老年高血压病人原发性醛固酮增多症的临床特点
车金娜1,李雪丽1,曹彩霞,杨学成3,李丹4,钟丽娜
(青岛大学附属医院,山东 青岛 266003 1 内分泌科; 2 老年医学科; 3 泌尿外科; 4 心血管内科)
最新统计数据显示,我国65岁以上老年人占总人口的11.4%,其中50%以上的老年人患有高血压[1]。高血压是我国最常见的慢性病之一,同时是脑卒中、心肌梗死等心脑血管疾病死亡的主要危险因素。原发性醛固酮增多症(PA)是继发性高血压的常见病因,其在高血压病人中的发病率达10%,而在难治性高血压中的发病率高达17%~23%[2-3]。PA病人心脏、肾脏等靶器官损害较为严重,极大影响了人们的健康[4-5]。目前关于老年高血压人群中PA的研究较少。本研究分析老年高血压人群PA的临床特点,以提高对其认识和重视。
1 资料与方法
1.1 一般资料
收集2000年1月—2018年12月我院收治并确诊的PA病人329例的临床资料, PA的诊断及分型诊断均采用2016年《原发性醛固酮增多症诊断治疗的专家共识》的标准[4]。所有病人入院前均已停用对血浆醛固酮与肾素活性比值(ARR)影响较大的药物,包括醛固酮受体拮抗剂、保钾利尿剂、排钾利尿剂及甘草提炼物等至少4周;停用血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂、钙离子拮抗剂等药物至少2周。
1.2 研究方法
所有病人均行PA筛查,用化学发光法检测血浆立位醛固酮(ALD)、立位肾素活性(PRA);并于入院时进行病史采集,测量身高、体质量、血压,计算体质量指数(BMI)。所有病人均于入院次日清晨采集空腹静脉血,检测空腹血糖(FPG)、空腹胰岛素(FINS)、血钾、血钠、血肌酐(Scr)、皮质醇以及促肾上腺皮质激素(ACTH),并计算胰岛素抵抗指数(HOMA-IR)。HOMA-IR=FINS(mU/L)×FPG(mmol/L)/22.5,以HOMA-IR≥2.69作为胰岛素抵抗(IR)诊断标准[6]。肾小球滤过率(eGFR)=175×Scr-1.234×年龄-0.179(女性×0.79)[7]。左心室心肌肥厚的诊断依据心电图及超声心动图。肾脏损害的诊断参照美国肾脏协会轻度肾损害的诊断标准[8],eGFR<60 mL/(min·1.73 m2)。根据年龄分为老年组(年龄≥65岁)和非老年组(年龄<65岁),回顾性分析并比较两组病人临床表现及生化指标的差异。
1.3 统计学分析
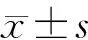
2 结 果
2.1 两组临床特点比较
与非老年组比较,老年组PA病人BMI偏高,eGFR及舒张压偏低,HOMA-IR≥2.69及发生低钾血症(血钾<3.5 mmol/L)的例数均高于非老年组,差异有显著性(t=-1.989~4.505,χ2=5.654~16.912,P<0.05);老年组中糖尿病、冠心病、脑卒中及肾功能损害发生率较非老年组增高,差异有显著性(χ2=5.105~44.525,P<0.05),两组间性别、收缩压、Scr、皮质醇、ACTH、FPG、FINS、HOMA-IR、血钾、立位ALD、立位PRA、ARR、结节直径、射血分数等指标比较差异无统计学意义(P>0.05)。见表1、2。
2.2 老年组与非老年组各临床指标之间的相关性
非老年组年龄与舒张压呈负相关(r=-0.245,P<0.05),胰岛素与eGFR呈负相关(r=-0.363,P<0.05),胰岛素与Scr水平呈正相关(r=0.411,P<0.05),而血钾水平与结节直径呈负相关(r=-0.312,P<0.05)。老年组舒张压(r=-0.211,P<0.05)、eGFR(r=-0.203,P<0.05)均与年龄呈负相关,血钾与胰岛素水平(r=-0.361,P<0.01)、eGFR(r=-0.212,P<0.05)呈负相关。
3 讨 论
既往研究发现,ALD过多是导致心肌肥厚、心力衰竭和肾功能受损的重要危险因素[4]。相比原发性高血压,PA病人发生脑卒中及心血管疾病等并发症的风险更高,糖尿病及代谢综合征(MS)易感性明显增强[9-10]。然而,目前针对老年人群中PA病人的研究相对较少,在我国及亚洲人群的研究更为少见。国外有研究发现在老年PA病人中持续性高血压常见,对心脏、颅脑、肾脏等高血压靶器官损害更为严重,因此对老年PA病人的早期诊断及治疗至关重要[11]。本研究旨在探讨我国老年PA病人的临床特点及生化指标,为老年PA病人的早期筛查及诊治提供依据。
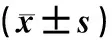
表1 老年组与非老年组一般资料及生化指标检测结果比较
注:*数据为M(P25,P75),IHA为特发性醛固酮增多症。

表2 老年组与非老年组PA病人并发症比较(例(χ/%))
TAKEDA等[11]研究发现,老年PA病人易发生心脑血管疾病,预后较差。本研究也显示,老年组PA病人冠心病及脑卒中的发生率明显高于非老年组,与TAKEDA等[11]的结果相一致。由于ALD和盐皮质激素受体的过度活化,对血管壁产生氧化应激、炎症刺激、纤维化和重构等有害影响,因此与原发性高血压相比较,PA病人易发生脑卒中及心血管疾病[9,12-13]。此外,有研究发现PA病人易出现左心室肥大,心肌收缩力下降,冠心病的发生率增加[14]。有Meta分析显示,PA病人发生充血性心力衰竭的概率是原发性高血压病人的2倍[15-17]。除了对心血管系统有影响外,大量研究也证实ALD可导致肾脏损害,并且肾脏损害与ALD的浓度密切相关[18]。相比原发性高血压,PA病人肾脏损害的发生率更高[19]。国外研究显示,老年PA病人低钾血症及肾功能损害的发生率要明显高于非老年病人[11,20]。本研究也显示,与非老年组比较,老年组PA病人血钾偏低,eGFR明显降低,肾功能损害的发生率增高;相关分析显示,老年组PA病人血钾与eGFR呈负相关,提示除了ALD影响肾功能外,低钾血症也可加重肾功能损害,这可能与低钾血症引起肾小管间质损伤有关[21]。但老年PA病人肾功能损害的具体机制需要进一步研究。
随着临床PA检出率的提高,PA病人中ALD的升高所致的代谢异常成为临床和基础研究的热点。本课题组前期研究显示,MS病人血浆ALD水平较高,且与高胰岛素血症及IR呈显著正相关,并在高血压和心血管并发症的发生中起到一定作用;对脂肪细胞的IR模型研究显示,ALD可能通过P13K-AKT信号通路导致IR的发生[22-23]。大量研究证实,PA病人糖尿病和MS的发病率高于原发性高血压病人,主要是由于PA病人腹型肥胖、IR、高血压所占比例升高所致[10,24-26]。本研究也表明,与非老年组比较,老年组PA病人BMI较高,平均值为(25.44±3.53)kg/m2;糖尿病的发生率更高,且更易发生IR,IR发生率可达82%。本文相关性分析显示,老年组PA病人血钾与胰岛素水平呈负相关,提示低钾血症对IR也有一定的影响。近年来也有研究发现,PA代谢异常与其分型也有一定的相关性,IHA病人腹型肥胖更严重,中重度高血压占比更高,易发生IR,而且糖尿病患病率明显高于醛固酮瘤及原发性高血压病人[27-28]。本文研究结果也显示老年组PA病人以IHA为主,约占98%。但关于PA分型与代谢异常的相关性需进一步探讨。
既往PA一直被认为是少见病,在高血压人群中占比不到1%,随着诊断技术的提高,PA的检出率明显提高,许多临床症状不典型的亚临床PA病人也得以检出。有研究显示,在正常血钾水平的高血压病人中PA占比高达9.5%[29]。本课题组对高血压并发肾上腺意外瘤(AI)的研究也表明,有相当数量的病人表现为亚临床PA,同时该研究显示醛固酮合成酶(CYP11B2)、促肾上腺皮质激素受体及相关转录调节因子在AI亚临床PA鉴别中有一定的意义[30]。但目前针对老年高血压人群中PA的研究相对较少,老年PA病人起病隐匿,临床表现不典型且病程更长,对老年人心脑肾等靶器官损害更为严重。此外,老年人往往合并多系统疾病,治疗难度增大,因此我们应重视老年高血压病人PA的筛查及诊治。
综上所述,老年高血压PA病人易合并糖尿病及心脑血管疾病,长期低钾血症及高血压引起的肾功能损害更为严重,且易发生IR,预后差,因此对老年PA病人的早期诊治及干预至关重要。

