动脉粥样硬化病人血清APOC3检测及其对TNF-α和JAM-1表达影响
(阜外华中心血管病医院(河南省人民医院)血管外科,河南 郑州 450000)
心血管系统疾病的致死率在全部疾病中位居首位,心血管疾病严重危害着人类的生命健康[1]。动脉粥样硬化是一种常见的发生于心血管系统的疾病,也是心血管疾病发生的征兆[2]。高血压、高脂血症、糖尿病、肥胖等均能够引发动脉粥样硬化[3]。冠心病是动脉粥样硬化导致的较为典型的心血管疾病[4]。动脉粥样硬化的发病机制是目前研究的热点。载脂蛋白C3(APOC3)广泛存在于人体内,在循环血浆中稳定表达[5]。APOC3与冠心病、高血压、糖尿病等疾病的发生密切相关[6]。血管内皮细胞存在于血管的最内层,在动脉粥样硬化的发生过程中具有重要的作用,而APOC3是血管内皮细胞功能的障碍因子[7]。目前,关于APOC3对血管内皮细胞肿瘤坏死因子-α(TNF-α)与连接黏附分子-1(JAM-1)表达的影响还不明确。本研究分别收集了冠状动脉有狭窄和无狭窄心脏病病人外周血清,检测APOC3的表达水平,并以血管内皮细胞为研究对象,探讨APOC3对TNF-α与JAM-1表达影响,以期为进一步研究动脉粥样硬化的发病机制奠定基础。现将结果报告如下。
1 资料与方法
1.1 一般资料
2017年12月—2018年10月,选取在我院行手术或冠状动脉造影检测的心脏病病人80例,男性42例,女性38例,平均年龄48岁。其中有冠状动脉狭窄者56例,无狭窄者24例。均符合文献的诊断标准[8]。冠状动脉狭窄病人与无狭窄者的年龄、性别等均匹配。本研究病人及家属均知情同意,并经过医院伦理委员会批准。
1.2 实验材料
人脐静脉血管内皮细胞购自美国ATCC公司。APOC3、TNF-α试剂购自Prepro Tech公司;TNF-α、JAM-1、GAPDH单克隆抗体购自美国CTS公司;人APOC3 ELISA检测试剂盒购自上海超研生物科技有限公司;CO2培养箱购自美国Thermo公司;倒置显微镜购自日本尼康公司。实时荧光定量PCR(qRT-PCR)试剂盒、cDNA合成试剂盒均购自天根生化科技(北京)有限公司;CFX 96Touch荧光定量PCR仪、GelDoc 2000凝胶成像系统均购自美国Bio-Rad公司。
1.3 实验方法
1.3.1血清APOC3水平检测 采集80例心脏病病人空腹12 h后的外周静脉血3 mL。血液凝固后分离出血清。采用ELISA法检测血清中APOC3含量。按照试剂盒说明书操作。
1.3.2细胞培养 取出保存于液氮罐中的人血管内皮细胞,置37 ℃培养箱中融化后,加入含有体积分数0.10胎牛血清(FBS)的DMEM细胞培养液,混匀后以1 000 r/min离心10 min,弃上清液,用5 mL细胞培养液悬浮细胞,接种到细胞培养瓶中,置37 ℃、体积分数0.05 CO2培养箱中培养。48 h后,观察细胞约为90%融合时,弃掉细胞悬浮液,用PBS洗涤细胞2次。加入2.5 g/L胰蛋白酶消化细胞,离心后用细胞培养液悬浮细胞,接种到细胞培养瓶中继续培养。
1.3.3qRT-PCR检测人血管内皮细胞中TNF-α、JAM-1 mRNA表达 取培养至对数生长期的人血管内皮细胞,加入胰蛋白酶消化细胞后,再加入细胞培养液悬浮细胞,接种到12孔细胞培养板中,调整细胞密度使每孔中加入的细胞数为4×105个。置37 ℃、体积分数0.05 CO2培养箱中培养24 h后,弃上清液。在细胞中分别加入终浓度为0、15、30、60、120 mg/L的APOC3作用16 h后,用PBS洗涤细胞2次。加入Trizol细胞裂解液,提取细胞RNA,按照荧光定量PCR试剂盒说明书分别检测TNF-α、JAM-1 mRNA水平。所用引物及其序列见表1。实验重复3次,每次3个复孔。

表1 qRT-PCR引物及其序列
1.3.4Western blot检测人血管内皮细胞TNF-α、JAM-1蛋白表达 人血管内皮细胞分别经0、15、30、60、120 mg/L的APOC3作用16 h后,收集细胞,加入细胞裂解液,放置于冰上裂解30 min。4 ℃下12 000 r/min离心15 min,取蛋白上清至新EP管中,用BCA蛋白浓度检测试剂盒检测提取的蛋白浓度。蛋白样品与Loading buffer煮沸变性后,加入到SDS-PAGE凝胶孔中,每孔中加入变性蛋白样品50 μL,以初始电压为80 V电泳30 min后,调整电压为120 V至电泳结束。取出蛋白凝胶在4 ℃下转印至PVDF膜上。经50 g/L脱脂奶粉封闭后,依次与一抗(1∶500)、二抗(1∶1 000)反应后,转移至暗室中滴加显色液,曝光后以GAPDH为内参,分析蛋白表达率。实验重复3次,每次3个复孔。
1.3.5TNF-α对人血管内皮细胞JAM-1mRNA和蛋白表达影响 取培养至对数生长期的人血管内皮细胞,弃细胞培养液,用胰蛋白酶消化后,接种到12孔细胞培养板中,置37 ℃、体积分数0.05 CO2培养箱中培养24 h后,将细胞培养液换成含有终浓度为0、1.0 mg/L的TNF-α细胞培养液,培养16 h后收集细胞。采用qRT-PCR、Western blot检测细胞中JAM-1mRNA和蛋白表达水平。步骤同1.3.3和1.3.4。实验重复3次,每次3个复孔。
1.4 统计学处理
2 结 果
2.1 病人血清中APOC3含量检测
结果表明,56例冠状动脉有狭窄病人血清APOC3为(9.36±0.95)g/L,明显高于24例无狭窄病人的(7.42±0.74)g/L,差异有显著性(t=2.790,P<0.01)。
2.2 APOC3对血管内皮细胞JAM-1 mRNA和蛋白表达影响
采用15、30、60、120 mg/L的APOC3作用后,血管内皮细胞中JAM-1mRNA和蛋白水平均高于0 mg/L者;血管内皮细胞中JAM-1mRNA和蛋白水平随着15、30、60 mg/L 的APOC3作用浓度的增加而增加(F=69.633、178.421,t=9.137~17.473,P<0.01)。而120 mg/L的APOC3作用后,细胞中JAM-1mRNA和蛋白水平较60 mg/L者有所下降。见表2。
2.3 APOC3对血管内皮细胞TNF-α mRNA和蛋白表达影响
采用15、30、60、120 mg/L的APOC3作用16 h后,血管内皮细胞中TNF-αmRNA和蛋白均明显高于0 mg/L者(F=28.746、50.426,P<0.01)。TNF-αmRNA和蛋白水平没有随着APOC3作用浓度的升高而增加。见表2。
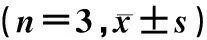
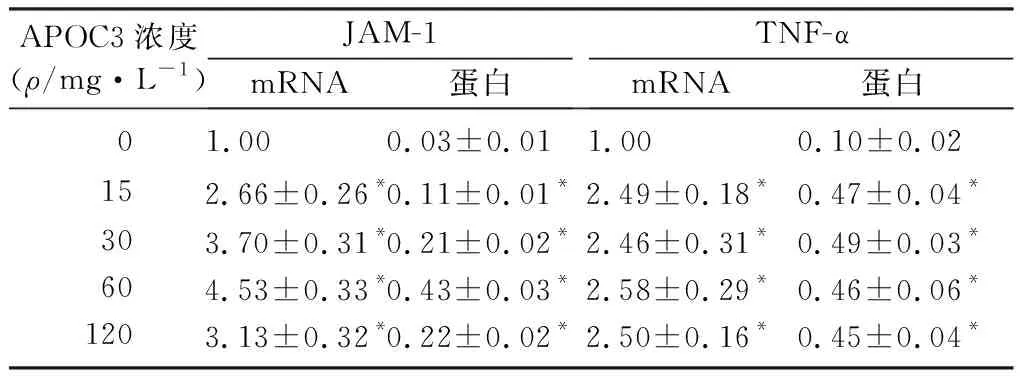
APOC3浓度(ρ/mg·L-1)JAM-1mRNA蛋白TNF-αmRNA蛋白 01.00 0.03±0.01 1.00 0.10±0.02 152.66±0.26*0.11±0.01*2.49±0.18*0.47±0.04*303.70±0.31*0.21±0.02*2.46±0.31*0.49±0.03*604.53±0.33*0.43±0.03*2.58±0.29*0.46±0.06*1203.13±0.32*0.22±0.02*2.50±0.16*0.45±0.04*
注:不同浓度之间比较,F=28.746~178.421,P<0.001;与0 mg/L比较,*t=9.137~21.909,P<0.01。
2.4 TNF-α对血管内皮细胞中JAM-1 mRNA和蛋白表达影响
采用1.0 μg/L的TNF-α作用后,血管内皮细胞中JAM-1mRNA和蛋白水平均明显高于0 μg/L者,差异有显著性(t=8.167、15.589,P<0.01)。见表3。
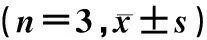

TNF-α浓度(ρ/μg·L-1)JAM-1 mRNAJAM-1蛋白0 1.00 0.17±0.021.02.35±0.15* 0.34±0.03*
与0 μg/L 浓度比较,*t=8.167、15.589,P<0.01。
3 讨 论
动脉粥样硬化是一种常见的动脉硬化血管疾病。动脉粥样硬化形成与复合糖类和脂质的聚集、血栓的形成、纤维组织增生的出现、动脉中层的钙化等有关。当病变逐渐累积到阻塞动脉腔时,由该动脉供应的组织器官出现缺血甚至坏死[9]。动脉粥样硬化血管弹性减弱,管壁上出现类似于米粒样的脂类[10-11]。另外,动脉粥样硬化会导致动脉腔变窄,进而引发高血压心脏病的发生。
载脂蛋白是指血浆脂蛋白中的蛋白成分,可以分为A、B、C、D、E等5类[11]。载脂蛋白是脂类物质的运输载体,其中部分载脂蛋白还具有脂蛋白代谢酶激活、受体的识别等作用[12]。载脂蛋白C具有水溶性,能够调控肝脂酶和脂蛋白脂酶的活性[13]。APOC3基因全长为3.1 kb,位于第11号染色体上[14]。临床研究结果表明,APOC3能够引起冠心病的发生,与高血压、高脂血症、肥胖等均有密切关系[15]。过表达APOC3小鼠的高三酰甘油血症明显加重,经过饲喂高脂饲料后,小鼠出现脂肪肝变性和明显的胰岛素抵抗[16]。已有研究结果显示,冠状动脉狭窄病人血清总APOC3浓度明显升高[17]。本文研究结果也显示,APOC3在冠状动脉狭窄病人血清中的表达明显增高。
免疫炎症是目前研究较多的动脉粥样硬化的发病机制。脂质的积累和炎症的共同长期作用导致动脉粥样硬化的发生[18]。APOC3、TNF-α、JAM-1等均与动脉粥样硬化的发生有关[19]。有研究结果表明,JAM-1在动脉粥样硬化斑块组织中的表达增高[20]。TNF-α是一种具有多重作用的细胞因子,具有调节血管内皮功能的作用,与动脉粥样硬化的形成密切相关[21]。本研究用不同浓度的APOC3作用血管内皮细胞,观察TNF-α、JAM-1mRNA和蛋白表达的变化。本文结果表明,TNF-α、JAM-1mRNA和蛋白表达均上调。其中JAM-1mRNA和蛋白表达水平在一定浓度范围内呈现浓度依赖,而TNF-αmRNA和蛋白表达水平并没有出现浓度依赖。采用TNF-α作用后,血管内皮细胞中JAM-1mRNA和蛋白表达升高,提示APOC3可能通过诱导TNF-α表达进而促进血管内皮细胞中JAM-1的表达。
综上所述,APOC3在动脉粥样硬化病人血清中表达上调。APOC3可能通过诱导TNF-α表达进而促进血管内皮细胞中JAM-1的表达,APOC3可能是炎症、细胞黏附的连接分子,有望成为预防和治疗动脉粥样硬化的靶点。本研究为进一步探讨动脉粥样硬化的发病机制奠定了基础,为治疗动脉粥样硬化提供了新思路。由于动脉粥样硬化发病机制极其复杂,对APOC3在动脉粥样硬化中的具体作用机制,有待于进一步研究。

