黄芪多糖对糖尿病心肌病大鼠心肌细胞凋亡的影响
(青岛大学附属医院老年医学科,山东 青岛 266003)
糖尿病心肌病(DCM)是由糖尿病引起的心肌特异性病变,是糖尿病病人致残致死的主要原因[1]。
DCM的病理机制错综复杂,包括代谢紊乱、慢性低度炎症、微血管结构及功能障碍、自主神经功能紊乱、氧化应激、线粒体功能障碍等[2]。研究表明,心肌细胞凋亡增加在DCM的发生发展中起重要的作用[3]。自噬是指通过溶酶体途径选择性降解细胞组分,继而实现细胞自身代谢需要及循环更新胞质成分的过程,在某些情况下,自噬激活被认为具有心脏保护作用[4]。有研究表明,通过促进自噬可缓解凋亡,防治DCM,提示调控自噬可能是治疗DCM的有效策略[5]。黄芪多糖(APS)是黄芪的主要活性成分之一,不仅具有免疫调节、抗氧化应激、抗肿瘤、双向调节血糖、保护心肝肾等多种药理活性,还可改善DCM[6]。我们的前期研究表明,APS通过抑制内、外源性凋亡途径以及内质网应激,抑制心肌细胞凋亡,改善DCM大鼠心功能[7]。近年来的研究结果表明,APS可抑制MAP4K3表达和mTOR信号的下传,而上调自噬,通过恢复自噬通量可改善心肌细胞功能[8]。然而,APS是否可通过影响DCM大鼠心肌细胞自噬进而改善心肌细胞凋亡尚不清楚。因此,本研究用APS进行干预,探讨其对DCM大鼠心肌细胞凋亡和自噬途径的影响。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级健康雄性SD大鼠30只,7~8周龄,体质量200~250 g,购自济南朋悦实验动物繁育有限公司。饲养条件:室温(25±1)℃,湿度(50±10)%,明暗周期12 h,自由饮水和摄食。所有动物相关实验操作均获得青岛大学动物福利和伦理管理委员会的批准。
1.1.2主要药物及试剂 APS(上海源叶生物科技有限公司,纯度≥98%);链脲佐菌素(STZ,Sigma-Aldrich);柠檬酸钠缓冲液(0.1 mol/L,pH值4.5,索莱宝公司);RIPA裂解液和苏木精-伊红染色试剂盒(碧云天公司);LC3和p62抗体(Cell Signaling Technology,USA);GAPDH抗体(Abcam,USA);BCA蛋白浓度测定试剂盒(索莱宝公司);TUNEL细胞凋亡检测试剂盒(Roche,USA)。
1.1.3仪器和设备 罗氏优越型血糖仪(ACCU CHEK Advantage,Roche, Germany);Vevo®2100超高分辨率小动物彩色多普勒超声实时影像系统(VisualSonics,Canada);电泳仪(Bio-Rad,USA);Image-Pro Plus 6.0图像分析软件(Media Cybernetic,USA);石蜡切片机(Leica RM2265);全功能微孔板检测仪(BIO-TEK,USA);奥林巴斯光学显微镜(Olympus BX53,Japan)。
1.2 实验方法
1.2.1动物分组及处理 所有大鼠适应性饲养1周,禁食不禁水12 h后,随机分为正常对照组(NC组)、DCM组和APS治疗组(APS组),每组10只。DCM组和APS组大鼠一次性腹腔注射10 g/L的STZ溶液50 mg/kg[9](注射前用0.1 mol/L、pH值4.5的柠檬酸钠缓冲液在冰上避光配制,现配现用)以诱导1型糖尿病模型,NC组大鼠腹腔注射等体积的柠檬酸钠缓冲液。分别于注射后第3、7天,禁食12 h后从尾静脉采血测空腹血糖,空腹血糖≥16.7 mmol/L且伴有“三多一少”症状者视为造模成功。同时,参考既往研究[10],APS组一次性灌胃给予APS溶液1 g·kg-1·d-1进行干预,而NC组和DCM组灌胃等体积的生理盐水,连续干预16周。
1.2.2血糖和体质量监测 动物自饲养开始,于每周末同一时间称量并记录大鼠的体质量,在禁食12 h后经尾静脉采血测空腹血糖。
1.2.3超声心动图评估心功能 实验16周后,采用体积分数0.03异氟烷雾化吸入麻醉大鼠,由同一专业人员使用小动物超声成像系统检测经胸二维超声心动图,获得以下心功能指标:左心室舒张末期直径(LVEDD)、左心室收缩末期直径(LVESD)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、缩短分数(FS)和射血分数(EF)。重复测量6个连续的心动周期。
1.2.4心肌组织病理观察 心功能评估结束后,腹腔注射水合氯醛3 mL/kg麻醉大鼠,迅速分离出心脏,用大量生理盐水洗去其内残留血液后,将心脏沿心室中间横向平分,取部分左心室组织浸泡于40 g/L多聚甲醛中固定24 h以上,4 μm石蜡切片后,行苏木精-伊红、TUNEL染色,在光学显微镜下观察相关病理改变。
1.2.5Western blot检测心肌组织内p62和LC3蛋白表达 使用RIPA裂解液提取心肌组织总蛋白,采用BCA法测定总蛋白浓度[11]。根据测试结果,将样品浓度调至1 g/L,并加入适量4×SDS上样缓冲液,95 ℃变性10 min。SDS-PAGE分离蛋白,并将蛋白转至PVDF膜上。牛奶封闭膜2 h,以TBST洗膜3次后,加相应的一抗室温下孵育2 h,再洗膜3次,然后加与一抗结合的二抗室温下孵育1.5 h。以TBST洗膜3次后,使用ECL显影剂显影相关蛋白条带,用Image J图像分析软件分析灰度值,计算p62和LC3蛋白的相对表达量。
1.3 统计学分析
2 结 果
2.1 各组大鼠一般状态评估
除去造模失败、死亡及状态不佳不合格大鼠后,每组有6只大鼠纳入实验研究及数据分析。STZ注射后,DCM组和APS组大鼠出现明显的多饮、多尿、多食等糖尿病症状,DCM组大鼠体质量较NC组明显下降,血糖较NC组明显升高,说明模型建立成功。APS干预后,与DCM组相比,APS组大鼠体质量明显增加,血糖明显降低,说明APS可改善糖尿病大鼠的体质量和血糖。
2.2 各组大鼠心功能比较
与NC组相比,DCM组大鼠LVEDD、LVESD、LVESV、LVEDV显著增大,EF、FS显著下降(F=5.584~342.701,t=3.125~18.648,P<0.05),提示其心功能下降。而APS干预可显著减小LVEDD、LVESD、LVESV、LVEDV,并抑制FS的下降(t=2.503~13.416,P<0.05),说明APS干预可一定程度改善DCM大鼠心功能。见表1。
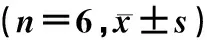
表1 各组大鼠心功能相关参数比较
与NC组相比,F=5.584~342.701,*t=3.125~18.648,P<0.05;与DCM组相比,#t=2.503~13.416,P<0.05。
2.3 各组大鼠心肌组织病理学改变
NC组大鼠心肌细胞完整,肌纤维排列有序,无凋亡及炎性细胞浸润。DCM组大鼠心肌组织发生明显改变,出现心肌细胞肥大和排列紊乱、肌纤维断裂、细胞边界不清和大小不一。APS组大鼠心肌组织排列较DCM组整齐,心肌细胞凋亡减少,炎症较轻,说明APS可显著改善DCM心肌组织病理改变。
2.4 APS对DCM大鼠心肌细胞凋亡影响
干预16周后,TUNEL染色结果显示,NC组、DCM组和APS组的细胞凋亡率分别为(11.48±2.44)%、(55.84±7.84)%和(16.31±4.06)%。与DCM组相比,APS组大鼠心肌细胞凋亡率明显下降(F=23.931,t=9.157,P<0.05),说明APS干预可抑制DCM大鼠心肌细胞凋亡。
2.5 APS对DCM大鼠心肌组织自噬相关蛋白表达影响
干预16周后,Western blot检测结果显示,相较于NC组,DCM组大鼠心肌组织内LC3蛋白表达显著降低,而p62蛋白表达显著升高(F=11.341、22.155,t=4.439、9.409,P<0.05),表明在DCM大鼠中心肌细胞自噬受到抑制。而与DCM组相比,APS组大鼠心肌组织内LC3蛋白表达上调,p62蛋白表达下降,差异均有统计学意义(t=3.714、9.682,P<0.05),说明APS干预可恢复DCM大鼠心肌细胞内自噬水平,从而发挥保护作用。见表2。
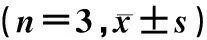
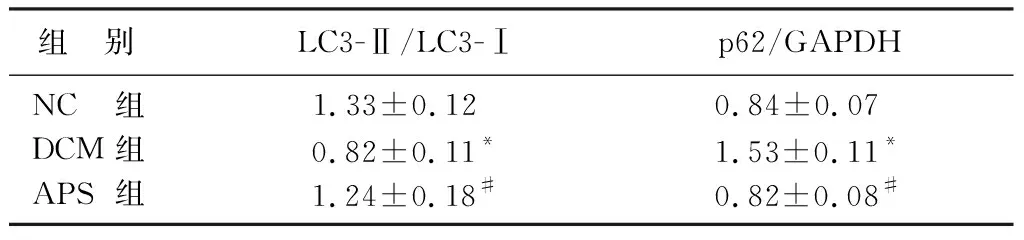
组 别 LC3-Ⅱ/LC3-Ⅰp62/GAPDHNC组1.33±0.12 0.84±0.07 DCM组0.82±0.11*1.53±0.11*APS组1.24±0.18#0.82±0.08#
与NC组相比,F=11.341、22.155,*t=4.439、9.409,P<0.05;与DCM组相比,#t=3.714、9.682,P<0.05。
3 讨 论
糖尿病引起的心血管并发症的发病率及死亡率在全球逐年上升,并带来高经济负担,值得重视[12]。其中,DCM是糖尿病病人发生心力衰竭的主要原因,然而,DCM的确切病理生理机制尚不清楚。DCM发病缓慢隐匿,早期即发生结构和功能异常,包括左心室肥大、心肌纤维化、舒张功能障碍和细胞信号传导异常[13]。本研究结果显示,DCM组大鼠LVEDD、LVESD、LVESV、LVEDV增大,EF、FS下降,表明其心功能下降;而苏木精-伊红染色提示DCM大鼠心肌结构发生异常改变,TUNEL染色提示心肌细胞凋亡增加。我们的前期研究显示,APS可有效缓解DCM的心肌细胞凋亡,改善大鼠心功能[7]。本实验APS组大鼠心脏超声相关指标的改变进一步表明,APS可改善DCM大鼠心功能;苏木精-伊红及TUNEL染色表明,APS组大鼠心肌结构及心肌细胞凋亡得到有效改善。但其具体的分子机制尚不明确,有待进一步探讨。
自噬是一种具有高度保守性、可选择性地降解过多或有害胞质成分(如受损的线粒体或蛋白多聚体)的过程,对细胞起保护作用[14]。有关研究表明,在DCM中自噬不足,而上调自噬可阻碍DCM进展[15]。AMPK的激活可恢复心脏自噬,可防止心肌细胞凋亡,改善心功能[16]。在肝脏中,APS以与二甲双胍类似的方式抑制促凋亡的内质网应激和上调受抑制的自噬,恢复肝功能[17]。此外,APS预处理可恢复因阿霉素抑制的心脏自噬,减轻心脏损伤,改善心功能[8]。LC3参与自噬体形成到成熟的各个阶段,是目前研究自噬最常用的标志物,主要包括LC3-Ⅰ(胞质状态)和LC3-Ⅱ(膜结合状态)。当自噬发生时,LC3-Ⅰ被活化,结合磷脂酰乙醇胺转变为LC3-Ⅱ,促进自噬体形成及成熟[14],LC3-Ⅱ的变化水平与自噬程度呈正相关,可部分反映自噬水平。此外,在选择性自噬中,p62作为自噬受体被特异性招募至自噬体内降解,因此也常被作为检测自噬水平的指标。目前,采用Western blot方法检测LC3-Ⅱ的变化及辅助性检测p62水平是评估自噬的主要方法[18]。本文研究通过Western blot检测表明,DCM组大鼠心肌细胞内LC3蛋白表达较NC组显著降低,伴随p62蛋白表达升高,表明DCM组心肌细胞自噬受到抑制;而APS干预后,与DCM组相比,APS组大鼠心肌组织内LC3蛋白表达上调,p62蛋白表达下降。提示APS可能通过自噬途径有效减少DCM心肌细胞凋亡。
综上所述,APS能够有效恢复自噬活性,减轻糖尿病所致的心肌细胞凋亡。

