褐藻胶寡糖对D-半乳糖诱导小鼠骨质疏松的作用
(青岛大学附属医院老年医学科,山东 青岛 266100)
骨质疏松具有骨微观结构退行性改变、骨量减少和骨密度降低的特点,导致骨强度降低[1]、骨脆性增加[2]及骨折风险增加[3],引起了老龄化社会的广泛关注。氧化应激学说是衰老的重要机制之一[4],该学说认为活性氧(ROS)的积聚超过机体的清除能力造成DNA损伤、激活氧化应激,从而导致衰老及衰老相关疾病的发生。ROS在体内积聚可激活核因子κB受体活化因子配体(RANKL)信号通路,导致骨吸收增加。RANKL信号通路被认为是促进破骨细胞活化的主要靶点,可激活多种下游信号通路[5],从而促进骨吸收和破骨细胞分化过程。长期注射D-半乳糖(D-gal)可导致实验动物产生一系列类似于自然老化的病理变化,如认知障碍、氧化应激和骨量减少等[6]。用D-gal诱导建立亚急性衰老模型具有周期短、价格低廉、操作简便、结果稳定可靠等优点,已广泛应用于衰老机制研究和抗衰老药物筛选。褐藻胶寡糖(AOS)具有较高的生物活性,如抗炎、抗氧化、抗凋亡、抗肿瘤等[7]。骨质疏松性骨折是导致老年人死亡的主要原因之一[8],因此骨质疏松症的早期预防、诊断和治疗十分重要,开发更有效的延缓骨质疏松症的药物具有重要意义。目前大多数骨质疏松研究侧重于绝经后妇女,而缺乏对老年男性骨质疏松的研究。故本实验采用D-gal诱导建立小鼠骨质疏松模型,探讨AOS对衰老雄性小鼠骨质疏松的作用及其可能的机制。
1 材料和方法
1.1 实验材料
健康雄性C57BL/6J小鼠45只,SPF级,8周龄,购自济南朋悦实验动物繁育有限公司,饲养于青岛大学医学部SPF级实验动物中心。饲养条件:12 h昼夜循环,室温(20±2)℃,相对湿度40%~60%,自由摄食物和水。动物实验操作均经青岛大学动物福利和伦理管理委员会批准,并且遵守中国动物保护委员会制订的《动物保护与使用指南》。P16小鼠单克隆抗体购自美国 Cell Signaling Technology公司,RIPA裂解液和BCA蛋白浓度测定试剂盒购自上海碧云天公司,逆转录试剂盒及Mix购自Roche公司。
1.2 实验方法
1.2.1动物分组及处理 45只小鼠适应性喂养1周后,随机分为对照组(Control组,A组)、模型组(D-gal组,B组)、D-gal+AOS低剂量组(D-gal+AOS-L组,C组)、D-gal+AOS中剂量组(D-gal+AOS-M组,D组)以及D-gal+AOS高剂量组(D-gal+AOS-H组,E组),每组9只。Control组小鼠颈背部皮下注射灭菌注射用水5 mL/(kg·d),其余组小鼠颈背部皮下注射D-gal 200 mg/(kg·d),连续8周。从D-gal注射第5周开始,AOS干预低、中、高剂量组分别给予AOS 50、100、150 mg/(kg·d)灌胃处理4周,Control组和D-gal组小鼠给予蒸馏水10 mL/(kg·d)灌胃处理4周。
1.2.2骨密度测量 药物干预完成后,取每组各3只小鼠的同侧股骨,采用双能X线骨密度仪(Dexa;Osteosys Primus,Korea)对整个股骨进行骨密度测量(扫描间距1.5 mm,扫描速度60 mm/s)。
1.2.3Western Blot检测P16和P67 phox蛋白表达 药物干预完成后,取每组各3只小鼠的股骨组织进行液氮研磨,将RIPA裂解液加入研磨好的股骨组织中提取蛋白,用BCA试剂盒检测蛋白浓度。提取的蛋白进行SDS-PAGE电泳,待溴酚蓝至分离胶底部时转移到PVDF膜上,凝胶成像系统成像后用Quantity One软件分析灰度值。
1.2.4RT-PCR检测股骨组织p47phox、gp91phox和RANKLmRNA的表达 药物干预完成后,取每组各3只小鼠的股骨组织进行液氮研磨,加Trizol 50~100 g/L,颠倒混匀室温放置30 min。4 ℃下以12 000 r/min离心5 min,弃沉淀,加1/5体积氯仿,充分震荡混匀后置于冰上静置5 min。4 ℃下以12 000 r/min离心15 min,将上清转移至新的1.5 mL EP管中。加入与上清等体积的异丙醇,充分震荡混匀,置于冰上静置10 min。4 ℃下以12 000 r/min离心10min,弃上清,加体积分数0.75的乙醇溶液悬浮沉淀。4 ℃下以12 000 r/min离心5 min,吸除上清,自然晾干后加入10 μL DEPC水溶解RNA。用Nanodrop分光光度计测定RNA浓度,用逆转录试剂盒将mRNA逆转录为cDNA。应用RT-PCR法进行扩增,扩增条件:95 ℃、600 s,95 ℃、10 s,60 ℃、10 s,72 ℃、15 s,共计40个循环;95 ℃、10 s,65 ℃、60 s,97 ℃、1 s。PCR引物及其序列见表1。
1.3 统计学方法
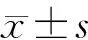

表1 PCR引物及其序列
2 结 果
2.1 各组小鼠股骨骨密度比较
与Control组相比较,D-gal组小鼠股骨骨密度明显下降;与D-gal组相比较,AOS干预各组小鼠股骨骨密度明显增加,差异均有统计学意义(F=46.853,P<0.05)。见表2。
2.2 各组小鼠股骨组织中P16和P67 phox蛋白表达比较
与Control组相比较,D-gal组小鼠股骨组织中P16和P67 phox蛋白表达增加;与D-gal组比较,AOS干预各组小鼠股骨组织中P16和P67 phox蛋白表达降低,差异均有统计学意义(F=50.862、156.943,P<0.05)。见图1、表2。
A:Control组,B:D-gal组,C:D-gal+AOS-L组,D:D-gal+AOS-M组,E:D-gal+AOS-H组。
图1 各组小鼠股骨组织中P16和P67 phox蛋白表达的Wes-tern Blot检测
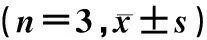
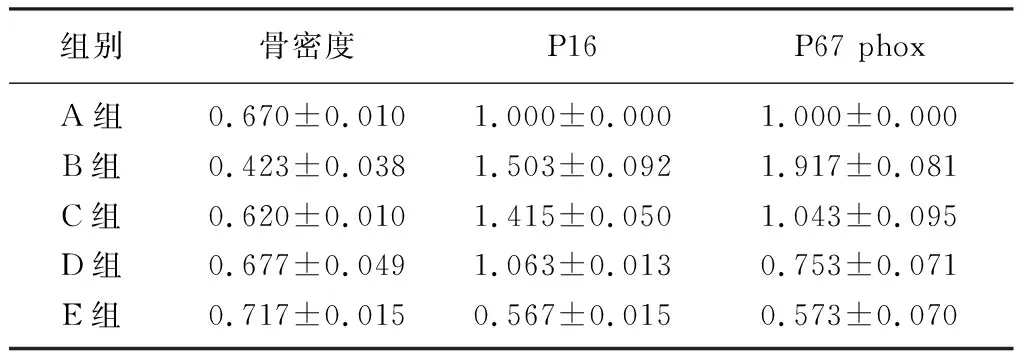
组别骨密度P16P67 phoxA组0.670±0.0101.000±0.0001.000±0.000B组0.423±0.0381.503±0.0921.917±0.081C组0.620±0.0101.415±0.0501.043±0.095D组0.677±0.0491.063±0.0130.753±0.071E组0.717±0.0150.567±0.0150.573±0.070
2.3 各组小鼠股骨组织中p47 phox、gp91 phox 和RANKL mRNA表达比较
与Control组相比较,D-gal组股骨组织中p47phox、gp91phox和RANKLmRNA表达增加;与D-gal组相比,AOS干预各组小鼠股骨组织中p47phox、gp91phox和RANKLmRNA表达降低,差异均有统计学意义(F=17.373~112.311,P<0.05)。见表3。
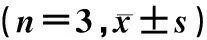
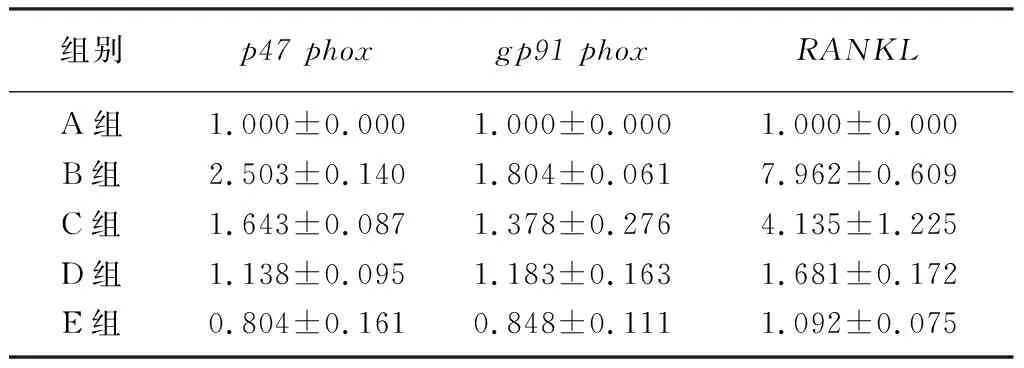
组别p47 phoxgp91 phoxRANKLA组1.000±0.0001.000±0.0001.000±0.000B组2.503±0.1401.804±0.0617.962±0.609C组1.643±0.0871.378±0.2764.135±1.225D组1.138±0.0951.183±0.1631.681±0.172E组0.804±0.1610.848±0.1111.092±0.075
3 讨 论
到2050年,65岁以上的老年人口将超过8亿。随着世界人口平均寿命的延长,衰老相关疾病如阿尔茨海默病[9]、骨质疏松[10]等的发病率和死亡率将明显增加,其造成的社会医疗负担也日益加重。骨质疏松症是一种与年龄相关的退行性疾病,严重影响人们的生活质量,导致老年人的死亡率增加。衰老可以引起骨皮质和骨小梁的矿化减少、孔隙度增加及骨密度降低等,导致骨质疏松和骨折的风险增加[11]。本文研究结果显示,D-gal组衰老性骨质疏松模型小鼠的股骨骨密度较Control组显著降低,而与D-gal组相比,AOS干预各组小鼠的股骨骨密度显著增加。说明AOS对D-gal诱导的骨质疏松有保护作用。P16作为细胞周期蛋白依赖性激酶抑制因子[12],在衰老和抑制肿瘤生长过程中起重要作用。P16在大多数啮齿动物和人体组织中的表达随年龄增长而显著增加[13]。本文结果显示,P16蛋白在D-gal组股骨中的表达增加,而与D-gal组相比,AOS干预各组小鼠股骨中P16蛋白的表达降低,说明AOS延缓了D-gal诱导的衰老进程。
氧化应激可诱导DNA损伤和细胞衰老,而抑制衰老可能是治疗骨丢失的有效方法。氧化应激与许多年龄相关疾病(骨质疏松、心血管疾病和神经退行性疾病等)有关,它可以破坏骨骼系统中骨吸收和骨形成的动态平衡,使骨硬度和强度降低,在骨质疏松的发生和发展中起重要作用[14]。ROS的一个主要来源是烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶,它可促进氧化应激的发生。本研究结果显示,D-gal组股骨中NADPH氧化酶亚基p67phox、p47phox和gp91phox的mRNA表达增加,而与D-gal组相比,AOS干预各组股骨中NADPH氧化酶亚基mRNA表达减少。表明AOS对衰老性骨质疏松的保护作用可能与氧化应激的抑制有关。
随着年龄的增长,破骨细胞介导的骨吸收和成骨细胞介导的骨生成之间失去平衡[15],当骨吸收超过骨形成时出现骨代谢失衡,引起骨量降低从而导致骨质疏松的发生。RANKL在破骨细胞生成中发挥着重要的作用[16],可以与核因子κB受体活化因子(RANK)结合激活信号通路,促进破骨细胞活化、分化和成熟等过程[17]。RANKL相关信号通路被认为是促进骨丢失和破骨细胞活化的主要靶点[18]。本研究结果显示,在衰老性骨质疏松D-gal组股骨中RANKLmRNA表达增加,而与D-gal组相比,AOS干预各组小鼠股骨中RANKLmRNA表达降低,说明AOS对衰老性骨质疏松的保护作用可能与RANKL通路抑制有关。
综上所述,AOS对D-gal诱导的C57BL/6J小鼠骨质疏松有保护作用,其机制可能与氧化应激和破骨细胞活化抑制有关,具体机制还需进一步研究。

