臭氧氧化技术在有色金属湿法冶金中的应用进展
张佳乐 王 天 张利波 曲洪涛 张 特 张利华 罗尧尧
(1.昆明理工大学 省部共建复杂有色金属资源清洁利用国家重点实验室,昆明 650093;2.昆明理工大学 非常规冶金教育部重点实验室,昆明 650093;3.昆明理工大学 冶金与能源工程学院,昆明 650093;4.云南驰宏锌锗股份有限公司,云南 曲靖 655011)
“臭氧”是由三个氧原子组成的分子(O3),是氧气的同素异形体,在水溶液中的标准氧化电位值2.07 V,仅次于氟(3.06 V)而高于高锰酸钾(1.70 V)、双氧水(1.78 V)、氯(1.36 V)和氧气(1.23 V)等常见氧化剂的氧化电位,在化学反应过程中可以表现出强氧化性能[1-3]。与其它传统氧化剂相比,臭氧氧化既可避免诸如高锰酸钾、二氧化锰、氟和氯等氧化时体系引入新的杂质源,也可避免如双氧水等氧化时溶液体系过度膨胀等问题[4],具有氧化效率高、选择性好、操作简便、适用范围广等显著优点,且反应后的尾气在水中可快速分解为氧气,不会引起二次污染,是一种新颖、高效的绿色强氧化剂。因此,臭氧氧化技术已在有色金属湿法冶金领域得到越来越广泛的应用和推广。本文重点介绍了臭氧氧化技术在贵金属、重金属、稀有金属及轻金属等有色金属湿法冶金领域的研究进展,并对其应用前景进行展望。
1 臭氧氧化作用原理
目前,关于臭氧氧化原理仍未有确定的结论,一般认为氧化作用主要分为直接氧化和间接氧化两种,其中,直接氧化是指以O3分子形式在水溶液中和其他物质发生氧化反应。通常情况下,在臭氧产生自由基过程受到抑制时,直接氧化反应会成为主要步骤,但是其反应速率较慢且氧化过程具有选择性,主要用来氧化硫化物、双键、活性芳香族等[5]。间接氧化是指由O3分子在水中分解产生氧化能力更强的单原子氧O和羟基自由基·OH等中间产物进行氧化,如反应式(1)~(5)所示,属于自由基型反应。溶液中引入OH-可以明显促进臭氧产生自由基的速度,而自由基的氧化速率接近离子扩散速率,是臭氧强氧化性的主要体现[6-8]。基于臭氧的强氧化能力,除铂、铱以外,在热力学上臭氧几乎可氧化元素周期表中包括金属在内的所有元素及难冶硫化矿物和砷化矿物等。
O3→O+O2
(1)
O+H2O→2HO·
(2)
(3)
(4)
(5)
2 在贵金属湿法冶金领域的应用
目前氰化浸出法是回收贵金属Au、Ag最常用的方法之一[9]。但由于金、银矿的大规模开采,易浸资源日渐枯竭,难处理矿将成为金银提取工业的主要资源。它们的主要特点就是贵金属以夹杂包裹或细小颗粒嵌布在矿物中,通过常规的氰化法难以有效浸出。因此一般需要进行氧化预处理,打开金属包裹体,提高贵金属的回收率。常用的预处理方法有焙烧、高压氧化、化学氧化和细菌氧化等[10-12]。这些预处理方法通常会造成环境污染,或具有所需资金要求过高、运营时间过长、操作过程繁琐等缺点。随着低电耗臭氧发生器和臭氧技术的发展,臭氧在水处理领域得到大规模应用,因此有许多学者在将臭氧用于难冶金银矿石进行预处理提高回收率方面也做了大量探索性的研究。
2Fe3++15O2
(6)
对于双难处理矿石,由于含碳物质和硫化物的双重存在,并且含碳材料可以包裹或吸附氰化物溶液中的金,因此金的回收率进一步受到限制。BAZHKO等[17]研究了臭氧氧化技术在双难处理矿石上的应用前景,并对硫氰酸盐氧化进行了分析。发现在酸性介质(pH值为1~2)中用臭氧预氧化双难处理矿石会使硫化物发生氧化反应并将金释放,含碳物质被破坏,在随后的氰化过程中提高了金的回收率。但另一方面,氰化物的消耗也增加,这是由于臭氧作用下硫化物氧化的中间产物如元素硫或硫代硫酸盐等与氰化物反应形成硫氰酸盐。相反,在较高pH值范围内(6~8)臭氧预氧化后虽然氰化物消耗及生成SCN-会减少,但金的回收率却没有显著提高。CARRILLO-PEDROZA等[18]也观察到了类似的现象。这主要是由于高pH值下,在氧化过程中硫化物表面形成的氢氧化铁胶体包裹抑制了硫化矿物的进一步溶解,影响了金的浸出率。同时通过臭氧对含氰化物/硫氰酸盐的金浸出浆液和滤液进行氰化物再生实验,证实臭氧氧化30 min后,超过99%的硫氰酸盐转化为氰化物后可用于氰化提金过程,但在低pH值条件下的臭氧氧化氰化物再生前景需进一步研究。
对于含硫、砷、碳等杂质较高的难处理金矿,在常规浸出条件下,回收率仅为20%~50%[19]。因此,在浸出之前一般也都需要进行预处理以提高回收率。钱方珺[20]通过研究发现,采用三氯化铁对高硫高砷难浸金精矿的预浸出过程中会产生易与金形成二次包裹的单质硫,阻碍三价铁离子与矿石的进一步接触,对后续氰化提金反应极为不利。为了阻止大量单质硫的产生,他们利用臭氧协助三氯化铁预氧化该精矿,预处理前后矿石的SEM图如图1所示。从图1可以看出,原矿中矿石多为块状,经臭氧和三氯化铁预处理后,金颗粒包裹层被打开,矿渣变得疏散,颗粒更加微细。KURNIAWAN等[21]以臭氧为氧化剂在水溶液中预氧化处理硫化金精矿,研究铜、铁、锌的溶解行为。在水溶液中矿物颗粒会和臭氧相互作用产生泡沫,这个就是强氧化剂臭氧溶解精矿中金属的现象。

图1 高硫高砷难处理原矿的SEM图像(a);臭氧协同三氯化铁处理后的SEM图像(b)[20]Fig.1 SEM images of refractory raw ore with high sulfur and high arsenic(a)and after treatment with ozone and ferric chloride(b)[20]
深红银矿(Ag3SbS3)因其矿床丰度和赋存性高而成为最重要的银矿之一,但由于银颗粒在硫化物晶格的镶嵌而不能有效地被氰化物溶解,造成银回收率较低。RODRGUEZ-RODRGUEZ等[22]选择采用臭氧预处理此含银硫化矿,矿石中80%以上的Ag被溶解,回收率得到显著提高。这是因为利用臭氧的强氧化性能够夺取深红银矿中的Sb、S元素,破坏Ag3SbS3的整体结构,使Ag更容易释放出来,化学反应式见式(7)。
Ag3SbS3+14.5O3+0.5H2O+2H+=
(7)
贵金属钌(Ru)很难用常规的酸、碱、氧化剂、甚至王水等将其溶解,因此它的高效快速溶解技术是贵金属冶金领域公认的难题之一[23]。MUN等[24]发现在核压反应水堆(PWR)安全壳内具有高放射性的气态RuO4,是钌与空气辐解形成的臭氧相互作用的结果,说明钌可被O3氧化形成气态RuO4。ARAI等[25]获得了从湿法炼铅的难溶残留物中高效回收钌的工艺。具体操作流程是首先将含铅难溶残留物进行熔炼,硝酸溶铅并过滤,将不溶的活性残渣及含铅滤液放入氧化装置内,通入臭氧并加热,钌的溶解率可高达99.8%。臭氧氧化工艺简化了Ru和Pb的相互分离的过程,可作为钌分离的有效手段。
3 在重金属湿法冶金方面的应用
铜、锌、锑、铅与臭氧接触会被强烈氧化。目前臭氧在重金属浸出、回收等方面均有一定的研究和应用,以下将对这些内容分别进行介绍。
随着高品位矿床的日益枯竭,从低品位矿物以及冶炼的废水废渣中回收有价金属具有长远的意义。郭学益等[26]在盐酸体系中采用臭氧协同氧气从低品位含锑复杂硫化矿中回收锑。结果表明,在85 ℃时臭氧协同氧化作用下,锑的浸出率可达86.1%,而用氧气氧化浸出时,锑浸出率仅为26.6%,说明臭氧的存在极大地促进了锑浸出反应的进行。在反应过程中,升高温度会导致臭氧分解,但由于反应速率和传质过程都较快,反应消耗和溶解在溶液中的臭氧量基本一致,臭氧分解并不影响反应的进行,并且升高温度可以增强气液固传质效率,提高锑的浸出率。在低温条件下,利用氧气做氧化剂时是化学反应速率较低的混合过程控制,而在臭氧存在时化学反应速度明显增快,表现为控制步骤为扩散控制。这一对比充分说明臭氧在低温时对反应过程的促进作用。
针对冶炼废水或废渣中的大量镍,CALZADO等[27]采用臭氧氧化—沉淀的方法从硫酸浸出冶炼污泥的浸出液中回收其中的镍,重点研究了沉淀pH值对产品组成和形貌等的影响。研究表明,在pH值较低时,只有钴被氧化沉淀,而镍依旧存在于溶液中。pH值≥6.8时,Ni(Ⅱ)形成Ni(OH)2悬浊物后被臭氧氧化形成β-NiOOH沉淀。两种产品的SEM图如图2所示。从图2可以看出,与Ni(OH)2沉淀物相比,利用臭氧处理后所得的β-NiOOH沉淀产物颗粒更致密,粒度更小。ICHLAS等[28]提出在处理含钴、锰等杂质的氢氧化镍沉淀的过程中,利用具有高氧化还原电位的臭氧代替过硫酸盐做氧化剂,将溶解的镍和杂质钴、锰分离,同时避免了钠离子的引入。结果表明,在pH值为5时,以臭氧为氧化剂反应2.5 h后,可以将钴、锰氧化到高价态再水解沉淀为钴氢氧化物和二氧化锰,实现了与镍的分离,而溶液中的镍需要在更高pH值条件下才能形成沉淀。

图2 Ni(OH)2的SEM形貌(a)和β -NiOOH的SEM (b)形貌[27]Fig.2 SEM morphologies of Ni(OH)2(a)and β -NiOOH(b)[27]
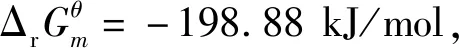
目前,硫化矿(如黄铁矿FeS2、黄铜矿CuFeS2、闪锌矿ZnS、方铅矿PbS等)是铜、锌、铅等重金属冶炼的重要资源。但是在这些矿石中硫与金属的结合力很强,使得金属通常不容易被有效地浸出提取,造成金属的回收率较低。用强氧化剂臭氧处理这类硫化矿时,可以增加硫的氧化,破坏硫化矿物的结构,从而使金属有效释放,进入浸出液。此外,可在有效缩短反应时间的同时不带入任何杂质,从而降低低品位硫化矿浸出的操作成本[32]。
MUBAROK等[33]探讨了臭氧作为氧化剂在硫酸介质中直接常压浸出硫化锌(闪锌矿)精矿的可行性,考察了酸浓度、进料气体喷射速率、矿石粒度分布、搅拌速率、温度、浆料密度等因素对锌提取效率的影响。结果表明,除搅拌速率外,其它影响因素对锌的溶解产生显著影响,且最终生成易于漂浮的独立元素硫,并且对锌的溶解没有明显的影响。通过浸出动力学分析发现,锌的浸出速率遵循收缩核模型,受表面反应控制。湛雪辉等[34]探索了在90 ℃的盐酸溶液中,以臭氧为氧化剂、三氯化铁为助浸剂联合浸出方铅矿精矿制备氯化铅的工艺。发现浸出过程中,方铅矿中的硫元素被臭氧和氯化铁深度氧化成硫酸盐,同时生成氯化铅和相应的硫酸盐,而Fe3+先被硫化铅还原成Fe2+,再被臭氧氧化为Fe3+,可实现三氯化铁的循环使用。该工艺铅的浸出率达99.5%,并且可以直接用于制备合格的氯化铅产品,具有工艺流程短、环境污染少、产品附加值高的优点。PEDROZA等[35]发现在酸性介质中,O3是氧化浸出黄铜矿(CuFeS2)最好的氧化剂,在其强氧化作用下,Cu2+被氧化形成CuSO4进入溶液,而Fe2+形成FeSO4后被臭氧氧化为Fe3+,Fe3+可以通过反应式(8)的反应促进黄铜矿的浸出。结果表明,超过70%的与铜相结合的硫能被氧化去除,从而提高铜及其他有价金属的浸出率。并且指出虽然利用臭氧需要消耗高电量,增加了浸出成本,高温条件下容易分解为氧气,导致铜浸出率降低,但与氧气的氧化相比,臭氧的强氧化性可以缩短浸出时间,并允许使用较低浓度的Fe3+和H2SO4,可减少试剂的消耗,降低从低品位黄铜矿中提取铜的成本。
CuFeS2+4Fe3+=Cu++Fe2++S0
(8)
4 在稀有金属和轻金属湿法冶金领域的应用
在稀有金属、轻金属等其它金属的制备、改性和除杂等方面,臭氧的绿色强氧化作用也非常明显。
工业上人们利用高价态Ce4+的氧化性去除附着于金属表面的放射性污染物,另外也用做催化剂去除废水中的有机物。但Ce4+在去除污染物的过程中被还原为Ce3+,导致污染物中Ce4+含量减少,氧化能力也减弱。因此,潘延波等[36]在硝酸介质中利用臭氧的强氧化性将Ce3+氧化为Ce4+,提高了去污液的氧化能力。利用双膜理论研究臭氧氧化Ce3+过程的传质问题,证实臭氧的氧化反应发生在液相主体中,属于慢速反应动力学区域。MATHESWARAN等[37]的研究也表明,在硝酸介质中,Ce3+被臭氧氧化成Ce4+,转化率较高。实验表明该反应过程对温度的变化最敏感,而增加硝酸的浓度会使溶液的酸性增加,从而降低臭氧在水中的分解速率,增加液相的臭氧浓度。
含铊矿石、冶炼废渣是铊生产的主要来源[38]。Tl3+/Tl+的氧化还原电位较高。王娜[39]的研究表明利用臭氧和高锰酸钾预氧化均能强化FeCl3混凝(微粒凝结现象)对Tl+的去除,但强化机理不同。臭氧对Tl+的去除机理是通过产生氧化还原电位更高的自由基使Tl+氧化成络合能力更强且溶解性更低的Tl3+,并且铊的去除率与O3投加量成正比,在氧化过程中未引入杂质离子;高锰酸钾不能将Tl+氧化成Tl3+,而是具有较好的吸附Tl+的性能,但需要较高的KMnO4投加量。
在湿法冶金工艺上,稀有高熔点金属一般都是先通过矿石在酸性或碱性介质中浸出后制取氧化物或卤化物,再用热还原或熔盐电解法制取金属。但这类金属矿在常温和低温(<300 ℃)下在空气中很稳定,不易被O2氧化后浸出[40]。因此,何东升等[41]研究了在常温下硫酸介质中用臭氧氧化含钒石煤中的钒,臭氧氧化对浸出效率的影响。结果表明,通入臭氧可提高原生石煤和风化石煤的钒浸出率,且随着臭氧流量的增大钒浸出率上升,提高浸出温度和H2SO4溶液浓度有助于强化臭氧对原生石煤中钒的浸出效果。对比臭氧与三价钒和四价钒的标准电极电位,可知臭氧均可以氧化三价钒和四价钒生成V2O5进入溶液。并且臭氧可以提高低浓度硫酸对含钒矿物晶体结构破坏能力,促进钒的浸出。对于高锰酸钾、氯酸钠等氧化剂比较,臭氧氧化工艺不会引起后续溶液除杂和废水处理的难度和成本等问题,显著提高五氧化二钒的纯度。皮关华等[42]采用焙烧—常压活性氧化(臭氧)浸出工艺对某钼镍矿进行回收。在进行焙烧脱硫后,在碱性条件下通入臭氧对该钼镍矿进行浸出,3 h后钼的浸出率达到98%。此外,在浸出过程中,臭氧可以将该矿石中含有铁、钙、镁等主要杂质氧化后发生水解沉淀进入渣相,提高浸出所得钼的纯度。
此外,在利用拜耳法生产氧化铝过程中,由于有机物会在铝酸钠溶液中不断积累,影响氧化铝生产的产量、质量和成本,而臭氧多用于水中有机物处理领域[43]。陈映等[44]用臭氧去除铝酸钠溶液中的有机物的研究结果表明,臭氧对铝酸钠溶液除有机碳和草酸钠效果明显,反应最终生成CO2和H2O,对铝酸钠溶液污染小,并且臭氧还能氧化溶液中的还原性杂质,达到铝酸钠溶液脱色的净化效果。
利用臭氧可将铁、锰、砷氧化形成不溶性氧化物沉淀性质,可将臭氧用于废水中铁、锰、砷等离子的去除。潘正棵[45]采用臭氧生物沸石工艺研究了臭氧对微污染水中铁、锰杂质的去除作用。发现与单独生物沸石工艺相比,通入臭氧可分别使铁和锰的去除率提高到66%和70%。NISHIMURA等[46]采用臭氧氧化沉淀稀酸性溶液中的砷与锰。在无砷溶液中,对于Mn(Ⅱ)的臭氧氧化分为两个阶段,第一阶段随着臭氧浓度的缓慢增加,锰离子被氧化形成MnO2的沉淀。而在氧化电位增加的第二阶段,溶液中锰的浓度却增加,这是由于二氧化锰被氧化溶解为高锰酸盐。而在对含As(Ⅲ)的废酸水处理中,臭氧氧化的第一阶段比在具有相同初始浓度的锰(Ⅱ)的无砷溶液中出现的结束时间早,这是由于锰(Ⅱ)氧化成锰(Ⅲ)形成了砷酸锰沉淀物而不是MnO2。
5 结论与展望
臭氧氧化能力仅次于氟而高于高锰酸钾、二氧化锰、双氧水、氯和氧气等传统氧化剂,具有氧化效率高、选择性好、反应速率快等优点,且在常温下可快速自行分解为氧气,不会引起二次污染。因此,臭氧氧化技术作为一种新颖、高效的清洁工艺引起了广泛关注,在贵金属、重金属、稀有金属及轻金属等有色金属的湿法冶金领域表现出巨大的应用潜力。但是如何克服臭氧生产成本高、利用率低的问题,进一步提高氧化效率和效果是值得关注的方向。随着科技的发展以及臭氧在水处理领域的成功工业化应用越来越多,将为其在冶金领域的工程化和产业化提供经验借鉴和指导。
当前,臭氧氧化难冶复杂金属硫化物及低品位硫化矿的机理研究将成为重要发展方向,同时在目前已有的研究资料中,各种金属硫化物及低价金属离子的臭氧氧化浸出的有关热力学数据很少,而且氧化机理和动力学特征需要进一步深入探索,并创建一套系统的臭氧氧化/浸出机制,使其在有色金属湿法冶金领域发挥更好的作用。

