骨质疏松情况下骨能量耗散的改变
张书威,张攻孜,隋熠,李明,吕厚辰,王铁,张立海
(解放军总医院第一医学中心骨科,北京 100853)
骨质疏松症是常见的骨骼疾病,是一种以骨量低、骨组织微结构损坏、骨脆性增加、易发生骨折为特征的全身性骨病[1]。骨质疏松与增龄相关,随着年龄增长发病率增高。骨质疏松的最严重后果是骨质疏松性骨折[2]。流行病学调查显示,2010年我国骨质疏松性骨折患者达233万,相关医疗支出649亿元[3]。骨质疏松已成为我国面临的重要公共卫生问题。
目前,临床上普遍采用骨矿密度(bone mineral density,BMD)值诊断骨质疏松,并由此预测骨折风险。但骨量与骨折风险之间的关系并不完善[4]。例如,在相同BMD水平下,75岁女性的髋关节和前臂骨折发病率是是45岁女性的4~7倍[5],单独使用BMD值无法有效预测骨折风险。2001年美国国立卫生研究院(National Institutes of Health,NIH)将骨质疏松定义为以骨强度下降和骨折风险增加为特征的骨骼疾病[6]。骨强度涵盖骨量和骨质量两大要素。BMD值表示的是单位体积内骨骼矿物质的密度,即骨量,而除密度外,骨组织的强度还受到其他因素的影响,如羟基磷灰石微晶的矿化、胶原的糖基化以及受离子影响的胶原纤维间牺牲键等[7]。本文主要对可能影响骨质量的因素作一探讨,现报道如下。
1 对象与方法
1.1 研究对象
纳入2016年1月至2016年12月期间在解放军总医院骨科行髋关节置换术的24例股骨颈骨折患者的股骨头为研究对象。剔除附着在股骨头表面的韧带等软组织,用浸润磷酸缓冲盐溶液(phosphate buffer saline,PBS)的纱布包裹,置于-20℃冰箱,梯度降温,1℃/min,冷冻封装保存。纳入标准:(1)基于髋关节平片及CT影像示股骨颈骨折,行髋关节置换术;(2)18~90岁;(3)髋关节置换术中切除的股骨头完整,且保存于我院临床标本资源库;(4)一般情况稳定。排除标准:(1)行空心钉内固定;(2)孕妇或哺乳期妇女;(3)严重脏器功能衰竭、全身情况不稳定、合并风湿及强直性脊柱炎等自身免疫病。患者或家属均签署知情同意书。
1.2 方法
筛选所有样品的骨密度和骨强度,匹配骨密度水平趋近而机械性能差异显著的目标样本,研究其骨强度的变化(杨氏模量异质性)。
1.2.1 骨密度检测 解冻后用生理盐水洗净,置入Micro-CT的检测扫描管内,使用Inveon MM系统对BMD进行分析并记录,将感性兴趣区域(region of interest,ROI)选择为主压力骨小梁区,沿主压力方向,取直径1 cm、高度1 cm的圆柱体检测。
1.2.2 骨强度检测 在每个样本的主压力骨小梁区,沿主压力方向,制作3个直径0.7 cm、高度3.0 cm的圆柱体骨柱试件。将骨柱试件置于万能拉力机(INSTRON3365)的样品台上,以1 mm/min速度施加压力,直至试件断裂。实验结束后计算机自动输出载荷-位移曲线,根据此曲线,可以得到样品的最大载荷;对曲线下面积进行积分,可得到骨组织断裂所需要的能量。
1.2.3 杨氏模量异质性检测 使用Allied低速精密切割机(TechCut 4)从样本的相同位置上切取5.0 mm×5.0 mm×5.0 mm立方体,使用30%H2O2溶液脱去油脂及胶原,包埋于聚甲基丙烯酸甲酯中,Yamato真空干燥箱(DP33)中干燥12 h,70℃。用金刚石研磨膏(1.00 μm、0.30 μm、0.05 μm)抛光得到样品。使用原子力显微镜(Bruker,Dimension Icon)扫描样品,方式:PeakForce QNM;范围:1 μm×1 μm;频率:0.5 Hz。扫描后可得到样品目标区域的高度图和模量分布图。使用AFM分析软件(NanoScope Analysis 1.9)对样品进行分析,计算模量分布。每个样品重复检测10次。
1.3 统计学处理

2 结 果
2.1 骨密度及骨强度检测结果
24例患者的基本资料及骨密度及断裂功检测结果如表1所示。
由表1可见,1号和3号为目标样品,其BMD值分别为322.29和327.12 mg/cm3,断裂所需能量分别为(1.05±0.09)J和(0.44±0.04)J,两个样品的BMD值最为接近,且断裂所需能量差异具有统计学意义(P<0.01)。1号样品和3号样品的载荷-位移曲线及断裂所需能量如图1所示。
2.2 杨氏模量异质性检测
目标样品的杨氏模量分布图显示:1号样品模量高低呈散在分布;3号样品模量以中央垂直线为轴,轴两侧模量分布相对均匀,上方模量较低,下方模量较高(图2A,B)。1号和3号目标样品的杨氏模量值分别为(12.17±0.94)和(13.55±0.72)GPa(图2C)。

表1 患者骨密度值、等效矿物密度及断裂功
BMD: bone mineral density.

图1 载荷-位移曲线
3 讨 论
本研究通过对骨密度数据的筛选,匹配骨密度水平趋近而机械性能差异显著的一组目标样本,研究骨强度与其纳米异质性是否有关。模量分布作为一种定性的检测手段,所得的模量分布曲线均值并不能定量地评价样本的模量及硬度,模量的空间分布规律也值得关注。本研究结果表明,1号和3号目标样品的杨氏模量值分别为(12.17±0.94)和(13.55±0.72)GPa,数值接近但模量的空间分布规律差异很大:1号样品模量高低呈散在分布;3号样品模量以中央水平线为界面,界面两侧模量分布相对均匀。
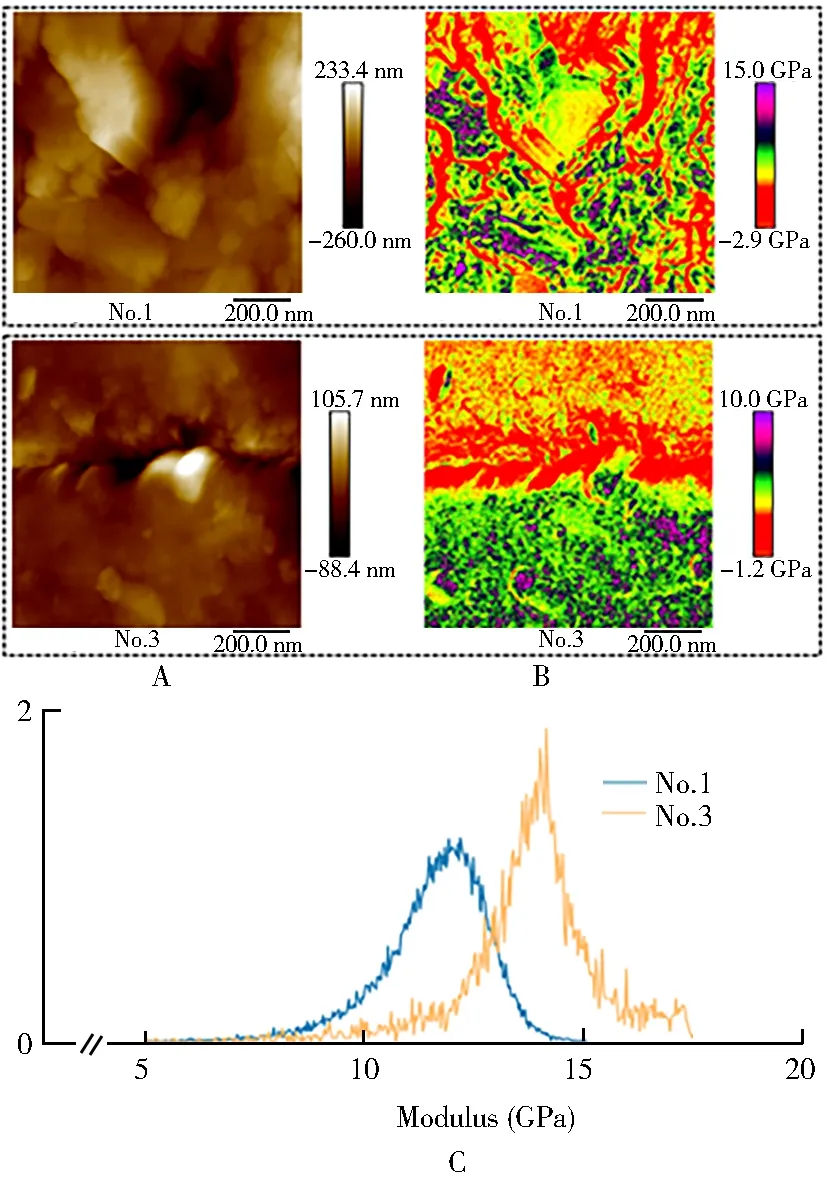
图2 杨氏模量检测结果
Tai等[8]就纳米级异质性对骨能量耗散的影响进行了四点弯曲的模拟实验,结果显示,完全均质的试件在受到弯曲时应力集中;而模量分布散在的不均匀试件更有利于应力的分散,应力传导的距离为均匀试件的近2倍。这似乎可以解释,平均杨氏模量较高的3号样品,因为均质而更容易造成应力集中,而在宏观机械性能上表现较差,提示骨强度与其纳米异质性有关。骨主要由交联的Ⅰ型胶原基质和矿化的纳米羟基磷灰石晶体组成。过去的研究将骨的弹性性质归因于矿物相,将其可塑性归因于胶原基质。这种简单的模型,没有考虑到两个相的相互作用,也没有考虑每个相在骨组织的弹性和塑性变形中都起到了作用。像所有复合材料一样,骨骼的每种成分对组织的整体质量都有不同、但密切相关的贡献。像许多天然材料一样,骨骼中矿物和有机质的几何形状、取向和结构的异质性,可导致其在机械性能上的异质性[9]。由于骨的多层级性质,其机械性能的异质性存在于多个长度尺度上。宏观上,为了适应不同的负载要求,对于不同的解剖位置,甚至特定解剖位置内的不同区域,机械性能均存在着明显的变化[10]。在微观水平上,纳米压痕进一步确定了骨小梁、骨单位与间质的模量和硬度差异,这归因于胶原纤维的取向和各向异性以及矿物质含量的变化。在这种长度尺度上的异质性也可能源于成骨细胞和破骨细胞的重塑过程,从而导致“旧”骨和“新”骨的混合[11,12]。经历重塑后,较旧的间质骨具有了较高的矿化度,导致刚度增加。
另外,骨作为一种复合材料,由多种构建模块组成整体,而整体之间存在着界面,对整体机械性能而言,界面的重要性与构建模块本身不相上下[13]。过去的研究已经注意到了纤维间界面和粘合线[10]:粘合线作为骨单位和基质之间的弱界面,在受外力作用时,能够将微裂缝引入其中,即破坏过程发生在弱界面。本组3号样本中模量分布分界的界面可能具有弱界面相似的性质,应力不仅易于在相对均质的组织中集中,并且容易沿着其界面断裂。但通过其原子力显微镜高度图,并没有发现周期性排布的胶原纤维束和羟基磷灰石片晶,其成因还有待进一步研究。

