膀胱癌患者术后尿路感染免疫状态与炎症介质的变化
韩明,王亚辉,杜昌国,燕群峰
咸阳市第一人民医院泌尿外一病区,陕西 咸阳 712000
由于内在环境和外在环境的影响导致膀胱黏膜上皮形成的恶性肿瘤称为膀胱尿路上皮癌,在临床上与泌尿系统相关的肿瘤中,膀胱癌是最常见的;同时,在人体发生的各种类型恶性肿瘤中,膀胱癌位列第九[1-2]。膀胱癌早期表现为无痛性的血尿或者间断性的血尿,小部分患者出现膀胱刺激症;随着肿瘤进展,后期会出现肿瘤梗阻输尿管开口以及膀胱颈口现象,从而导致患者上尿路阻塞和排尿困难[3]。目前临床上对膀胱癌治疗有显著效果的是采用经尿道对患者的膀胱肿瘤进行切除,由于电刀具有多方面的优势,因此临床上多采用经尿道电切切除膀胱非肌层浸润性肿瘤[4]。但是,患者经过经尿道膀胱肿瘤电切术后容易发生感染,其中又以尿路感染最为常见,尿路感染的发生不仅会导致患者出现相关的泌尿障碍,还会直接影响患者恢复程度[5]。膀胱癌患者术后发生尿路感染时,机体会表现出炎症状态,而其免疫状态也会发生一定的变化[6]。本文就膀胱癌患者术后尿路感染免疫状态与炎症介质进行研究,并对其变化情况进行分析。现将结果报道如下:
1 资料与方法
1.1 一般资料 回顾性选取2015年9月至2017年7月在咸阳市第一人民医院泌尿科行膀胱癌术后感染的57例患者作为观察组,另随机选取同时段的膀胱癌术后未发生感染的57例患者作为对照组。观察组患者中男性 40 例,女性17 例;平均年龄(57.47±8.21)岁;平均病程(9.16±1.34)个月;膀胱癌分期:Ⅰ期9 例,Ⅱ期14例,Ⅲ期16例,Ⅳ期18例。对照组患者中男性36例,女性 21 例;平均年龄(57.21±8.09)岁;平均病程(8.17±1.63)个月;膀胱癌分期:Ⅰ期10 例,Ⅱ期13 例,Ⅲ期17例,Ⅳ期17例。纳入标准:(1)均首次在我院进行手术者;(2)年龄27~78 岁;(3)临床资料完整。排除标准:(1)曾经接受过泌尿系统类的手术;(2)术前就存在尿路感染和凝血功能异常者;(3)伴随其他类型的恶性肿瘤或伴随其他脏器感染者。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 检测方法 (1)所有患者术后即开始每日清晨留取导尿管中尿液,制取尿液标本后采用自动微生物鉴定仪(上海枫岳商贸有限公司)监测是否有革兰阴性菌、革兰阳性菌及其他病菌。(2)术后7 d 抽取两组患者外周静脉血,采用流式细胞仪(默克公司上海办事处)检测免疫功能指标CD4+、CD8+、CD3+CD4+、CD4+/CD8+水平,并参照刘景田[7]的方法检测红细胞免疫指标自然肿瘤红细胞花环率(natural tumor erythrocyte rosette,NTER)、协同肿瘤红细胞花环率(associated tumor erythrocyte rosette,ATER)、促肿瘤红细胞花环率(enhance tumor erythrocyte rosette,ETER)、直向肿瘤红细胞花环率(direct tumor erythrocyte rosette,DTER)水平。(3)术后7 d 抽取空腹肘静脉血,离心加抗凝剂制取血清标本后,采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法检测炎性介质白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6 (interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及 前 列 腺 素 E2(prostaglandin E2,PGE2)水平,试剂盒均购自上海瑞齐生物科技有限公司。所有样本均由同一组检测人员在不知情下获取。
1.3 观察指标 (1)感染患者中病原菌类型:对尿液中存在的菌落,阳性(革兰阳性菌和真菌大于104CFU/mL 或者革兰阴性菌大于105CFU/mL)记为一例,同一病例不对不同时间段的同一菌株重复计算,主要包括革兰阴性菌(大肠埃希菌、肺炎克雷伯菌以及肠杆菌属)和革兰阳性菌(肠球菌属、表皮葡萄糖球菌)。(2)免疫功能指标:细胞免疫指标包括CD4+、CD8+、CD3+CD4+、CD4+/CD8+;红细胞免疫指标包括NTER、ATER、ETER、DTER。(3)炎症指标:包括IL-1β、IL-6、TNF-α、PGE2。
1.4 统计学方法 应用SPSS22.0统计软件进行数据分析,计数资料以例或率表示,计量资料以均数±标准差(x-±s)表示,采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 病原菌类型 观察组患者术后感染的病原菌类型检测结果显示,主要病菌为革兰阴性菌,革兰阴性菌种又以大肠埃希菌居多,见表1。

表1 观察组患者病原菌类型
2.2 两组患者的免疫功能比较 观察组患者的CD4+、CD3+CD4+、CD4+/CD8+和NTER、ATER、ETER、DTER水平明显低于对照组,CD8+明显高于对照组,差异均有统计学意义(P<0.05),见表2。
2.3 两组患者的炎症因子比较 观察组患者的IL-1β、IL-6、TNF-α、PGE2水平明显高于对照组,差异均有统计学意义(P<0.05),见表3。
表2 两组患者的免疫功能比较
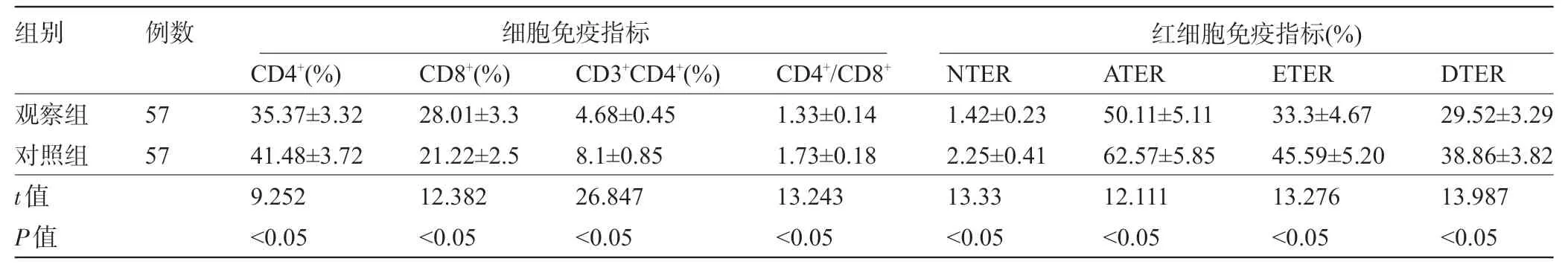
表2 两组患者的免疫功能比较
组别 例数 细胞免疫指标红细胞免疫指标(%)观察组对照组t值P值57 57 CD4+(%)35.37±3.32 41.48±3.72 9.252<0.05 CD8+(%)28.01±3.3 21.22±2.5 12.382<0.05 CD3+CD4+(%)4.68±0.45 8.1±0.85 26.847<0.05 CD4+/CD8+1.33±0.14 1.73±0.18 13.243<0.05 NTER 1.42±0.23 2.25±0.41 13.33<0.05 ATER 50.11±5.11 62.57±5.85 12.111<0.05 ETER 33.3±4.67 45.59±5.20 13.276<0.05 DTER 29.52±3.29 38.86±3.82 13.987<0.05
表3 两组患者的炎症因子比较
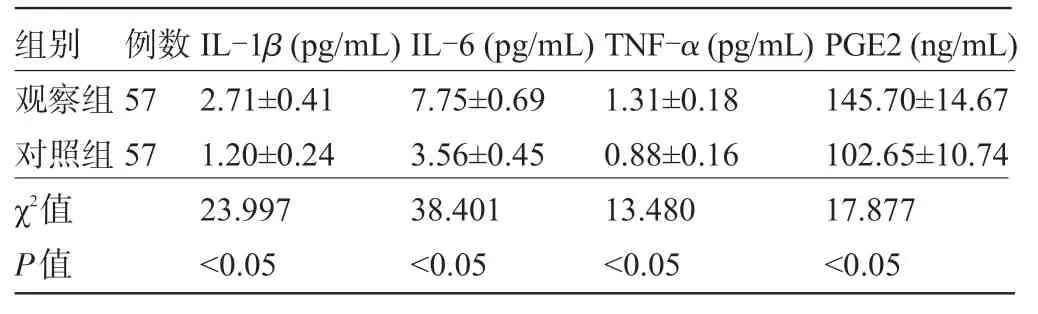
表3 两组患者的炎症因子比较
例数57 57组别观察组对照组χ2值P值IL-1β(pg/mL)2.71±0.41 1.20±0.24 23.997<0.05 IL-6(pg/mL)7.75±0.69 3.56±0.45 38.401<0.05 TNF-α(pg/mL)1.31±0.18 0.88±0.16 13.480<0.05 PGE2(ng/mL)145.70±14.67 102.65±10.74 17.877<0.05
3 讨论
经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)是临床治疗膀胱尿路上皮肿瘤的常用术式之一。且研究表明,对浅表性膀胱肿瘤以及浸润程度较浅(如浸润黏膜下层)患者行TURBT 在治疗,可有效提高患者生活质量、延长生存时间[8]。但在施行TURBT术时,需要经尿道进行操作,且之后的膀胱灌注也是经由尿道,而这些操作都加大了损伤患者尿道黏膜、膀胱壁风险,尿道黏膜和(或)膀胱壁损伤,这些因素又会直接导致尿道、膀胱对病菌的抵抗能力大幅度下降[9]。正常情况下,尿道中的栖息菌并不会对尿道产生危害,但是当这些栖息菌所处的环境发生改变,就易转变为致病菌。本试验中病原菌分析结果显示,对术后尿路感染的患者病原菌主要为大肠埃希菌和肺炎克雷伯菌,这在一定程度上证实了膀胱癌患者术后尿道感染主要的尿道的栖息菌[10]。膀胱癌患者经历手术打击后,其免疫功能多少会受到影响,而这也会影响感染是否发生及发生后对机体的损伤程度。T细胞在多种细胞免疫应答机制中占有主要地位,CD3+经常作为T 细胞成熟的代表性物质,CD4+则属于辅助性T淋巴细胞的表面标志,CD8+是直接对靶细胞进行清除的物质,CD4+/CD8+的升高则意味着机体内的免疫功能出现紊乱[11-12]。
本研究中,术后尿路感染的患者其CD4+、CD4+CD3+及CD4+/CD8+显著下降,CD4+/CD8+的比值也显著上升,说明感染患者的T淋巴细胞活动受到严重抑制,并且其免疫功能出现紊乱[13]。此外,红细胞是血液系统中存在数量最多且又具有一定程度免疫功能的细胞,它在多个免疫调节过程中均有参加,因此,在对机体免疫功能进行分析时,它也是作为常用指标之一[14]。当机体发生感染会对红细胞免疫功能产生影响,NTER、ATER、ETER、DTER分别表示红细胞与恶性肿瘤细胞相结合的能力、红细胞膜表面活性、患者血清中的补体样物质和对肿瘤产生抑制的因子[15-16]。而本研究中显示,观察组患者的NTER、ATER、ETER、DTER 均显著低于对照组,提示尿道感染的患者血液中红细胞对肿瘤细胞的作用大幅度降低,这需要临床医师加以重视。此外,机体在刺激状态下会处于一种应激状态,而这种应激状态会加快动力循环和代谢反应进而表现出生理和病理特征[17]。IL-1β、IL-6、TNF-α、PGE2均为炎症的标志性因子[18-19],多在应激状态下显著升高。在本研究中也显示,术后尿道感染患者炎症程度要高于对照组。
综上所述,膀胱癌患者术后感染在免疫功能上处于下降状态,而在炎症介质上则表现出显著升高,因此需要对患者的免疫功能进行适当的调节,而其炎症介质上也需要一定程度的清除,从而对患者病情恢复起到促进作用。

