移动体外膜肺氧合在小儿急性呼吸窘迫综合征院际转运中的应用:7例回顾性病例研究
郑贵浪,丁家畅,李旭锋,胡燕,吴家兴,王春,陈奕豪,祝玲萍,周成斌,孙跃玉,陈壮桂,郭予雄*
1广东省人民医院/广东省医学科学院儿科PICU,广州 510080;2中山大学附属第三医院PICU,广州 510630;3广东省人民医院/广东省医学科学院体外循环科,广州 510080
小儿急性呼吸窘迫综合征(pediatric acute respiratory distress syndrome,pARDS)是儿童常见的呼吸危重症,严重威胁着儿童的健康[1]。对于首诊在基层医院的严重pARDS患儿,常常需要转诊至上级医院,这对传统的转诊技术来说是极大的挑战。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是可部分替代心肺功能、维持机体器官氧供的一种体外生命支持技术,对传统治疗无效的严重心肺衰竭患儿提供了很好的救治手段。1977年,Bartlett等[2]率先开展了ECMO转运,同时提出移动ECMO概念。国内小儿ECMO技术起步稍慢,目前在儿童重症领域能够开展ECMO转运的单位较少,主要集中在北京、上海等几个大城市,华南地区及广东省进行小儿ECMO院际转运的报道更少。本研究回顾性总结广东省人民医院2019年1月1日-11月25日通过ECMO院外转运的pARDS患儿的临床资料,探讨了移动ECMO在pARDS中应用情况及其安全性。
1 资料与方法
1.1研究对象 收集广东省人民医院2019年1月1日-11月25日通过ECMO转运技术从外院转入后继续救治的pARDS患儿的临床资料并进行回顾性分析。共纳入7例患儿,其中男6例(占85.7%),女1例(占14.3%);年龄(43.3±42.9) 月,最小年龄8个月;体重(18.4±17.7) kg,最小体重7 kg。本研究已经过广东省人民医院医学研究伦理委员会审查。
1.2纳入及排除标准 ECMO转运的pARDS患儿纳入标准:①年龄<14岁,男女不限;②pARDS的诊断标准按照国内外通行标准进行判断[3-4];③pARDS严重,传统治疗无效,根据2015年体外生命支持组织(extracorporeal life support organization,ELSO)转运指南来确定患儿ECMO转运的指征; ④家属同意并最终实施了ECMO转运。排除标准:①ECMO转运的严重心功能障碍患儿;②ECMO转运的中毒患儿。
1.3方法
1.3.1ECMO转运前的评估 ①初次评估:广东省人民医院ECMO转运团队自接到院外转运患儿的信息开始,即刻派出儿童重症专家及ECMO专家对病情进行评估,如初步判断有ECMO转运指征,即与患儿家属进行充分的病情沟通,一致同意后,30 min内派出ECMO转运团队。②二次评估:抵达目的地医院后,ECMO转运团队再次对病情进行评估,达到ECMO支持指征,且家属同意用该技术进行抢救并转运时,即可开始行ECMO相关操作。
1.3.2ECMO转运团队组成 广东省人民医院小儿ECMO转运团队组成人员包括:儿童危重症专家1名,小儿心血管外科主治以上医师或小儿ECMO专家1名,儿童重症监护室护士1名,ECMO专科护士1至2名,救护车1至2辆。小儿ECMO转运团队实行24 h值班制度。
1.3.3ECMO转运相关器材及设备 广东省人民医院用于转运的设备有德国索林、美国美敦力或德国米道斯离心泵系统,根据患儿年龄大小选择儿童或者新生儿氧合器。根据病情严重程度及心功能状态选择ECMO模式,采用静脉-动脉(V-A)模式或静脉-静脉(V-V)模式。转运过程中救护车的其他常规设备包括呼吸机、输液泵、手持式超声等。转运出发前,应保证移动ECMO相关设备及器材、药物处于安全可用状态。
1.3.4ECMO转运的管理
1.3.4.1ECMO的评估与上机 抵达目的地医院后,仔细研究患儿的临床资料、病情严重程度,确定ECMO支持指征,充分与患儿家属沟通病情后,开始置管及ECMO上机处理。上机后监测患儿的临床表现,结合血气分析、凝血功能状态等辅助检查,按照病情调整原有呼吸机参数、血管活性药物等治疗方案,病情稳定后启动转运。
1.3.4.2ECMO回程前核查 启动回程前,确保ECMO管路连接处紧密,插管处无活动性出血或渗血,确认气源、电源情况,确保患儿气管插管及深静脉置管固定妥当,核对转运途中可能需要的救治药物是否完备。与当地医院及广东省人民医院PICU交流,做好交接工作。
1.3.4.3转运过程中患儿症状及体征的监测 监测患儿的生命体征、出入量、ECMO血流量、气流量,定期监测活化的全血凝固时间(activated clotting time of whole blood,ACT)及血气分析等;严密监测ECMO插管位置有无变化、管路是否打折,如果存在以上情况应立即复位;监测凝血功能,保持ACT 160~180 s,动态调整血管活性药物使用剂量及呼吸机参数,维持患儿于安静舒适状态,尽量使患儿心肺处于休息状态。
1.3.5住院期间诊治方案 患儿转运至广东省人民医院后,由儿科PICU、ECMO专家及儿科心脏内外科的副主任医师以上医师组成专家组,对患儿的综合救治提供总的指导。所有患儿均须重新评估、核实其严重ARDS的诊断,结合国内外指南及广东省人民医院的经验进行规范性治疗[3]。在继续ECMO支持的前提下,尽量降低机械通气的相关参数,逐渐下调至停止所有血管活性药物,控制液体出入量,给予镇静镇痛处理等,同时密切监测呼吸、循环功能,动态监测ECMO运行指标(氧气流量、氧浓度、血流量、ACT等)。腺病毒所致的pARDS患儿,可给予大剂量丙种球蛋白(2 g/kg)及短期小剂量甲泼尼龙治疗[5],未使用抗病毒药物。
1.3.6数据收集及分析 收集所有入选患儿的相关资料:①患儿的性别、年龄、体重、临床表现、救治的全部经过信息及最终预后;②总结患儿ECMO支持前的疾病严重程度,收集ECMO转运距离、转运时间、支持模式及转运过程并发症等;③pARDS患儿经ECMO转运至广东省人民医院后的救治效果指标,包括机械通气时间、住院时间、ECMO院内运转时间、ECMO撤机成功率、预后及并发症发生情况等;④根据收集的数据类型,采用SPSS软件进行描述性分析。
2 结 果
2.1ECMO转运患儿的临床资料 所有病例均为严重ARDS患儿,其中4例确定为人腺病毒感染(HAdV),3例病原菌不明确。所有患儿转运前经当地医院非手术治疗(机械通气、抗感染及其他常规支持方案)疗效不佳,病情进展,至转运前最差氧合指数(OI)均超过40。
所有患儿均采用陆地救护车系统进行转运,结合病情及患儿体重选择ECMO转运模式,转运距离为(9.4±8.9) km,最远22 km,转运时间为(35.7±17.2) min,最长60 min。转运过程全部成功,无转运过程中死亡病例。转运过程中置管位置少许渗血比较常见,但未见大出血或出血量过大导致明显贫血或心血管系统不稳定表现者。转运过程中无脱管、置管移位、气管导管脱落或扭折等现象,无低血压无法纠正、严重低氧血症无法纠正、严重心律失常现象。所有患儿转运过程中血氧及循环状态良好。具体资料见表1。
2.2ECMO转运后患儿的诊治结果 所有患儿符合严重pARDS标准,存在换气功能严重障碍。ECMO治疗期间均动态监测X线胸片及胸部CT,所有患儿胸部渗出严重,呈“白肺”改变(典型改变见图1)。机械通气时间为(17±11) d,最长为28 d;ECMO运转时间为(307.4±233.6) h,最长支持691 h(最终死亡),存活者中ECMO支持时间最长为552 h(约23 d)。所有患儿的住院时间为(23±15) d,存活者最长住院时间为45 d,最短12 d,尚有1例患儿成功撤除ECMO还在住院中(病例7)。所有患儿中,5例因液体超负荷难以用药物控制或因出现急性肾损伤(AKI 2期)而予连续性肾脏替代疗法(CRRT)治疗。所有CRRT治疗均为并联连接在ECMO体外循环的血管管路中。病情好转、AKI缓解或液体过负荷纠正后撤除CRRT。
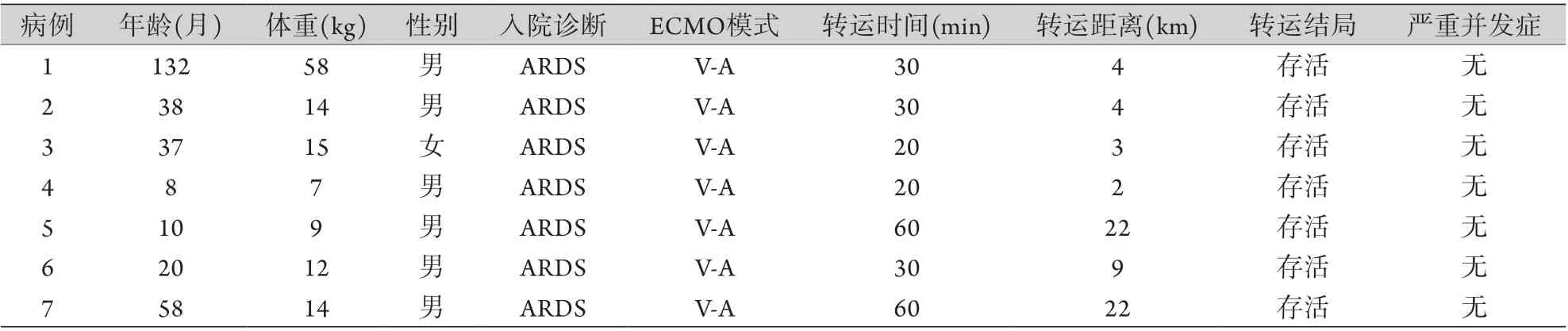
表1 ECMO转运患儿的一般临床资料Tab.1 General clinical data of children with ECMO transport
2.3ECMO转运后患儿的预后情况 所有患儿中6例出院,其中4例痊愈(治愈率66.7%),死亡2例(病死率33.3%)。另外1例(病例7)HAdV-ARDS患儿目前已经撤除ECMO,但尚未治愈出院,因肺动脉栓塞、闭塞性细支气管炎、肠功能衰竭目前还在住院治疗,未撤离呼吸机。治愈病例中,2例是HAdV所致,出院时存在闭塞性细支气管炎,需要低流量吸氧及雾化治疗,另外2例病原体不明确,治愈出院。死亡病例中,1例病原体为HAdV,因ECMO期间出现严重肺出血死亡;另外1例病原体不明,因脓毒症休克、严重心力衰竭及严重毛细血管渗漏而死亡(表2)。
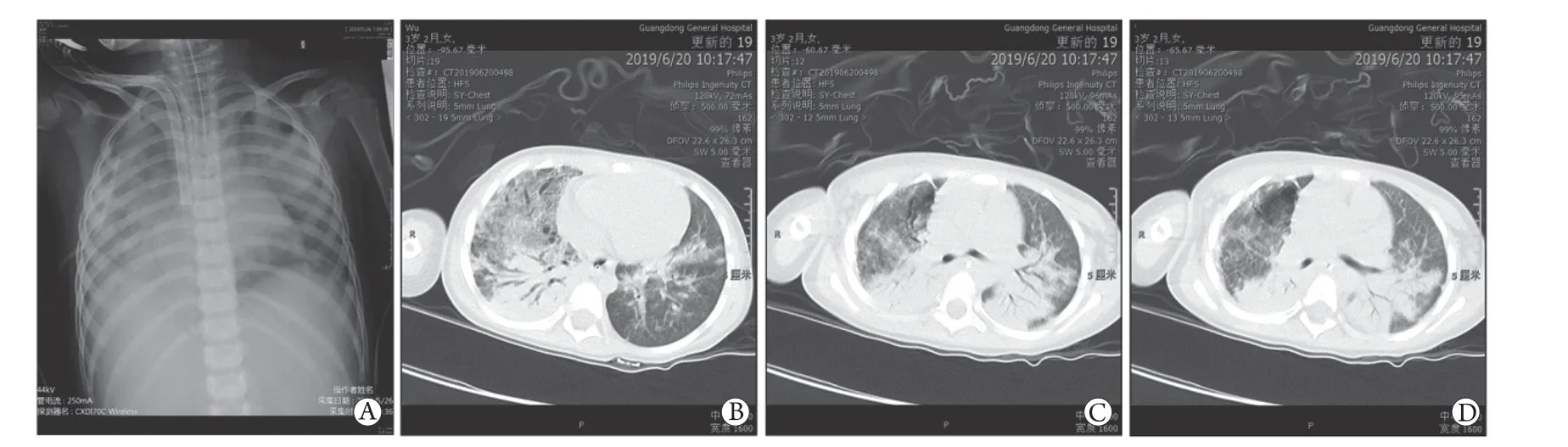
图1 腺病毒所致pARDS患儿的典型胸片(A)及胸部CT(B-D)图像Fig.1 Typical chest radiograph (A) and CT scans (B-D) of patients with pARDS caused by HAdV
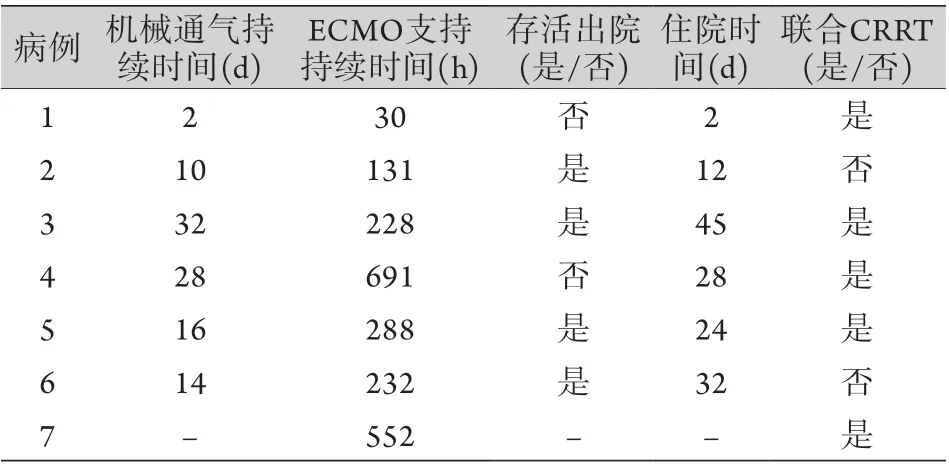
表2 移动ECMO转运的pARDS患儿治疗概况及预后Tab.2 Treatment profiles and prognosis of children with pARDS transported by ECMO
3 讨 论
pARDS是由肺部或肺外因素引起的广泛急性肺损伤,进而导致气体交换障碍及肺力学异常,临床以呼吸困难、顽固性低氧血症、X线胸片广泛弥漫性渗出及氧合指数升高为突出表现。近10年来,机械通气策略方面的改进是ARDS治疗的主要进展[6],但机械通气仅为呼吸系统对症支持手段,并不能治愈ARDS,因此积极查找ARDS病因,去除ARDS发生的危险因素是治疗及控制ARDS的关键所在[4]。
2012年我国9个省市20家ICU的横断面调查显示,ICU患儿ARDS的发病率为8.2%[7]。Bellani等[1]对50个国家459个重症监护中心的ARDS患儿进行前瞻性研究,发现ICU入院患儿中重症ARDS占10.4%,而轻、中、重度ARDS的在院病死率分别为34.9%、40.3%及46.1%。目前,我国ARDS患儿的病死率与国际水平相当[7]。本研究7例pARDS中4例为腺病毒所致,而传统的监测手段未能发现病原体,均通过纤维支气管镜行肺泡灌洗液病原学宏基因组测序确定,提示高通量病原微生物检查有助于临床诊断。本研究结果显示,重度pARDS结局为死亡2例,存活4例,略低于文献报道水平,可能与早期CRRT控制液体负平衡相关,也不能除外样本量太小所致,因此仍有待进一步研究。
移动ECMO技术在严重pARDS患儿中的转运至关重要。近年来,国内儿科ECMO的应用快速增多,但儿科ECMO转运仅在少数医院开展。ECMO转运技术是儿科重症转运的高级形态,因技术难度较大及费用昂贵等因素的制约,在我国儿科ECMO的应用中起步较晚。对于严重心肺衰竭的患儿,传统的转运技术无法保证远距离转移,移动ECMO的出现可以保障转运途中患儿生命体征的稳定,为进一步救治提供了宝贵机会。ECMO转运危重症在国外已经相当成熟,大量的实践及报道提示,移动ECMO在危重症中的应用是安全且富有成效的[8-15]。
我国自2009年始见ECMO转运危重症的报道[16], 但多限于成人,直至2016年,应用移动ECMO转运危重症患儿才见报道[17]。截至目前,我国也仅在北京、上海等几个城市的部分大医院开始尝试ECMO转运危重症患儿[18],而广东省乃至华南地区鲜见采用移动ECMO转运严重呼吸危重症患儿的报道。国内ECMO转运危重症患儿的实践显示,对于技术娴熟的ECMO团队,ECMO远距离转运儿童危重症也是安全有效的[19-22]。本研究纳入ECMO转运的pARDS均为严重病例,患儿转运前最差氧合指数(OI)均>40,转运过程顺利,无严重并发症发生,7例患儿均安全转运至广东省人民医院,再次证实移动ECMO在pARDS的转运中是安全可行的。与外院ECMO转运的数据相比[15,18],本研究中的患儿ECMO转运距离较短,花费在转运途中的时间也比较短,这可能与转运并发症少有一定关系。
本研究中移动ECMO转运pARDS患儿抵达广东省人民医院后,经积极治疗,存活率达到66.7%,撤除ECMO成功率达71.4%。存活患儿中,ECMO支持的平均时间为220 h。这与洪小杨等[18]对中国大陆儿科ECMO转运的多中心调查结果基本一致,提示广东省人民医院的小儿ECMO转运水平与国内同行水平相当。Bryner等[15]总结过去20多年ECMO转运危重症的研究发现,有71%的ECMO转运患儿成功存活出院,而与之相同年限间体外生命支持组织(Extracorporeal Life Support Organization,ELSO)组织登记的ECMO支持的呼吸疾病患儿存活率为56%,也与本研究的结果相似。然而,本研究中的存活者住院时间偏长,且需机械通气支持的时间也较长,如何缩短住院时间、减少并发症及提高生存率仍然是亟待解决的问题。
综上所述,pARDS是儿童呼吸危重症的常见疾病之一,其居高不下的病死率严重危害儿童的健康。本研究结果显示,移动ECMO转运pARDS患儿是安全有效的,为此类患儿的院际转运提供了很好的手段。

