胡杨组培及愈伤组织增殖研究
张靖,马彦军,贺隆基,张成君
(1.甘肃农业大学林学院,甘肃 兰州 730070;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;3.甘肃农业大学草业学院,甘肃 兰州 730070)
胡杨Populus euphratica,具有极强的抗逆性,经济价值高,是西部林业生态建设的先锋树种。有关胡杨愈伤组织的研究报道比较少,马艳[1]研究了胡杨叶片组织培养技术,结果表明叶片诱导愈伤组织的最适培养基为WPM+0.4 mg/L 6-BA+0.4 mg/L NAA,朱小虎[2]研究以胡杨的雄花、花序轴为外植体筛选出最佳外植体,结果表明花序轴为诱导愈伤组织的最佳外植体,诱导愈伤组织最佳培养基为B5培养基,愈伤组织增殖最佳培养基为MS或LS培养基。本研究以胡杨当年生嫩枝为外植体,通过对比试验,筛选出最佳的消毒方式以及培养基,来实现胡杨愈伤组织的高效诱导和快速增殖,建立胡杨愈伤组织诱导和增殖体系,以期为后续胡杨的无性繁殖奠定基础。
1 材料和方法
1.1 材料
取样地点位于甘肃农业大学院内,103°70′E、36°09′N,海拔1 514.81 m。取样日期2019年5月上旬。剪取胡杨南向嫩枝为样枝,当年生,未木质化,保湿带回室内备用。
1.2 试验方法
1.2.1 外植体预处理
供试枝条剪去两端,保留中间一段用作外植体,长2~3 cm,带腋芽 3~4个,同时剪去叶片,保留一小段叶柄。软毛刷仔细刷洗枝段,流水冲洗30 min。在超净工作台上,枝段先用75%酒精消毒 2~3 s,无菌水冲洗 3 次,0.1% HgCl2灭菌,无菌水冲洗后,剪去叶柄,植入培养瓶中。
1.2.2 灭菌试验
将酒精消毒处理过的枝段经0.1% HgCl2灭菌后植入MS培养基上进行培养。0.1% HgCl2灭菌设置 5 个处理时间,分别为 0、4、6、8、10 min。每个处理接种20瓶,每瓶接种1个外植体,每隔3 d观察1次,记录数据,2周后进行统计。筛选出合适的灭菌方案。
1.2.3 愈伤组织诱导
将0.1% HgCl2灭菌过的外植体接种到培养基分别诱导愈伤组织。3种培养基为MS、B5、White,添加不同浓度、不同组合的6-BA、NAA为处理,见表1。每个处理接种10瓶,每瓶接种1个外植体,3次重复。接种后每隔3 d观察1次,记录愈伤组织的生长状况。30 d后统计愈伤组织诱导率。

表1 愈伤组织诱导实验设计
1.2.4 愈伤组织增殖
诱导形成的愈伤组织切成小块,长宽约0.5 cm,转移至MS培养基进行继代培养增殖,基本培养基添加不同浓度、不同组合的6-BA、NAA为处理,见表2。每个处理接种10瓶,每瓶接种2个外植体,3次重复。接种后每隔3 d观察1次,记录愈伤组织的生长。40 d后统计数据。
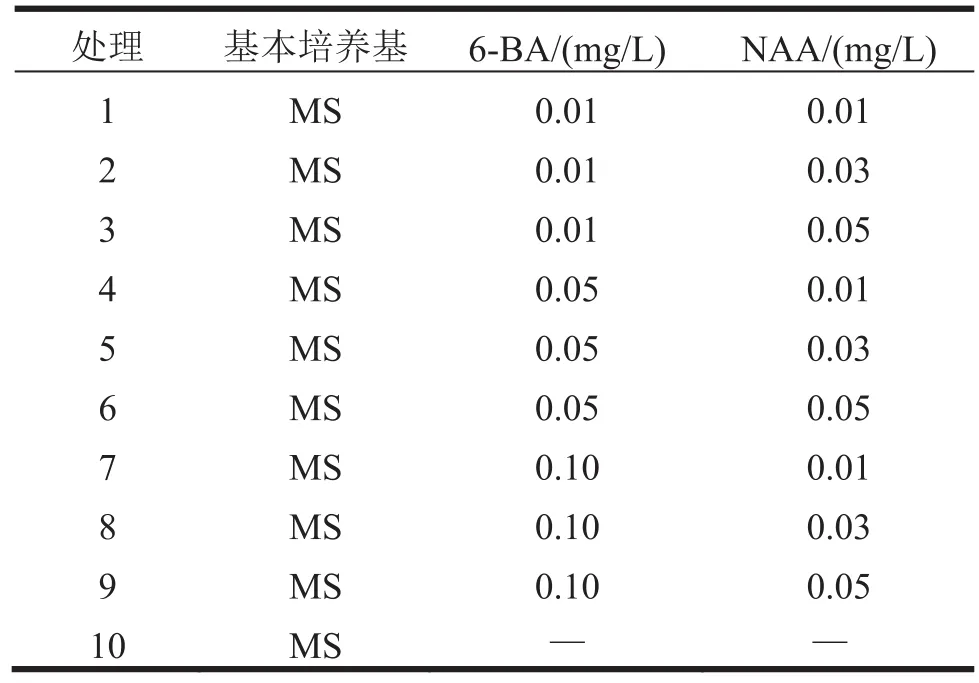
表2 愈伤组织增殖实验设计
1.2.5 培养条件
所有培养基中均添加蔗糖25 g/L,琼脂6 g/L,pH 调至 5.8~6.0,培养室温度(22±2)℃,光 /暗周期 12 h/12 h,光照强度 1 400~2 000 lx,培养室湿度 50%~65%。
全部数据利用SPSS19进行分析。
2 结果与分析
2.1 灭菌试验
由图1可知,0.1% HgCl2灭菌6 min效果最好,成活率可到达86.67%,污染率10%。0.1% HgCl2灭菌8、10 min,外植体生长初期与灭菌6 min的处理类似,但后期成活率低。

图1 不同消毒时间下外植体污染率及成活率
2.2 愈伤组织诱导
不同浓度的激素对胡杨愈伤组织诱导有不同的影响,如图2所示。首先,与对照(处理1)相比,添加诱导激素的各处理有统计学意义,且诱导率相差悬殊,说明诱导激素在愈伤组织形成中具有决定意义;其次,相同培养基处理之间无统计学意义;其三,处理2与B5、White 2种培养基的处理有统计学意义,与同为MS培养基的处理3无统计学意义,但诱导率较高。综合分析,处理2为最佳诱导培养基配方,诱导率可达到83.3%。观察发现,处理2诱导的愈伤组织结构紧密,呈团状。因此,最佳愈伤组织诱导培养基配方为MS+0.50 mg/L 6-BA+0.10 mg/L NAA。

图2 不同培养基与激素浓度下愈伤组织诱导率
2.3 愈伤组织增殖
初代培养所得到的愈伤组织数量较少,为了获得大量的愈伤组织,增殖培养必不可少。增殖结果见表3。从表3可以看出,首先,添加激素的各处理增殖程度明显高于对照(处理10),说明添加激素对愈伤组织的增殖具有重大意义。其次,分析表明,当6-BA与NAA的浓度比值为1时,有利于愈伤组织的增殖。以MS为基本培养基,添加0.05 mg/L 6-BA+0.05 mg/L NAA,愈伤组织增值效果最佳,所得愈伤组织呈黄绿色,结构疏松,长势最好。同时,6-BA的浓度0.01~0.05 mg/L时,随着NAA浓度的增加,愈伤组织增殖程度逐渐增加;6-BA浓度0.10 mg/L时,随着NAA的浓度增加,愈伤组织增殖程度逐渐降低。

表3 不同激素对愈伤增殖的影响
3 讨论
植物细胞、组织、器官脱分化形成愈伤组织。愈伤组织的形成分为诱导期、分裂期和形成期3个阶段。培养基种类、激素种类、浓度及其不同组合对愈伤组织的诱导和分化起着重要的作用[3],同一植物种类,同一外植体在不同激素种类及不同浓度的组合下愈伤组织诱导率和增殖效果不同。本实验以胡杨的嫩枝为外植体,首先确定最佳的消毒方案,然后通过对比不同培养基以及激素浓度配比的结果,筛选出诱导胡杨愈伤组织和促进愈伤组织增殖最佳的配方。实验表明,用0.1% HgCl2处理6 min,污染率较低同时成活率最大,为最佳处理结果。0.1% HgCl2处理8、10 min的污染率低,但后期成活率也低。这种情况可能是HgCl2对外植体有毒害作用,随着时间的延迟,毒害作用越大,外植体的存活率越低。这与聂玉鸿[4]所研究的胡杨嫩枝最佳消毒时间不一样,造成差异的可能原因,首先是外植体不同。聂玉鸿[4]外植体取自室内培养发芽抽生的未木质化嫩枝,长3~5 cm,而本项研究为室外发芽抽生的未木质化嫩枝。其次,两个实验酒精消毒时间不同。研究结果表明,MS培养基添加0.50 mg/L 6-BA+0.10 mg/L NAA最有利于愈伤组织诱导。本文未涉及不同外植体对愈伤组织诱导的影响,但通过朱小虎[2]的试验可以说明,不同外植体的愈伤组织诱导率不同,其原因可能是外植体的脱分化难易程度不同以及不同外植体所需的培养条件也不一致。
不同激素的浓度与配比对愈伤组织的增殖具有重要意义[5]。研究发现,当6-BA与NAA浓度比为1时,有利于愈伤组织的增殖。在愈伤组织形成的过程中,激素作为植物生长发育的第一信使,通过调节植物基因活性,诱导基因表达,从而产生相应的蛋白,相应蛋白的多少可以反应愈伤组织的形成和增殖程度[6]。6-BA与NAA的相互作用,不同浓度的配比共同控制其蛋白的合成,当6-BA与NAA浓度比值为1时,相应的蛋白含量最多,愈伤组织增殖程度最好。当6-BA浓度0.01~0.05 mg/L时,随着NAA浓度的增加,愈伤组织的增殖效果越好,说明增殖激素对愈伤组织的增殖具有重要意义。当6-BA浓度0.10 mg/L时,随着NAA的浓度增加,愈伤组织增殖值程度逐渐降低,表明高浓度的生长调节剂对愈伤组织的增殖起着抑制作用。MS+0.05 mg/L 6-BA+0.05 mg/L NAA为愈伤组织增殖最佳培养基。
4 结论
胡杨嫩枝最佳消毒方案为0.1% HgCl2处理6 min,适合胡杨嫩枝愈伤组织诱导培养基为MS+0.50 mg/L 6-BA+0.10 mg/L NAA,愈伤组织增殖培养基为MS+0.05 mg/L 6-BA+0.05 mg/L NAA。

