环境温度和酸碱变化适应性广的纤维素降解菌复合系筛选
肖艳萍, 张仕颖,包 立, 赵丹丹,张乃明*
(1.云南农业大学植物保护学院,云南 昆明 650201;2.云南省土壤培肥与污染修复工程实验室/云南省土壤资源利用与保护创新团队,云南 昆明 650201;3.云南省贸易经济学校,云南 昆明 650204;4.云南省农业科学院农业经济与信息研究所,云南 昆明 650231)
【研究意义】农业秸秆等资源的不当焚烧不仅带来环境污染,还造成资源浪费。生物堆肥可以将秸秆资源等有效利用起来,是实现农业有机固体废物无害化、减量化、资源化的重要手段。【前人研究进展】在堆肥中,微生物的作用至关重要,很多研究都发现微生物能促进和优化堆肥过程[1],增加全氮、有效磷及速效钾的含量,提高堆肥品质等[2];有研究发现AM真菌能够促进还田稻秆的分解,促进有机质的养分释放[3]。复合微生物的研究和开发一直是堆肥领域的一大热点。然而,微生物菌剂在实际使用时,由于受到周围环境中生物与非生物因素的影响,复合微生物的适应性和竞争力在复杂环境中往往会发生变化,导致废弃物降解效果不佳,这是复合微生物在生物堆肥应用中存在的一个巨大缺陷,例如堆肥中一些降解菌在高温下失活[4],一些微生物菌在低温和碱性条件下其对纤维素的降解功能不能正常发挥等[5]。【本研究切入点】理论上,不同环境适应类型的微生物共同作用,或高环境耐受性微生物可能对纤维素废弃物的降解具有较好的作用。因此,尽可能让使用的菌剂不单一化,增强其环境的稳定性和耐受性,也许对降低菌剂在复杂环境中的堆肥具有利好。因此,采用不同适用类型的微生物制成微生物菌剂,同时筛选环境适应性强的微生物投入实际环境中使用,可能更加有利于废弃物在不同发酵阶段的腐解。【拟解决的关键问题】探究和筛选一种具有环境适应能力的纤维素降解菌复合系,以期能够降低实际堆肥过程中非特定环境因素对菌系功能稳定性的影响,降低环境温度变化、酸碱变化等对微生物菌系的影响,有利于纤维素降解菌复合系在生物堆肥过程中发挥其功能作用,从而促进堆肥腐熟。
1 材料与方法
1.1 供试材料
采用20株具有纤维素分解能力的菌株作为供试菌,所有菌株都直接从自然生态环境中分离得到,具有降解纤维素的能力,为实验室前期分离所得,详见表1,分类种属均未鉴定。
采用的主要培养基为羧甲基纤维素钠液体发酵培养基[6],主要设备为全温摇瓶柜、水浴恒温振荡器、小型离心机、基本型火焰光度计、电热恒温鼓风干燥箱、蒸汽灭菌器、接种箱等。
1.2 试验方法
首先采用正交试验构建复合微生物菌系。将20株供试菌株随机分成4组,每组5株菌, 按照4因素5水平正交表[7]组合构建得到25组复合微生物菌系(CM1-CM25),详见表2~3。第2步,对每一组复合菌进行拮抗关系试验。第3步,对复合菌系进行筛选。不同温度条件下的CMC酶活测定。基本操作:把复合菌系的各个菌株接种到250 mL三角瓶液体发酵培养基中,放置到摇床上,120 r/min,28 ℃恒温振荡培养,采用DNS法分别测定35、45、55 ℃的CMC酶活。不同酸碱条件下的CMC酶活测定。基本操作:采用DNS法,测定不同pH值条件下(pH 6、7、10)的CMC酶活。FPA滤纸酶活测定。基本操作:把复合菌系的各个菌株分别接种到250 mL三角瓶液体发酵培养基中,并在三角瓶中各加入1根1.0 cm×5.0 cm的滤纸条作为底物降解试验的外观指标,并对复合菌系的FPA滤纸酶活进行测定。通过测定不同条件下的CMC酶活,以及FPA滤纸酶活, 筛选得到目标组合菌株。第4步,对目标复合菌进行复筛[8]。制备复合菌的菌种扩大培养液,测定菌株之间的协同作用。采用滤纸崩解试验:在滤纸条液体发酵培养基中分别接入一定量的菌液(单一菌液,复合菌液以及空白对照),并在发酵液中加入1根1.0 cm×5.0 cm的滤纸条,观察滤纸崩解情况。筛选最适复合菌搭配比例。采用三角瓶滤纸条馈烂实验:按照4因素3水平正交表(表4),设10、20和30 mL 3个接种量,对最优菌系的4株菌进行最适组合比例筛选,同时备一个空白试验,不加任何微生物菌液;在每个试验中都加入同等重量的滤纸条,观察滤纸条的溃烂情况。第5步,分子鉴定。

表1 菌株基本情况
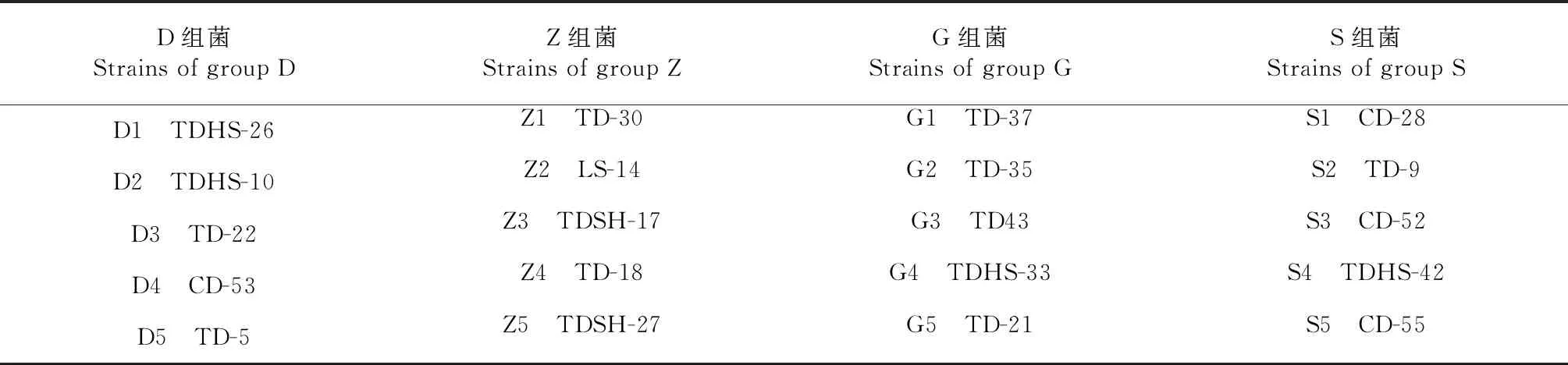
表2 供试菌株分组及编号情况

表3 复合微生物菌构建情况
1.3 数据分析
采用SPSS 20.0和Microsoft Office Excel 2007进行相关数据分析。
2 结果与分析
2.1 拮抗关系筛选结果
羧甲基纤维素培养基平板上的“十”字点接培养发现,在25组复合菌系中,有14组生长正常;7组存在一定生长抑制,但是各株菌间并没有观察到明显的拮抗和抑制孢子生成等现象;其他的4组(CM7、CM9、CM18和CM20)则存在显著的生长拮抗和抑制现象,表现为菌株组合在培养基上生长缓慢、菌落小,有的直接不生长。复合菌系菌株间的拮抗关系试验结果,将组合待筛选的25组菌系直接筛选为21组。这一筛选结果也表明了复合菌系的组合是需要进行筛选的,随意的组合不一定有利于菌株的生长,也可能直接抑制其生长,对组合菌的功能会起到不利的作用,也不便于复合菌的混合发酵培养。在复合菌系的进一步筛选中,将不再对CM7、CM9、CM18和CM20进行研究,25组待选菌系减少为21组。
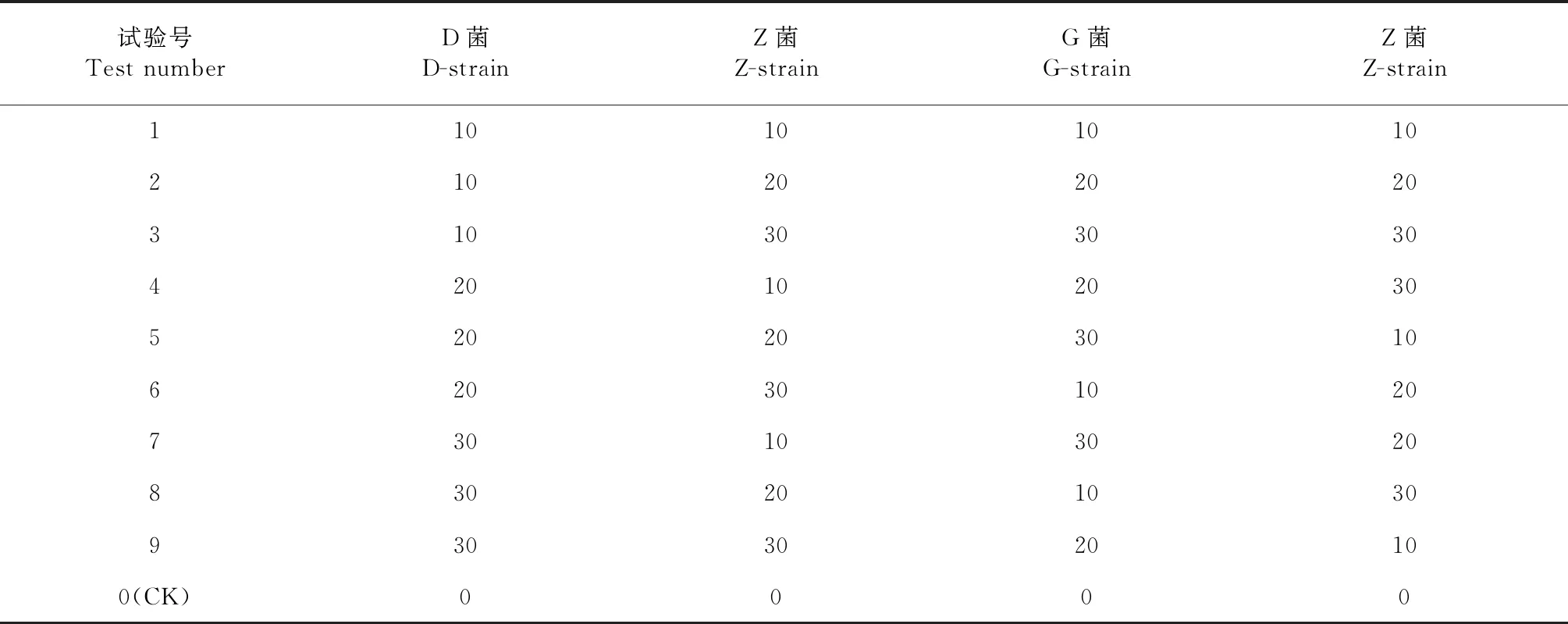
表4 复合菌系最适混合比例筛选
2.2 不同温度、酸碱度等条件下复合菌系的筛选结果
从表5可见,21组待筛组合均表现出不同的分解纤维素的CMC酶活和滤纸PFA酶活。(1)CM3、CM16、CM5、CM11、CM2、CM8、CM4、CM12、CM13和CM14共10组菌对温度变化和酸碱度变化较为敏感,环境适应性范围相对窄。在环境变化过程中,特别是在高温环境和高碱性环境中,该组合菌的纤维素的降解功能便失效,或是CMC酶活降低,直至无法再进行纤维素的分解。
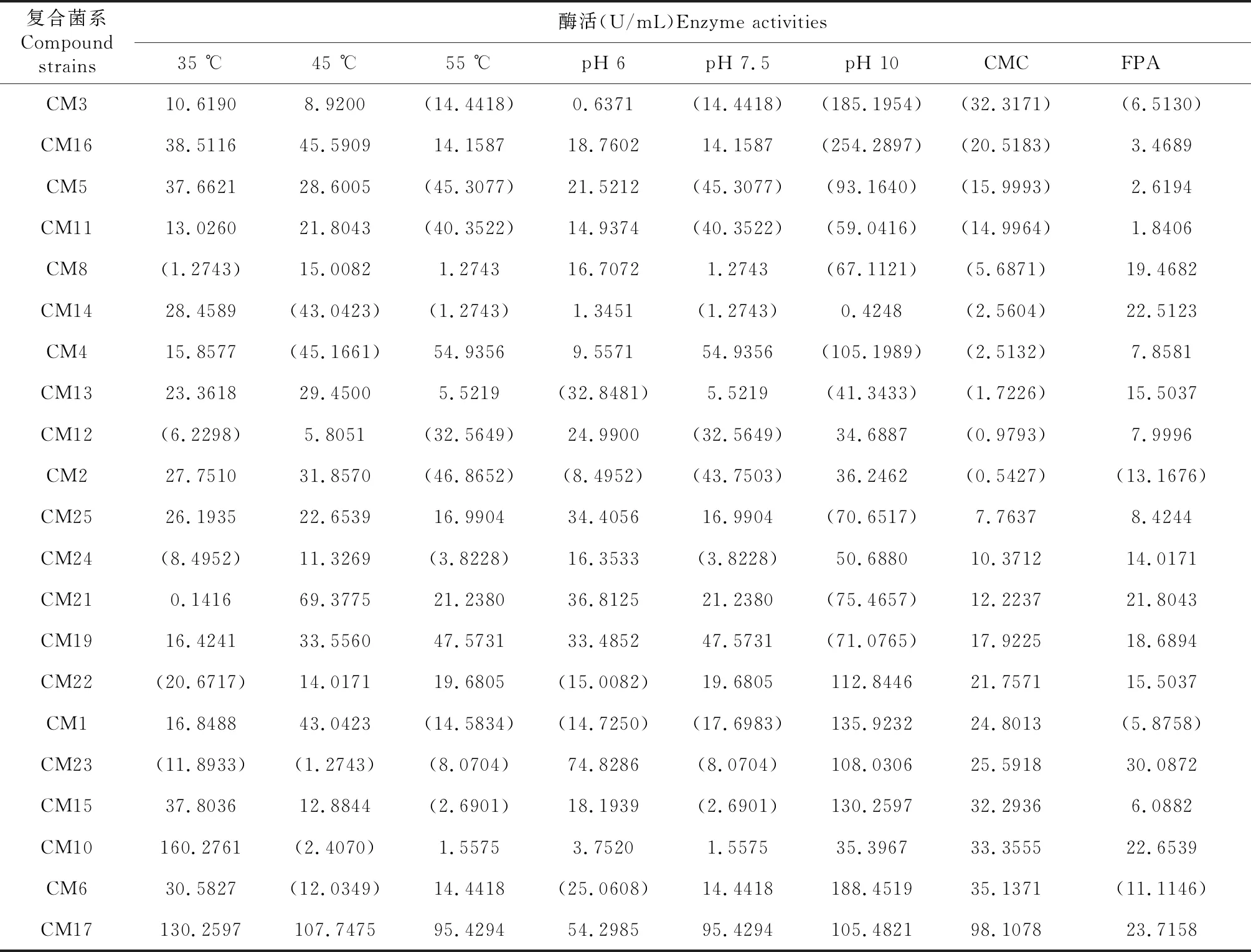
表5 复合菌系在不同条件下的酶活

图1 CM3等10组菌在不同环境条件下的CMC酶活 Fig.1 CMC enzyme activities of 10 groups of bacteria such as CM3 under different environmental conditions

图2 CM3等10组菌在pH 7.5的滤纸FPA酶活 Fig.2 FPA enzyme activities of 10 groups of bacteria such as CM3 in pH 7.5
在图1中,随着温度由35 ℃,经过45 ℃,升高为55 ℃,这10组菌的酶活逐渐降低,表现出对温度升高的不耐受性,在55 ℃高温条件下,基本已无法再分解纤维素,酶活检出基本均为负数;在酸碱变化条件下,由酸性条件(pH 6)逐渐变为高碱性条件(pH 10)时,这10组菌从有酶活至无酶活,表现出对酸性条件的适应性和对碱性,特别是高碱性条件的极不耐受性。不同环境条件下的CMC酶活测定结果表明,这10组菌只适合在中低温条件和酸性条件下分解纤维素,在高温条件和碱性条件下,纤维素分解能力受到抑制。生物堆肥的环境变化极为复杂,同时,堆肥中存在高温阶段变化,这10组菌对高温和碱性的极度敏感和不耐受性,决定了其不适合作为生物堆肥菌剂,如果非要使用它们作为菌剂,也只能应用于堆肥前期,堆肥升温后将无法发挥作用。此外,在图2中,未检测到CM2和CM3的滤纸FPA酶活,其他8组菌都具有一定的滤纸FPA酶活。图1~2结果表明,CM3等10组菌属于中低温和酸性环境适应性组合菌,对高温和碱性环境存在环境不耐受性。
CM1、CM23、CM24、CM15、CM10、CM6、CM25、CM22、CM21、CM19和CM17共11组菌对温度变化和酸碱度变化的敏感性存在差异。如图3所示,温度变化对该11组菌的CMC酶活影响不敏感,表现为在低温、中温和高温条件下的酶活变化趋势不显著,相对低温35 ℃和高温55 ℃,该11组菌在45 ℃表现得更为活跃一些,低温到高温的变化并没有对其酶活产生明显的抑制作用,除了CM10,该组合菌在低温时酶活表现活跃,随着温度升高,其酶活受到明显抑制,该菌比较偏好低温环境。酸碱变化对该11组菌的酶活影响较为显著;在pH 6的酸性环境和pH 7.5的弱碱性环境中,它们的酶活变化并不明显,说明,它们对酸性和弱碱性环境具有一定的适应性,然而,当环境变为高碱性环境,CM25、CM21和CM19的酶活表现为受到明显抑制,说明,CM25、CM21和CM19不能耐受碱性条件,偏喜酸性和弱碱性环境;其他8组菌并没有受到碱性环境的抑制,反而表现出对碱性环境的偏好,酶活不仅没有受到抑制反而升高了。在CM1等11组菌中,无论温度条件改变还是酸碱条件改变,CM17的酶活都比较稳定,既能适应高温环境,在酸性和碱性环境中仍然表现良好。
由图3分析得到,CM10为低温适应型;CM25、CM21和CM19为不耐受碱性条件型;CM1、CM23、CM24、CM15、CM6、CM22和 CM17为温度耐受型,同时比较偏好碱性环境,它们的环境适应性相对较广。

图3 CM1等11组菌在不同环境条件下的酶活Fig.3 Enzyme activities of 11 groups of bacteria such as CM1 under different environmental conditions
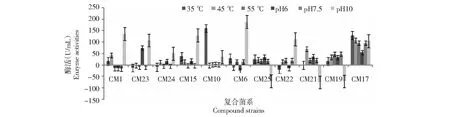
图4 CM1等11组菌在不同环境条件下的酶活 Fig.4 Enzyme activities of 11 groups of bacteria such as CM1 under different environmental conditions
从图4可见,CM17的柱形最为整齐,在35、45和55 ℃,以及pH 6、7.5和10都有明显的柱形表现,其他组合的柱形表现相对欠佳,不是柱形差距太大就是某些柱形的酶活为负值。CM17的柱形表明,该菌系对温度变化和酸碱变化的适应性较稳定。
从图5可见,CM17具有最大的累积酶活,CM17在不同环境条件下,都具有较好的CMC酶活,纤维素分解能力较佳。
从图6可见,CM1等11组菌中,CM1和CM6未检测到滤纸FPA酶活,其他组合都具有滤纸FPA酶活,表明CM1和CM6的综合纤维素分解能力较弱。
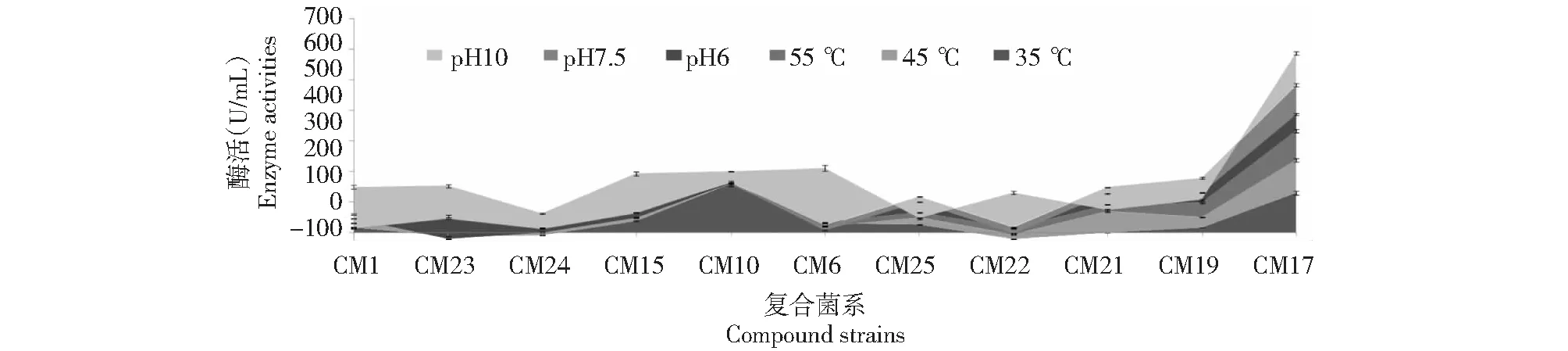
图5 CM1等11组菌在不同环境条件下的酶活 Fig.5 Enzyme activities of 11 groups of bacteria such as CM1 under different environmental conditions

图6 CM1等11组菌的在pH 7.5的滤纸FPA酶活 Fig.6 FPA enzyme activities of 11 groups of bacteria such as CM3 in pH 7.5

a, b, c, d分别是CD53、LS14、CD52和TD21菌株在CMC琼脂培养基上的生长菌落a, b, c and d showed the colonies of the CD53, LS14, CD52 and TD21 on CMC agar medium, respectively图7 CM17在平板培养基上的生长情况Fig.7 The growth of the CM17 on CMC plate
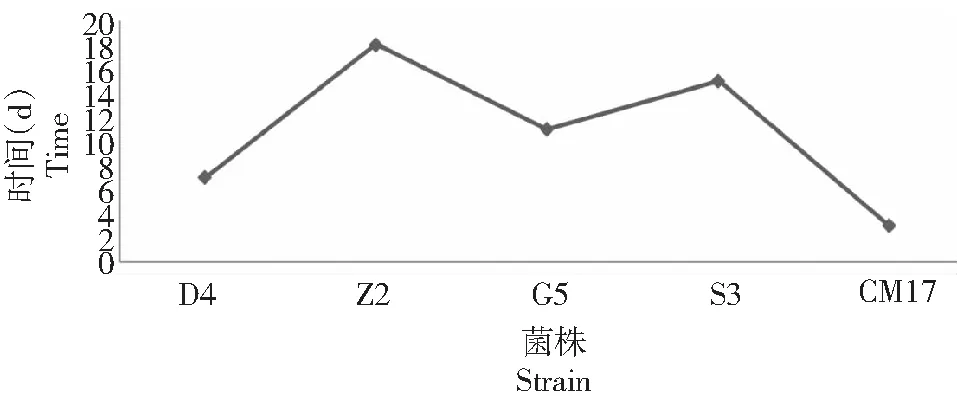
图8 CM17、D4等的滤纸完全崩解时间Fig.8 The time of completely dissolving the filter paper for CM17,D4 and other strains
(3)通过比较分析,将CM17作为筛选的目标菌,该菌系无论在酸性环境、碱性环境,还是低温、高温,都具有较好的纤维素分解能力,对环境具有广泛的适应性,其在35、45和55 ℃,pH 6、7.5和10的酶活分别为130.2597、107.7475、95.4294、54.2985、95.4294 和105.4821 U,平均CMC酶活为98.1078 U,并且其滤纸FPA酶活为23.7158 U。
2.3 CM17复合菌的形态及鉴定
D4(CD-53)、Z2(LS-14)、G5(TD-21)和S3(CD-52)4株菌组合构成了复合菌剂CM17,各菌株的菌落形态特征及16SrDNA分子鉴定如图7。分子鉴定结果表明,CM17复合菌剂里包含有菌链格孢属Alternaria,链霉菌属Streptomyces,厄氏菌属Oerskovia,短梗霉属Aureobasidium等菌,是一个包含有细菌和真菌的复合菌剂。
2.4 CM17的进一步筛选研究
2.4.1 复合菌剂协同作用 从图8可见,CM17组合菌系比其单菌株具有较好的纤维素分解效果,同等条件下完全崩解同等重量的滤纸,CM17需要72 h(3 d),而D4、G5、S3、Z2等单菌株分别需要7、11、15和18 d;CM17的纤维素分解效率至少是其单菌株的2.33倍。由此可见,CM17分解纤维素的效率较高,究其原因,是由于复合菌之间的协同分解作用提高了CM17的滤纸崩解效率。
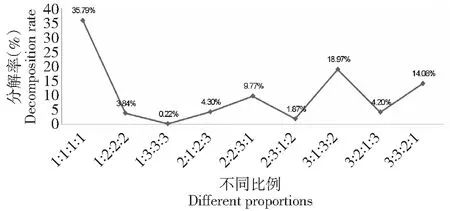
图9 不同混合比例的CM17的滤纸分解结果 Fig.9 The filter paper disintegration ratio of CM17 mixed with different proportions
2.4.2 CM17的最适搭配比例 从图9可见,D4、Z2、G5、S3按照不同比例混合的CM17,它们的72 h滤纸崩解结果表明,复合菌系各菌株之间的协同作用会受到各菌株组合量的影响。当D4,Z2,G5,S3的混合体积比例为1∶1∶1∶1时,该菌系的滤纸分解率高达35.79 %;但是,当D4∶Z2∶G5∶S3的混合比例为1∶3∶3∶3时,CM17的滤纸分解率仅为0.22 %。该结果表明,CM17复合菌剂中,D4等4种菌的含量大小会影响CM17对滤纸的降解能力,影响其对纤维素的协同降解作用。由D4,Z2,G5,S3按照1∶1∶1∶1混合的CM17,具有较佳的协同降解纤维素的能力,能有效的提高菌剂降解纤维素的效率。
3 讨 论
一般在筛选复合微生物时,很多都选择直接从相应的环境条件或土壤中分离出优势菌,再进行组合研究,培养成复合微生物,例如从土壤中分离纯化出不同类型的微生物菌株,再选择搭配优势群体培养成复合微生物菌剂[9]。在复合微生物菌剂的制备中,各个菌种复合的比例是一个影响复合微生物功能的一个重要因素。不同纤维素降解菌的降解能力相差较远,各纤维素降解菌之间存在着协同和拮抗作用,复合菌系中微生物相互作用和影响也很复杂。研究发现,复合微生物各菌株之间存在的拮抗作用,可以通过调整菌种配比来降低各个菌株间的拮抗作用[10],因此,由2种以上的微生物构建的复合菌在制备时,都对其组合配比进行研究,例如乳酸菌、酵母菌和枯草芽孢杆菌复合发酵适宜添加比例为2∶2∶2[11];康氏木霉、白腐菌、变色栓菌与EM菌、固氮菌、解磷菌和解钾菌组合的高效复合微生物菌剂Ⅴ的最佳配比为15∶15∶15∶25∶10∶10[12];细菌、放线菌、酵母菌和真菌的最佳配比为3∶3∶3∶1[13];绿色木霉、米曲霉、枯草芽孢杆菌和假单胞菌组成的复合菌,它们之间的搭配比例在2∶2∶1∶1时,效果表现较佳[14];通过研究,CM17的最佳菌剂配比为1∶1∶1∶1。
筛选纤维素分解菌的很多研究,强调更多的是菌剂在某一特定环境条件下的功能,并不特别关注其是否具有环境广适性:例如只研究纤维素菌在温度为35 ℃、发酵液初始pH值为6.5时的CMCase和FPase产酶活性[15];用4株菌进行不同组配,研究不同pH值对最佳复合菌系产酶活性的影响, 发现在偏碱性和偏酸性条件下表现出较高的酶活力[16];以高温期的堆肥样品为材料,筛选构建木质纤维素分解菌复合系[17];堆肥中木质素降解的最适温度在40~50 ℃[18],而嗜热真菌的最适温度为40~50 ℃,因此筛选嗜热菌;为解决低温条件下玉米秸秆降解难的问题,专门筛选低温复合微生物菌[19]等。在堆肥过程中,环境条件变化可能对菌剂的稳定性造成影响,特别是温度变化,酸碱度变化等这些对微生物生长影响极度敏感的因素,此外,堆肥过程中的高温阶段,温度可达到60~70 ℃,复合菌剂在高温下是否可以继续发挥作用?此外堆肥的材料多种多样,繁杂而又不稳定,整个堆肥发酵过程中不断发生各种物理和化学变化,复合菌剂是否具有足够的稳定性来适应这些变化和不确定的环境因素?因此研究筛选复合菌,更着重关注菌剂的环境广适性和功能稳定性,筛选既具有环境稳定性,又有纤维素分解能力的复合菌,为此广泛选用了20种直接来自于环境的微生物,构建25组复合菌,在不同温度、不同酸碱度条件下研究其纤维素酶活,筛选得到CM17。青格尔等[20]对复合菌系GF-20的功能稳定性及适应性研究发现,复合菌系GF-20可在较大的温度和pH范围内保持较高的纤维素和半纤维素酶活性,能发挥秸秆降解作用。有研究发现复合菌会影响环境pH值,主要表现在,复合菌系对发酵液的pH值有良好的调节作用[21];青格尔等发现发酵液pH值随发酵时间的延长趋近于中性;复合系对环境pH的变化具有较强的缓冲调节能力,在不同初始pH的发酵环境下,其反应体系内的pH变化趋势相似[22];复合菌系的自我调节能力使发酵液中pH能够恢复到中性或偏碱性[23],有研究发现复合微生物可以改变腐解过程中温度与水解酶活性[24]等等。而CM17的纤维素酶活功能在不同的酸碱条件下都表现出很高的稳定性。王卫东等[25]对纤维素分解菌复合系WSC-6的稳定性研究发现,在pH 4~10的范围内,复合系对pH值具有缓冲能力,并正常分解纤维素。朴哲等发现纤维素分解菌复合系MC1的纤维素酶在65 ℃以下和pH 4.5~10.5表现出很高的稳定性,但超出此范围,酶活性急剧下降直至丧失[26]。而CM17在35~55 ℃和pH 6~10都能正常分解纤维素,表现纤维素酶活功能具有稳定性,在制备堆肥微生物菌剂中具有良好的应用前景和潜力。
4 结 论
由链格孢菌、链霉菌、厄氏菌和短梗霉菌组合的纤维素降解菌系CM17具有良好的功能稳定性,其对温度和酸碱的适应范围较广,外界温度和酸碱变化对该复合菌功能影响较小,在35~55 ℃和pH 6~10,都能正常的分解纤维素,表现出很高的纤维素酶活功能稳定性;CM17比单菌株具有较好的纤维素分解效果,其纤维素分解效率至少是单菌株的2.33倍;该复合微生物的最佳配比为1∶1∶1∶1,在制备生物堆肥微生物菌剂中具有良好的应用前景和潜力。

