微塑料(MPs)与全氟辛烷磺酸盐(PFOS)复合暴露对普通小球藻的毒性研究
苏佳伟 俞博浩 张德勇
【摘 要】为分析MPs与PFOS染物复合暴露对普通小球藻的毒性效应,分别设计了两种物质单独及复合染毒实验,以普通小球藻为受试生物,分析增殖速度及各生理指标。单独染毒实验证实MPs、PFOS均会抑制藻类的增殖速度,96h-EC50值分别为95.85 mg/L和311.06 mg/L;伴有叶绿素含量、总抗氧化能力、抗氧化酶活力、可溶性蛋白含量的下降;另外蛋白表达异常、MDA含量上升。复合染毒时仍出现上述毒性效应,但各指标的联合毒性普遍低于单独染毒的效应之和,即呈现出一定的拮抗效应,但是当染毒物质的剂量提高后,这种拮抗效应有所减弱。
【关键词】微塑料(MPs);全氟辛烷磺酸盐(PFOS);普通小球藻;复合暴露;毒性效应
微塑料(Microplastics,MPs)指尺寸小于5 mm的塑料碎片、颗粒及纤维,因其体积小而易于进入生物体内。人类大量使用塑料已有100多年,据统计仅我国2016年塑料制品总产量就达到了7717万吨。塑料制品的滥用和排放已致大量MPs进入了环境介质,成了重要的环境污染物。藻类是水生生态系统中的初级生产者,处于食物链底端,评价MPs对藻类的影响可以为全面认识其生态危害提供很好的切入点。当前关于MPs的毒性效应及其机制的研究尚不够系统,针对藻类的研究尤其不足。MPs对藻类的毒性可为可抑制细胞生长、破坏细胞膜结构、降低叶绿素含量和光合效率、引起细胞氧化损伤等,且毒性大小与微塑料本身的种类、大小、浓度等有关[1-3]。
Besseling等研究了纳米的聚苯乙烯(PS)对斜生栅藻生长和光合作用的影响,在实验浓度范围内,随纳米级PS 浓度增加藻细胞生长抑制率升高,相反,叶绿素a 含量降低[4]。Zhang 等的实验结果表明96 h暴露实验后,微米级聚氯乙烯对中肋骨条藻生长抑制率可达39.7%;在高浓度(50 mg/L)暴露实验中,叶绿素含量和光合效率也明显下降;而毫米级微塑料聚氯乙烯(MP-PVC)对微藻的生长没有明显影响。观察发现PVC破坏了藻细胞的细胞壁和细胞膜的完整性。PVC暴露实验初期,藻细胞生长明显受到抑制、叶绿素含量和光合效率明显下降;暴露实验后期,不良影响效应减小,但仍低于空白对照水平在另一研究中,MP-PS明显抑制特氏杜氏藻生长,并且PS 粒径越小抑制作用越明显,但对光合作用却没有影响[3]。另外,Bhattacharya等发现MP-PS不仅能降低小球藻和栅藻光合作用效率,而且还增加了藻细胞内活性氧(ROS)的含量。微塑料影响藻细胞生长的同时,藻细胞也会产生应激反应以减小、修复微塑料对其造成的损伤,但当损伤程度超出藻细胞自我修复能力范围后会导致藻细胞生长异常或死亡。Mao等研究聚苯乙烯微塑料(MP-PS)对蛋白核小球藻的毒性,并首次报道了微塑料具有抑制和刺激藻细胞生长的双重作用[1]。同时,MPs对水中的溞类、贝类等低等动物的毒性效应也被证实,因此可以说MPs对水生生态系统的威胁是全方位的[5-9]。
但当前研究绝大多数采用了MPs单独染毒方式,其结论远远不能反映实际环境中MPs因和其他污染物共同存在可能导致的复合效应。为分析MPs与其他污染物联合暴露对淡水藻类具有何种效应并初步揭示其产生机制,本研究拟评价不同剂量的MPs与PFOS联合染毒后,对普通小球藻的增殖、光合作用、抗氧化能力等方面的毒性效应及其与单独染毒的差异。其中所选择的PFOS污染物是水体环境中普遍存在的具有代表性的污染物,它具有亲脂性、持久性、生物累积性和生物毒性等特点,且被证实对多种生物具有毒性效应[10-13]。本研究的结果有助于更全面地认知MPs与水体中其他污染物联合暴露对藻类的复杂毒性效应,为相关污染物的治理提供科学依据,并为进一步研究其对高等生物的毒性效应提供参考。
1 材料与方法
1.1 藻类培养及染毒方案
普通小球藻(Chlorella vulgaris)及淡水绿藻专用培养基购自中科院水生所。微塑料材料为聚乙烯(PE)原料粉末,粒径为微米级。藻类培养条件为25℃、12h/12h光暗循环。单独染毒、联合染毒方案参见结果部分的表格。藻类染毒后继续培养96h后分析各指标。
1.2 藻类生物量的光密度分析法的建立
首先对藻液进行全波长扫描,找出特征吸收峰。然后分别利用吸光度法与显微镜计数法建立藻浓度与吸光度值之间的回归方程。
1.3 藻类的生长抑制效应分析及96h-EC50值计算
基于A690值绘制生长曲线,建立抑制率P和浓度的自然对数LnC的线性回归关系,求解抑制率为50%的浓度值即EC50值。抑制率P(%)=(对照组A690-处理组A690)/对照组A690
1.4 抗氧化酶活性测定
1.4.1 SOD活性测定
收集藻细胞,研磨、离心,取上清为SOD粗提液。采用邻苯三酚自氧化法测定SOD活力,再按照2.35mL Tris-HCl缓冲液、1.8mL蒸馏水、0.15mL邻苯三酚溶液、200μL样液的反应体系测定ΔA325。U=[(A325-ΔA325)/ΔA325×100%]/50%×Vs×D/V总。
1.4.2 POD活性测定
藻细胞破壁后,上清充分转入25mL容量瓶定容。取比色皿加入反应混合液3ml和酶液1mL。立即开启秒表记录A470,每隔1min读数1次,共5min。U=(A470×0. 01×W ×t)×样品稀释倍数。
1.4.3 CAT活性测定
藻细胞破壁后,加入3mL0.05mol/L pH7.8 PBS,再加入200μL 30%H2O2迅速摇匀,1分钟后开始,每1 min記录1次A240,连续记录5min。U=ΔA240×Vt/W/Vs/0.01/t。
1.5叶绿素含量测定
藻液用高速离心法提取,加1.5mL乙醇和少许石英砂研磨,转入离心管定容到10mL,于4℃黑暗提取12h;4000rpm离心10min;上清于比色管中用90%乙醇定容10mL。于比色皿中,测吸光值。叶绿素a浓度(mg/L)=(11.64A633+2.16A645+0.10A630)V1/1000V2。式中V1为提取液定容体积(mL);V2为滤液体积(L)。
1.6可溶性蛋白含量测定
取藻类破壁离心后的上清于1cm光程石英比色皿中测定A280和A260,按公式计算可溶性蛋白含量。
1.7 藻类MDA活性测定
藻液离心后加10%TCA研磨,匀浆液12000rpm离心10min。取2mL上清于试管,加入0.6%硫代巴比妥酸2mL,沸水浴10min。4500rpm离心10min,取上清测吸光度。MDA浓度=6.45(A532-A600)-0.56×A450。
1.8 统计分析
采用单因素方差分析(One Way ANOVA)分析处理组与对照组之间的差异显著性,p<0.05为显著。
2 结果
2.1藻类生物量的光度分析法的建立
经连续波长扫描,普通小球藻在690nm处有吸收峰;然后基于藻密度与A690建立了线性回归方程:y=0.025x+0.0403;R?=0.9613。二者具有较理想的线性关系,便于快速测定藻类生物量。
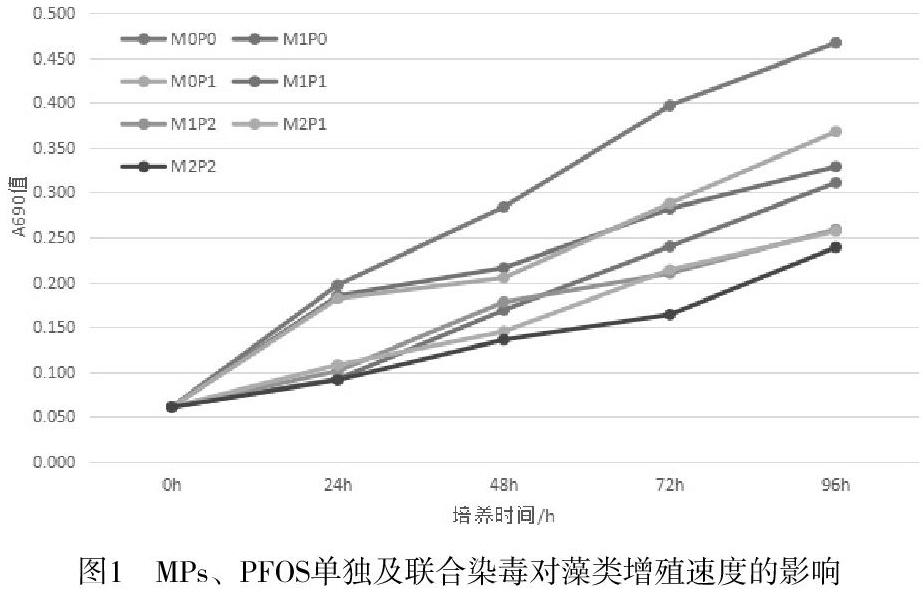
2.2单独及联合染毒对普通小球藻的增殖速度的影响
如图1所示,MPs及PFOS单独染毒对小球藻均有抑制效应,96h-EC50为95.85mg/L。联合染毒则均呈现为拮抗作用,即MPs+PFOS联合染毒引起的抑制率小于单独染毒的抑制率之和(0.405<0.517;0.334<0.508)。
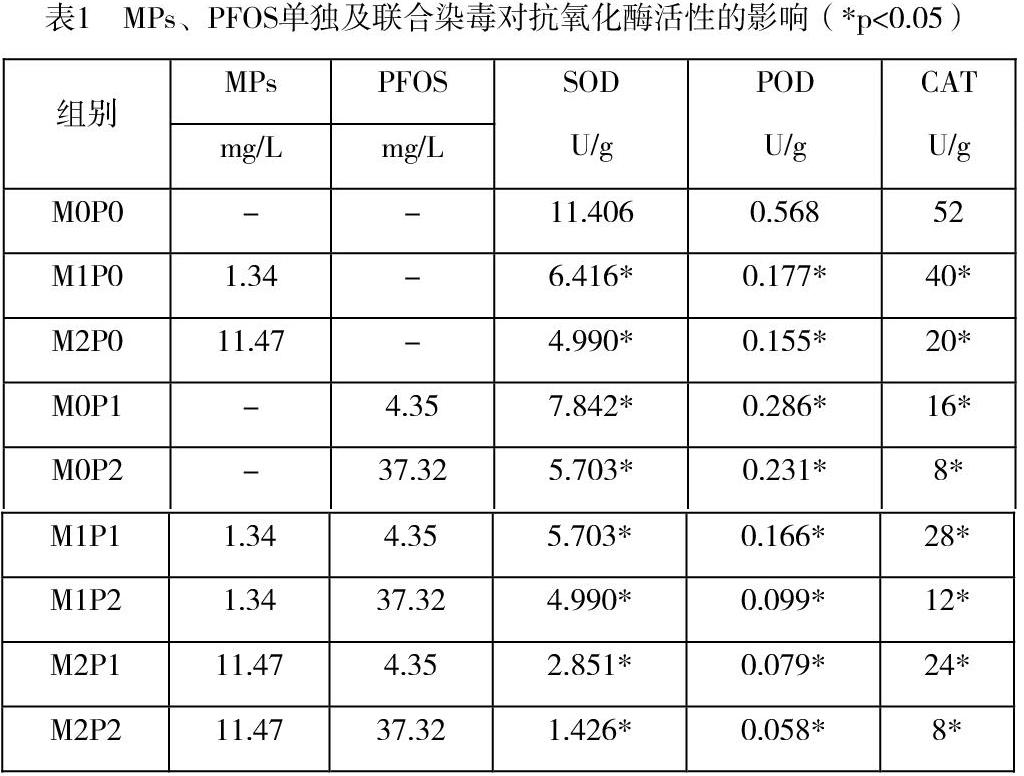
2.3单独及联合染毒对普通小球藻抗氧化酶活性的影响
如表1所示,单独染毒下三种物质对藻类的抗氧化酶活性均有抑制效应。联合染毒时,MPs+PFOS的抑制值(SOD 9.980、5.703;POD 0.510、0.469;CAT 44、24)小于單独染毒相加之和。因此MPs与PFOS联合染毒时均呈现为拮抗作用。
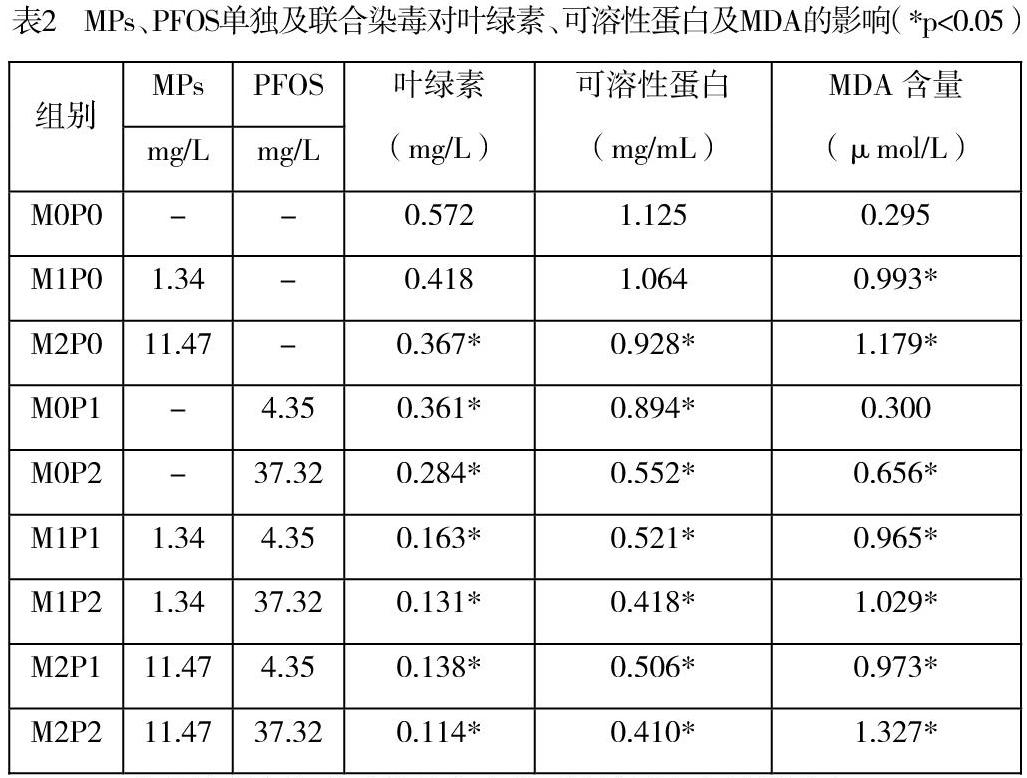
2.4 MPs单独及联合染毒对普通小球藻叶绿素含量的影响
如表2所示,染毒物单独染毒均可导致小球藻叶绿素含量下降。联合染毒的表现则以轻度的协同效应为主。MPs+PFOS的联合效应则因剂量不同而出现了一些波动(0.458<0.493;0.409>0.365)。
2.5 单独及联合染毒对普通小球藻可溶性蛋白含量的影响
如表2所示,MPs和PFOS的染毒均导致小球藻的可溶性蛋白含量下降。而在联合染毒实验中,MPs+PFOS呈现低剂量时表现为协同作用(0.640>0.290),高剂量表现为轻度拮抗(0.715<0.770),这种情况比较复杂,显示不同污染物之间的作用可能会受各种因素影响,甚至会因剂量的不同出现相反的结果。
2.6 MPs单独及联合染毒对普通小球藻MDA含量的影响
如表2所示,各染毒组MDA 含量均高于空白对照组,且随着染毒浓度的增加而升高,而在低浓度PFOS 下其MDA 含量(0.300)与空白对照组(0.295)相差不大,可见低浓度的PFOS 对藻类MDA含量影响不大。同样的比较MPs 阴性染毒组与PFOS 阴性染毒组,如M2P0 的MDA 含量为1.179μmol/L,而M0P2 的MDA 含量为0.656μmol/L 可以发现MPs 对藻类MDA 含量的毒性效应更大更显著。联合染毒组的MDA 含量升高程度普遍小于所对应的单独染毒组之和。故可以认为MPs与PFOS 联合染毒表现了一定的拮抗效应。
3讨论
当前MPs已成为引人关注的重要污染物。水中的MPs会被生物误以为浮游生物而主动对其进行捕食,从而进入生态系统的食物链(网)。研究发现许多水生动物的胃、消化管、肌肉等组织和器官中均含有微塑料存在。近来甚至在人体内也普遍检测到了微塑料的存在,且种类多达数十种。藻类是水生生态系统的生产者,MPs对藻类的影响关系到整个水生生态系统的维系。在本研究中,MPs被证实能抑制普通小球藻的增殖,并引起叶绿素含量、抗氧化能力等的下降等,这一结论与与以往在其他藻类上的研究报道基本一致(虽然以往某些研究称观察到同时促进和抑制藻类生长的所谓“双重效应”,但属于个例,在本研究所采用的普通小球藻上未观察到此情况)。同时,与以往研究不同,本研究更侧重于考察MPs与其他污染物联合暴露时呈现的毒性效应。除了叶绿素指标有点例外,在所研究的绝大多数指标中,我们均证实了MPs、PFOS联合暴露时,会呈现一定的拮抗效应,即联合毒性低于两种物质单独暴露引起的毒性之和。这一现象以往罕有探讨,初步分析其原因可能是MPs具有较强的吸附性和漂浮性,导致其他污染物能被吸附在其颗粒上而无法发挥对藻类的毒性。另外,结果也显示当染毒剂量双双升高时,拮抗效应往往有所减弱。
本研究在评估藻类的状态采用了叶绿素、抗氧化状态、蛋白表达、可溶性蛋白含量几个重要指标。叶绿素是光合作用的执行者,测定叶绿素含量可以了解植物物质转化的程度和速度,其含量高低直接反映藻类的生长繁殖能力。以MPs+PFOS联合染毒为例,空白对照组叶绿素含量为0.572mg/L,而各染毒组依次为0.367、0.284、0.163、0.131、0.138和0.114mg/L,最低组仅为空白组的19.9%,降低非常明显。虽然联合染毒有一定的拮抗效应,但对于缓解这种毒性效应实际意义不大。藻类的抗氧化能力的强弱与健康程度存在着密切联系,抗氧化酶的活力有助于大致藻类的健康状况。以MPs+PFOS联合染毒为例,为了充分评估普通小球藻的抗氧化状态,分别测定了3种抗氧化酶的活力。其中SOD是负责清除氧自由基的酶,POD藻类体内负责分解过氧化物的酶,CAT是能够催化过氧化氢分解为水和分子氧,这三者均是藻类抗氧化损伤、清除代谢废物的关键物质,对藻类的生长代谢非常重要[14,15]。以MPs与PFOS对小球藻的SOD活性影响为例,空白组SOD活性为15.946U/g,MPs染毒组的数值分别为7.248U/g、5.315U/g,联合染毒组中活性最高的为3.383U/g,最低的为0.966U/g,分别为对照组的45.45%、33.33%、21.21%和6.05%。可溶性蛋白质有助于藻类对抗环境胁迫,还能增加细胞渗透浓度和功能蛋白的数量,有助于维持细胞正常代谢,因此也是反映抗逆状态的指标。在本研究中,低剂量的MPs对可溶性蛋白产生的毒性效应微小,但POFS结合后则会产生协同作用,大大增强TCS对可溶性蛋白的毒性。MDA是膜脂过氧化作用的最终分解产物,其含量反映藻类遭受逆境伤害的程度。MPs在本研究被证实对藻类的细胞膜能够造成严重危害,并且在MPs与PFOS联合染毒中对MDA含量存在着协同作用。这进一步增强了染毒物对藻类细胞膜的破坏。
本研究初步证实了MPs对藻类有显著的毒性效应但同时也能适度减轻水体中存在的其他污染物的毒性。当多种毒物同时作用于藻类时,呈现的效应非常复杂。MPs的毒性机制涉及破坏光合作用、损害抗氧化能力、影响某些蛋白的表达等,但尚有许多问题有待进一步研究,例如在具体哪些蛋白发生了表达异常、微塑料有无引起藻类的DNA损伤等。
参考文献:
[1]Mao YF,Ai HN,Chen Y,et al. 2018. Phytoplankton response to polystyrene microplastics:perspective from an entire growth period[J]. Chemosphere,208:59-68.
[2]Sjollema SB,Redonda-Hassele RP,Leslie HA,et al. 2016. Do plastic particles affect microalgal photosynthesis and growth? [J]. Aquatic Toxicology,170:259-261.
[3]Zhang C,Chen XH,Wang JT,et al. 2017. Toxic effects of microplastic on marine microalgae Skeletonema costatum:Interactions between microplastic and algae [J]. Environmental Pollution,220:1282-1288.
[4]Besseling E,Wang B,Lurling M,et al. 2014. Nanoplastic affects growth of S. obliquus and reproduction of D. magna [J].Environmental Science & Technology,48(20):12336-12343.
[5]Ogonowskl M,Schur C,Jarsen A,et a1. 2016. The effects of natural and anthropogenic microparticles on individual titness in Daphnia magna. PLoS One,11(5):e0155063
[6]Paulpont I,Lacroix C,González FC,et al. 2016. Exposure of marine mussels Mytilus spp. to polystyrene microplastics:Toxicity and influence on fluoranthene bioaccumulation [J]. Environmental Pollution,216:724-737.
[7]Sussarellu R,Suquet M,Thomas Y,et al. 2016. Oyster reproduction is affected by exposure to polystyrene microplastics[J]. Proceedings of the National Academy of Sciences of the United States of America,113(9):2430-2435.
[8]Ziajahromi S,Kumar A,Neale P A,et al. 2017. Impact of microplastic beads and fibers on waterflea(Ceriodaphnia dubia)survival,growth and reproduction:Implications of single and mixture exposures[J]. Environmental Science & Technology,51(22):13397-13406.
[9]江敏,袁璐瑤. 全氟辛烷磺酸(PFOS)的环境污染及生态毒性研究进展[J]. 安全与环境学报,2014(4):207-212.
[10]Gilbert RJ,Williams PE. 1987. The oral retention and antiplaque efficacy of triclosan in human volunteers[J]. British Journal of Clinical Pharmacology,23(5):579-583.
[11]Kannan K,Corsolini S,Falandysz J,et al. 2004. Perfluorooctanesulfonate and related fluorochemicals in human blood from several countries[J]. Environ. Sci. Technol.,38(17):4489-4495.
[12]Olsen GW,Burris JM,Ehresman DJ,et al. 2007. Half-life of serum elimination of perfluorooctanesulfonate,perfluorohexanesulfonate and perfluorooctanoate in retired fluorochemical production workers[J]. Environ. Health Perspect.,115(9):1298–1305.
[13]王海涛. 全氟辛烷磺酸及其盐类的毒性研究[J]. 水产学杂志,2017,30(4):55-58..
[14]Bajguz A. 2010. An enhancing effect of exogenous brassinolide on the growth and antioxidant activity in Chlorella vulgaris cultures under heavy metals stress[J]. Environmental and Experimental Botany,68(2):175-179.
[15]Lee TM,Shiu CT. 2009. Implications of mycosporine-like amino acid and antioxidant defenses in UV-B radiation tolerance for the algae species Ptercladiella capillacea and Gelidium amansii[J]. Marine Environmental Research,67(1):8-16.
作者简介:
苏佳伟,2000年11月出生,男,汉族,浙江嘉兴人,本科生,研究方向为生物工程,单位:浙江树人大学;
俞博浩,2000年6月出生,男,汉族,浙江舟山人,本科生,研究方向为生物工程,单位:浙江树人大学;
通讯作者:
张德勇,1978年4月出生,男,汉族,山东聊城人,博士生,教授,研究方向为毒理生态学,工作单位:浙江树人大学。
基金项目:
本研究受浙江树人大学实验室开放项目(2021JS3012)资助。
(作者单位:浙江树人大学生物与环境工程学院)

