超声辅助提取澳洲坚果青皮总黄酮工艺优化及抗氧化性能研究
张明 杜丽清 马飞跃 帅希祥 涂行浩

摘 要:以澳洲坚果青皮为原料,研究了超声辅助提取总黄酮工艺条件以及抗氧化活性。通过L9(34)正交试验得到超声功率为300 W条件下的最佳提取工艺:提取时间为45 min、乙醇浓度为50%、提取温度为50 ℃、料液比为1∶60 (g/mL),在此条件下总黄酮提取量为(1638.59±44.26) mg/100 g。通过抗氧化实验发现,澳洲坚果青皮总黄酮ABTS自由清除能力约为Trolox的2.48倍,总抗氧化还原能力约为Trolox的1.90倍,由此表明澳洲坚果青皮总黄酮具有较强的抗氧化活性。
关键词:澳洲坚果青皮;超声辅助;总黄酮;抗氧化
中图分类号:S664.9 文献标识码:A
Optimization of Ultrasonic-Assisted Extraction and Antioxidant Activity of Total Flavonoids from Macadamia Green Peel
ZHANG Ming, DU Liqing*, MA Feiyue, SHUAI Xixiang, TU Xinghao
South Subtropical Crops Research Institute, Chinese Academy of Tropical Agriculture Sciences / Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs, Zhanjiang, Guangdong 524091, China
Abstract: The study focused on the optimization of the ultrasonic-assisted extraction and antioxidant activity of total flavonoids from macadamia green peel. An orthogonal test with four factors and three level was carried out and the optimized conditions were: ultrasonic extraction time 45 min, ethanol content 40%, extraction temperature 50 ℃, solid-liquid ratio 1∶60 (g/mL). The total flavonoids yield was up to (1638.43±44.26) mg/100g under the optimized conditions. The ABTS radical scavenging and total antioxidant capacity was about 2.48, 1.90 times of Trolox. The results indicated that the total flavonoids from macadamia green peel had strong antioxidant capacity.
Keywords: macadamia green peel; ultrasonic-assisted; total flavonoids; antioxidant
DOI: 10.3969/j.issn.1000-2561.2020.05.024
澳洲坚果(Macadamia tetraphylla L.)是一种广泛生长于澳大利亚,具有较高价值的山龙眼科木质坚果作物[1]。从引种试种至今,特别是经过近几年的快速发展,我国已成为澳洲坚果种植面积最大的国家。同时,澳洲坚果产量节节攀升,澳洲坚果加工品也逐渐增多。加工过程中占澳洲坚果(鲜果)重量1/2的青皮等加工副产物绝大部分被随意丢弃,青皮腐败后会导致当地水源、土壤等的污染[2]。有研究报道[3-4]澳洲坚果青皮中含有丰富的酚类、黄酮类等活性物质,且具有较强的抗氧化活性。如果将澳洲坚果青皮中的黄酮类物质进行提取并加以综合利用,不仅为开发天然抗氧化剂提供了原料,还有利于保护环境以及实现资源的最大化利用,也为延伸澳洲坚果加工产业链提供了有力支撑。
提取是活性物质单体分离和鉴定的重要步骤。当前,常见的植物活性物质提取方法主要有传统溶剂浸提法、微波辅助[5]、超声辅助[6]、酶辅助[7]、亚临界溶剂提取[8]、超临界溶剂提取[9]等现代提取方法。超声辅助提取以其设备简单、提取效率高等優点而广受研究人员青睐,其已被广泛应用于植物活性物质提取中,如橘皮[10]、芒果皮[11]等。但到目前为止,仍未见关于超声辅助提取澳洲坚果青皮总黄酮的研究。因此,本研究将从乙醇浓度、料液比、提取温度、提取时间和超声功率5个因素对超声辅助提取工艺进行优化,并以水溶性维生素E(Trolox)为阳性对照,研究澳洲坚果青皮总黄酮对ABTS自由基清除能力和总抗氧化还原能力,以期为澳洲坚果加工副产物的高效利用提供借鉴。
1 材料与方法
1.1 材料
1.1.1 植物材料 澳洲坚果青皮由中国热带农业科学院南亚热带作物研究所种质资源圃品名为‘南亚1号的澳洲坚果脱皮所得。澳洲坚果青皮经清洗后自然晾干,粉碎过40目筛,筛下物即为实验样品,置于4 ℃冰箱备用。
1.1.2 试剂与仪器 芦丁、水溶性维生素E(Trolox)、Fe3+-三吡啶三吖嗪(TPTZ)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-苦肼基(DPPH)、过二硫酸钾,Sigma公司;无水乙醇、醋酸,天津富宇精细化工有限公司;氯化铝,广州化学试剂厂;六水氯化铁,广东光华科技股份有限公司;亚硝酸钠,天津市福晨化学试剂厂;盐酸、氢氧化钠,国药集团化学试剂有限公司。以上试剂均为分析纯。
UTP-313 百分之一电子天平,上海花潮电器有限公司;ST40高速冷冻离心机,赛默飞世尔科技(中国有限公司);FZ-06高速药材调料粉碎机,浙江温岭市百乐粉碎设备厂;UV2007型紫外可见分光光度计,岛津企业管理(中国)有限公司;SK5210HP超声波清洗器,上海科导超声仪器有限公司。
1.2 方法
1.2.1 澳洲坚果青皮总黄酮提取方法 准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,加入一定体积乙醇溶液,在设定的料液比、提取温度、提取时间和超声功率条件下提取。提取结束后,于8000 r/min条件下离心15 min,取上清液并保存于4 ℃冰箱。
1.2.2 提取方法对澳洲坚果青皮总黄酮提取的影响 (1)超声辅助提取法。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,加入40%乙醇溶液75 mL,并置于50 ℃水浴中,在超声功率为300 W条件下提取60 min,提取结束后,8000 r/min 离心15 min,取上清液保存于4 ℃冰箱待测。
(2)传统提取法。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,加入40%乙醇溶液75 mL,并置于50 ℃水浴中提取60 min,提取结束后操作同超声辅助提取法。
1.2.3 单因素实验设计 (1)乙醇浓度对超声辅助提取澳洲坚果青皮总黄酮的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,按料液比为1∶75 (g/mL)分别加入浓度为30%、40%、50%、60%、70%、80%的乙醇溶液,并置于50 ℃水浴中,在超声功率为300 W条件下提取60 min。提取结束后操作同超声辅助提取法。
(2)料液比对超声辅助提取澳洲坚果青皮总黄酮的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,分别按料液比为1∶15、1∶30、1∶45、1∶60、1∶75、1∶90 (g/mL)加入浓度为40%的乙醇溶液,并置于50 ℃水浴中,在超声功率为300 W条件下提取60 min。提取结束后操作同超声辅助提取法。
(3)提取温度对超声辅助提取澳洲坚果青皮总黄酮的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,按料液比为1∶75 (g/mL)加入浓度为40%的乙醇溶液,并分别置于20、30、40、50、60、70 ℃水浴中,在超声功率为300 W条件下提取60 min。提取结束后操作同超声辅助提取法。
(4)提取时间对超声辅助提取澳洲坚果青皮总黄酮的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,按料液比为1∶75 (g/mL)加入浓度为40%的乙醇溶液,并置于50 ℃水浴中,在超声功率为300 W条件下分别提取15、30、45、60、75、90 min。提取结束后操作同超声辅助提取法。
(5)超声功率对超声辅助提取澳洲坚果青皮总黄酮的影响。准确称取1.00 g澳洲坚果青皮样品于100 mL离心管,按料液比为1∶75 (g/mL)加入浓度为40%的乙醇溶液,并置于50 ℃水浴中,分别在超声功率为300、350、400、450、500 W条件下提取15 min。提取结束后操作同超声辅助提取法。
1.2.4 正交试验设计 在单因素实验基础上进行L9(34)正交试验,因素水平如表1所示。
1.2.5 澳洲坚果青皮总黄酮提取量的测定[12] (1)总黄酮标准曲线的制作。准确称取一定芦丁配置浓度为200 mg/L的芦丁标准溶液,然后取一定体积200 mg/L芦丁标准溶液分别稀释为10、50、100、150、200 mg/L的芦丁标准溶液;取0.3 mL稀释后的芦丁标准溶液于10 mL离心管,依次加入3.4 mL 30%乙醇、0.15 mL 0.5 mol/L NaNO2和0.15 mL 0.3 mol/LAlCl3,摇匀后静置5 min,再加入1 mL 1 mol/L NaOH,摇匀;以30%乙醇溶液为空白对照,在506 nm下测吸光值。以芦丁浓度(mg/L)为横坐标,吸光值为纵坐标,制作标准曲线:Y=0.0008X+0.0047(R2=0.9990)。
(2)总黄酮提取量的测定。取0.3 mL备用提取液于10 mL离心管,然后按(1)中的步骤加入各试剂,于506 nm條件下测吸光值,3组平行实验。总黄酮提取量计算公式如下:
总黄酮提取量(mg/100 g)=100×C×V/M
式中,C为经芦丁标准曲线计算出来的黄酮浓度(mg/L);V为提取液的总体积(mL);M为称取的澳洲坚果青皮的质量(g)。
1.2.6 澳洲坚果青皮总黄酮体外抗氧化性能研究 (1)ABTS自由基清除能力[13]。首先将备用提取液稀释至总黄酮浓度为60、70、80、90、100、110 mg/L,分别取50 μL上述不同浓度样液于10 mL离心管,加入4 mL ABTS+反应液[7 mmol/L ABTS溶液与2.45 mmol/L K2S2O8溶液按比例为1∶1进行充分混合后避光反应12~16 h,用30%乙醇溶液稀释至732 nm条件下吸光值为(0.70± 0.02),即为ABTS+反应液],充分混匀避光反应6 min后于732 nm处测吸光值A1。以50 μL 30%乙醇为空白对照,测吸光值A0。以澳洲坚果青皮总黄酮浓度为横坐标,以ABTS自由基清除率为纵坐标,拟合线性方程,清除率为50%时的总黄酮的浓度即为澳洲坚果青皮总黄酮对ABTS自由基的半数清除率IC50,并以Trolox为阳性对照,平行测3次。ABTS自由基清除率计算公式如下:
澳洲坚果青皮总黄酮DPPH自由基清除率= (A0?A1)/A0×100 %
(2)总抗氧化还原能力[14]。取20 μL备用提取液于10 mL离心管,分别加入1 mL 蒸馏水、1.8 mL FRAP溶液(40 mmol/L盐酸、20 mmol/L六水氯化铁溶液与pH为3.6的0.3 mmol/L醋酸缓冲液按比例为1∶1∶10混匀后置于37 ℃恒温水浴待用,需现配现用)充分混匀后于37 ℃恒温水浴反应10 min,于593 nm处测吸光值,平行测3次。以Trolox为标准物质制作标准曲线,计算澳洲坚果青皮总黄酮总抗氧化还原能力。
1.3 数据处理
每组实验均进行3次重复,结果取平均值±标准差。采用SPSS 17.0软件分析数據。
2 结果与分析
2.1 提取方法对澳洲坚果青皮总黄酮提取的影响
由图1可知,在提取时间、提取温度、料液比以及乙醇浓度等条件相同情况下,与传统提取工艺相比,超声辅助可显著提高澳洲坚果青皮总黄酮提取量(P<0.05)。这可能是因为采用超声辅助提取,加速了澳洲坚果青皮细胞的破坏,增加了目标物质与提取溶剂的接触,从而增加了目标物质向提取溶剂的扩散,从而导致提取量增加。
2.2 单因素实验结果分析
2.2.1 乙醇浓度对超声辅助提取澳洲坚果青皮总黄酮的影响 由图2可知,当乙醇浓度小于40%时,随乙醇浓度增加,超声辅助提取澳洲坚果青皮总黄酮的提取量增加;当乙醇浓度大于40%时,随乙醇浓度增加,总黄酮提取量减少;当乙醇浓度为40%时,总黄酮提取量最高,且显著高于其他乙醇浓度(P<0.05)。总黄酮提取量随乙醇浓度增加呈先增加后减少的趋势,可能是因为乙醇浓度增加有利于材料与提取溶剂接触,增加提取溶剂向细胞扩散的可能性,从而总黄酮提取量增加[15];但当乙醇浓度超过一定浓度时,总黄酮与提取溶剂极性的差异增加,从而导致提取量减少[16]。Sheng等[17]的研究表明,乙醇浓度为40%时杨树花总黄酮提取量最高,本研究趋势与其一致。综合考虑,乙醇浓度宜选为40%。
2.2.2 料液比对超声辅助提取澳洲坚果青皮总黄酮的影响 由图3可知,料液比对澳洲坚果青皮总黄酮提取量的影响趋势与乙醇浓度一致:随料液比的增加,总黄酮提取量呈先增加后减少的趋势,料液比为1∶75 (g/mL)时总黄酮提取量达到最高,显著高于其他料液比(P<0.05)。在(1∶15)~ (1∶75) g/mL范围内,总黄酮提取量随料液比增加而增加可能是因为料液比增加,提取溶剂中总黄酮含量较低,物料与提取溶剂之间的传质增加,从而提取量增加[18]。当料液比超过1∶75 (g/mL)时总黄酮提取量降低,这可能是色素等杂质向提取溶剂的扩散对黄酮扩散的影响所致[19]。同时,由于料液比的增加,会增加后续纯化、分离的工作量以及试剂消耗,所以料液比宜选为1∶75 (g/mL)。
2.2.3 提取温度对超声辅助提取澳洲坚果青皮总黄酮的影响 由图4可知,在20~70 ℃范围内,澳洲坚果青皮总黄酮提取量随温度升高而增加。其中,温度在20~50 ℃范围时,总黄酮提取量呈直线上升趋势;温度高于50 ℃时,总黄酮提取量增加缓慢。这可能是由于温度升高,分子运动加剧,增加了材料与提取溶剂之间的传质推动力;同时,提取溶剂粘度降低,总黄酮溶解度增加,从而总黄酮提取量增加[20]。田刚等[21]的研究表明月季叶总黄酮提取率随提取温度的增加呈先增加后减少的趋势,这可能是由于不同材料总黄酮组成成分不同所致。同时,由图4可知,当提取温度为60 ℃时,总黄酮提取量与提取温度为70 ℃时无显著差异,显著高于提取温度为50 ℃(P< 0.05),但仅比提取温度为50 ℃时高了4.87%。此外,提取温度增加会造成材料中热敏物质的破坏、杂质溶解度增加以及溶剂的挥发[22-23]。因此,综合考虑,提取温度宜为50 ℃。
2.2.4 提取时间对超声辅助提取澳洲坚果青皮总黄酮的影响 由图5可知,澳洲坚果青皮总黄酮提取量随时间的增加而增加,并在45 min之后趋于平缓,与提取温度影响趋势一致。这可能是随时间的增加,由于物料与提取溶剂中总黄酮浓度差减少,传质动力减小,从而45 min之后总黄酮提取量增加缓慢。同时,由图5中可知,提取时间从15 min增加到45 min,总黄酮提取量增加了96.5 mg/100g,增长率仅为10.34%。由于随提取时间的增加,溶剂挥发以及能量消耗也会随之增加,所以提取时间宜选为15 min。
2.2.5 超声功率对超声辅助提取澳洲坚果青皮总黄酮的影响 超声功率是影响总黄酮等生物活性物质提取的重要因素之一。由图6可知,总黄酮提取量随超声功率增加而缓慢增加。当超声功率从300 W增加到500 W时,虽然超声功率为500 W时总黄酮提取量显著高于超声功率为300 W时(P<0.05),但也仅增加了5.34%。同时,随超声功率的增加,“空化作用”增强,加速了总黄酮向提取溶剂扩散的能力,也会造成总黄酮的破坏以及能耗增加。因此,综合考虑,超声功率选为300 W。
2.3 超声辅助提取澳洲坚果青皮总黄酮正交试验结果分析
根据单因素实验结果,以总黄酮提取量为指标,在超声功率为300 W条件下,选取乙醇浓度(A)、料液比(B)、提取温度(C)和提取时间(D)4个因素进行L9(34)正交试验,从而确定澳洲坚果青皮总黄酮的最佳超声提取工艺条件。由表2极差分析和表3方差分析可知,超声对澳洲坚果青皮总黄酮提取量的影响因素依次为:提取时间(D)、乙醇浓度(A)、提取温度(C)、料液比(B),其中A、C、D为极显著(P<0.01),B为不显著。同时,由表2和表3可知,超声辅助提取澳洲坚果青皮总黄酮最优工艺条件为A1B3C3D3,由于影响因素B不显著,所以调整最优工艺条件为A1B1C3D3,即提取时间为45 min、乙醇浓度为50%、提取温度为50 ℃、料液比为1∶60(g/mL)。在最优工艺条件下进行验证试验,总黄酮提取量为(1638.59±44.26) mg/100 g,与A1B3C3D3无显著差异(P<0.05)。
2.4 澳洲坚果青皮总黄酮抗氧化性能实验结果
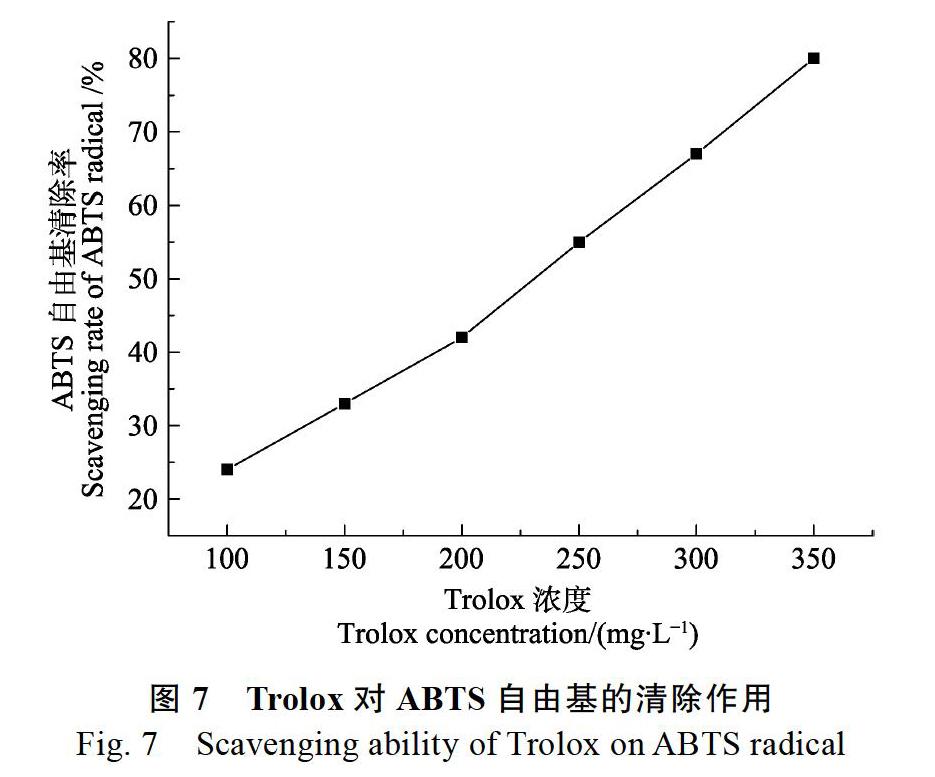
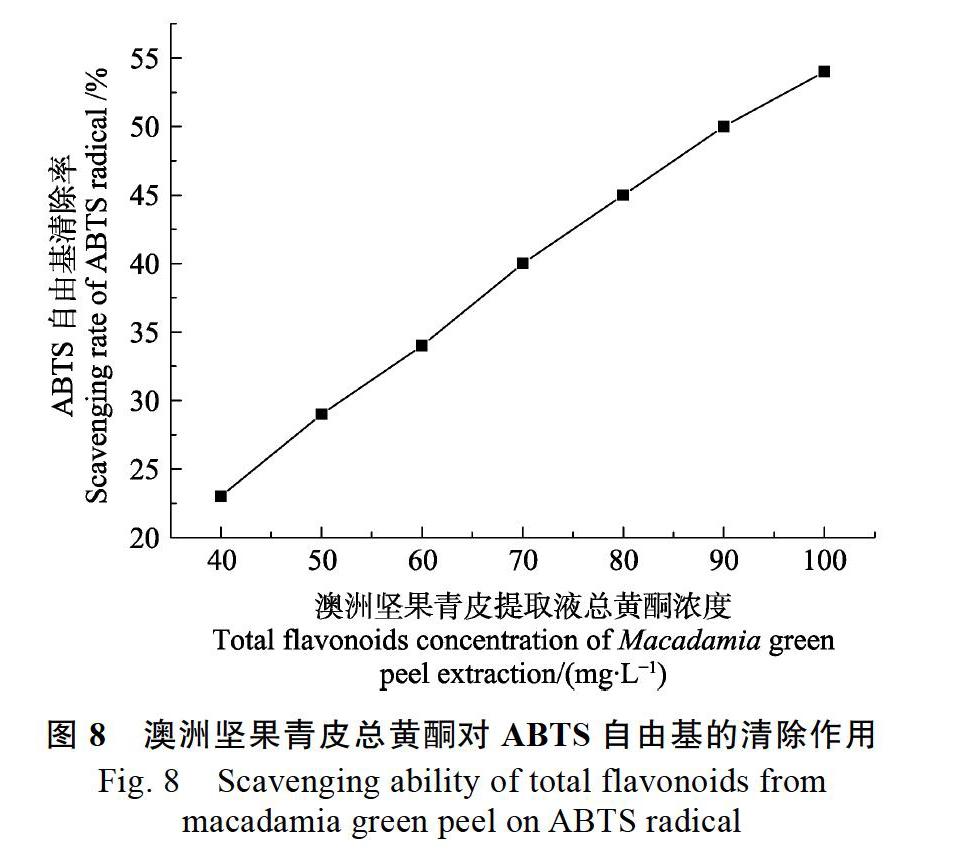
2.4.1 ABTS自由基清除能力 根据图7制定ABTS自由基清除率与Trolox浓度的线性方程:Y=0.2257X?0.6190(R2=0.9938)。由图8可知,在50~100 mg/L浓度范围内,澳洲坚果青皮总黄酮与ABTS自由基清除率呈较好的线性关系,拟合线性方程为:Y=0.5214X+2.7857(R2=0.9972)。由线性方程计算ABTS自由基清除率为50%时的Trolox浓度和澳洲坚果青皮总黄酮浓度即为半数清除率IC50。经计算,Trolox对ABTS自由基的IC50为224.26 mg/L,澳洲坚果青皮总黄酮对ABTS自由基的IC50為90.55 mg/L。由此可知,澳洲坚果青皮总黄酮对ABTS自由基清除能力强于Trolox,约为Trolox的2.48倍。
2.4.2 总抗氧化还原能力 由图9可知,以Trolox浓度为横坐标、吸光值为纵坐标,制作标准曲线:Y=0.0012X+0.0318(R2=0.9988)。当澳洲坚果青皮总黄酮浓度为105.11 mg/L时,吸光值为0.2717(3组平行试验分别为0.267、0.276、0.272),经总抗氧化还原能力标准曲线查得的Trolox浓度为199.92 mg/L,即澳洲坚果青皮总黄酮浓度为105.11 mg/L时,其总抗氧化还原能力相当于199.92 mg/L的Trolox。因此,澳洲坚果青皮总黄酮总抗氧化还原能力约为Trolox的1.90倍。
3 讨论
总黄酮是一类天然活性物质,有研究表明黄酮类化合物具有多种生物活性,如抗氧化、抗衰老、抗肿瘤等[24]。总黄酮的提取是研究其生物活性以及后续纯化、分离和结构鉴定的基础,从而广受科研工作者关注。本研究采用L9(34)正交试验对超声辅助提取澳洲坚果青皮总黄酮工艺进行优化,并采用了总抗氧化还原能力和对ABTS自由基清除能力评价其抗氧化能力。
在单因素实验基础上,进行正交试验,通过极差分析得出影响超声辅助提取澳洲坚果青皮总黄酮的因素依次为:提取时间、乙醇浓度、提取温度、料液比。优化的最佳超声辅助提取工艺条件为:提取时间45 min、乙醇浓度50%、提取温度50 ℃、料液比1∶60(g/mL)。在此条件下,总黄酮提取量为(1638.59±44.26) mg/100 g。通过总抗氧化实验发现,澳洲坚果青皮总黄酮对ABTS自由基的清除能力约为Trolox的2.48倍,总抗氧化还原能力约为Trolox的1.90倍,表明澳洲坚果青皮总黄酮具有较强的抗氧化能力。
本研究结果表明超声辅助提取澳洲坚果青皮总黄酮是一种行之有效的方法,为澳洲坚果青皮综合利用、开发多种类澳洲坚果产品以及延伸澳洲坚果加工产业链提供了借鉴作用,也为我国云南、广西和贵州等澳洲坚果主产区的澳洲坚果青皮处理提供了数据支撑。同时,为后续纯化、分离及鉴定等奠定了基础。
参考文献
Mayer D G, Stephenson R A, Jones K H, et al. Annual forecasting of the Australian macadamia crop-integrating tree census data with statistical climate-adjustment models[J]. Agricultural System, 2006, 91(3): 159-170.
杜丽清, 曾 辉, 邹明宏, 等. 澳洲坚果果仁中粗脂肪与脂肪酸含量的变异分析[J]. 经济林研究, 2009, 27(4): 92-95.
刘秋月, 叶丽君, 黄文烨, 等. 高效液相色谱法测定澳洲坚果青皮中的4种酚类物质[J]. 热带农业科学, 2016, 36(7): 106-111.
张 明, 帅希祥, 杜丽清, 等. 干燥方式对澳洲坚果青皮酚类物质提取量及抗氧化活性的影响[J]. 热带作物学报, 2018, 39(4): 785-790.
Krishnan R Y, Rajan K S. Microwave assisted extraction of flavonoids from Terminalia bellerica: Study of kinetics and thermodynamics[J]. Separation and Purification Technology, 2016, 157: 169-178.
Setyaningsih W, Saputro I E, Carrera C A, et al. Optimization of an ultrasound-assisted extraction method for the simultaneous determination of phenolics in rice grains[J]. Food Chemistry, 2019, 288: 221-227.
Puri M, Sharma D, Barrow C J. Enzyme-assisted extraction of bioactives from plants[J]. Trends in Biotechnology, 2012, 30(1): 37-44.
Lachos-Perez D, Baseggio A M, Mayanga-Torres P C, et al. Subcritical water extraction of flavanones from defatted orange peel[J]. The Journal of Supercritical Fluids, 2018, 138: 7-16.

