低磷胁迫柱花草差异表达基因分析研究
文亦芾 韩蓉蓉 单贵莲 史亮涛 罗富成 赵小雪 曾黎琼

摘 要:研究柱花草在低磷条件下生长的分子机理和反应机制。采用cDNA-SRAP分子标记技术分离柱花草茎和叶在低磷胁迫下相关基因的差异表达片段,并对其进行生物信息学分析。结果表明,8对引物组合共扩增出差异片段195条,其中抑制型表达片段56条,诱导型表达片段92条,上调表达型差异片段36条,下调表达型片段11条,大小均在50~1000 bp之间。二次扩增后将特异性条带回收后进行测序,通过BLAST比对,共比对出14条差异片段的同源序列,其中8个差异表达的核苷酸序列与已知功能基因(JCVI-FLLj-1K4未知mRNA、NBS-LRR型抗病蛋白、ATP合成酶、醛固酮还原酶、叶绿体RF2)有较高同源性,5个序列与假定基因或预测基因(UPF0051蛋白、蛋白酶启动子、SCEI结合酶、吲哚-3-丙酮酸盐单氧酶)同源性较高。本研究为筛选柱花草响应低磷胁迫的差异基因提供参考。
关键词:柱花草;磷脅迫;同源性;cDNA-SRAP;差异表达
中图分类号:S541 文献标识码:A
Analysis of Differentially Expressed Genes in Low Phosphorus Stress of Stylosanthes Guianensis
WEN Yifu1, HAN Rongrong2, SHAN Guilian1, SHI Liangtao3, LUO Fucheng1, ZHAO Xiaoxue1,
ZENG Liqiong4
1. College of Animal Science and Technology, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. College of Animal Science and Technology, Southwest University / College Herbivore Engineering Center of Chongqing, Chongqing 400715, China; 3. Research Institute of Tropical Eco-agriculture Sciences, Yunnan Academy of Agricultural Sciences, Yuanmou, Yunnan 651300, China; 4. Biotechnology and Germplasm Resources Institute, Yunnan Academy of Agricultural Sciences, Kunming, Yunnan 650223, China
Abstract: The cDNA-SRAP molecular marker technique was used to isolate the differentially expressed genes of the stems and leaves of Stylosanthes under low phosphorus stress, and bioinformatics analysis was carried out to study the molecular mechanism and reaction mechanism of Stylosanthes growing under low phosphorus condition. A total of 195 differential fragments were amplified from 8 pairs of primer combinations. Among them, there were 56 inhibitory expression fragments, 92 inducible expression fragments, 36 upregulated expression fragments and 11 down-regulated expression fragments, and the sizes ranged from 50 to 1000 bp. After the second amplification, the specific bands were recovered and sequenced. Through blast alignment, the homologous sequences of 14 different fragments were compared, and the 8 differentially expressed nucleotide sequences had high homology with known functional genes (JCVI-FLLj-1K4 unknown mRNA, NBS-LRR type disease resistance protein, ATP synthase, aldosterone reductase, chloroplast RF2), five sequences were highly homologous to the putative or predicted genes (UPF0051 protein, protease promoter, SCEI binding enzyme, indole-3-pyruvate monooxygenase). This study has laid a foundation for screening differential genes in response to low phosphorus stress.
Keywords: Stylosanthes; phosphorus deficiency; homolog; cDNA-SRAP; differential expression
DOI: 10.3969/j.issn.1000-2561.2020.05.017
磷是植物生长发育的必需元素,参与植物体内能量代谢、酶促反应、糖分代谢、光合作用等生理生化反应[1]。土壤中的磷由于强烈固定作用而难以移动,植物吸收的磷主要来自其根系所接触到的土壤和离根表较近的土体,土壤中磷肥利用效率低,因此磷素供应水平成为牧草生产中的主要限制因子之一[2]。在长期缺磷胁迫下,植物进化形成了一系列适应缺磷土壤的形态、生理生化及分子机制[3]。
柱花草(Stylosanthes guianensis)多年生豆科植物,是世界上热带、亚热带地区重要的放牧和刈割兼用型豆科牧草[4],可以在低磷的酸性红壤区生长,并具有较高产草量。柱花草对磷利用效率较高,属于磷高效基因型植物[5],在低磷条件下,磷高效基因型柱花草比磷低效基因型柱花草品种地上生物量高2~4倍,表现出既耐低磷又具有高产潜力的优良基因型性状[6]。
SRAP(sequence-related amplified polymorphism)即相关序列扩增多态性,是美国加州大学蔬菜作物系Li等[7]于2001年在研究芸薹属(Brassica)植物中开发的一种检测新型分子标记技术,操作简便、重复性好,近年来被广泛应用于植物遗传结构和遗传多样性分析[8]、分子标记辅助选择育种等方面。近年来,分子生物技术发展迅速,在柱花草的相关研究中也得到了广泛的应用。目前,有ISSR(inter-simple sequence repeats)[9]、RAPD(random amplified polymorphic DNA)[10-11]、AFLP(amplified fragment length polymorphisms)[12]、微卫星标记[13]等方面的研究报道。SRAP可应用于cDNA研究[14],现已应用于耐低磷差异基因的分离[15]、不同生长阶段的差异基因表达[16]、接种真菌后植物的差异表达等方面[17]。但cDNA-SRAP技术在柱花草差异表达基因分析方面的应用鲜有报道。本研究利用前期试验中优化后的柱花草cDNA-SRAP反应体系[18], 以‘热研5号为材料,利用SRAP分子标记技术,研究其在低磷胁迫下的基因差异表达,旨在为下一步开展柱花草耐低磷胁迫分子机制方面的研究提供理论依据。
1 材料与方法
1.1 材料
‘热研5号柱花草由云南省农业科学院热区生态农业研究所提供,本研究采用水培法,人工气候箱育苗(光照14 h,通气10 h,温度为25~ 28 ℃),用正常磷浓度(2 mmol/L)的1/2 Hoagland营养液培养柱花草至3~5叶,改用低磷浓度(20 μmol/L)的1/2 Hoagland营养液继续培养。分别在低磷胁迫0、1、3、7 d时取茎、葉,液氮速冻后于?80 ℃保存。
1.2 方法
1.2.1 柱花草RNA的提取和cDNA第一链的合成 采用Trizol法提取柱花草茎的RNA,用天根RNAprep Pure多糖多酚植物总RNA提取试剂盒提取柱花草叶总RNA,DNase I消化总DNA,利用超微紫外分光光度计测定RNA浓度,用1%浓度的琼脂糖电泳分析其纯度;用FastQuant cDNA第一链合成试剂盒合成cDNA第一链。严格按照说明书进行操作。
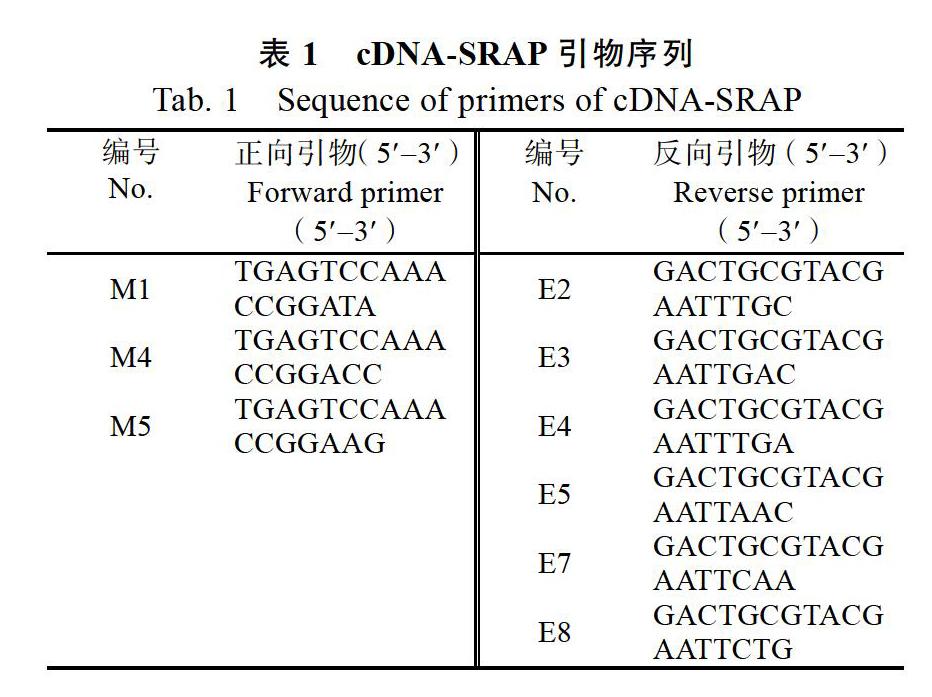
1.2.2 柱花草cDNA-SRAP扩增 本研究用的引物(表1)参照张伟丽等[8]研究中的引物。优化后的柱花草cDNA-SRAP反应体系为[18]:总反应体系为20 μL,模板用量200 ng,Mg2+浓度为2.5 mmol/L,引物浓度为0.4 μmol/L,dNTP浓度为0.25 mmol/L,Taq酶用量为1 U。
cDNA-SRAP PCR反应扩增体系为:94 ℃ 4 min;94 ℃ 45 s,33 ℃ 45 s,72 ℃ 45 s,5个循环;94 ℃ 45 s,50 ℃ 45 s,72 ℃ 45 s,30个循环;最后72 ℃延伸5 min。反应结束后4 ℃保存,扩增产物在6%聚丙烯酰胺凝胶电泳检测。
1.2.3 差异片段的回收和二次PCR、克隆、测序 先检测后筛选出具有差异表达的片段,用75%乙醇反复擦洗胶板上含有目的基因条带的凝胶(去除胶表面的杂质),使其吸水变软,然后将差异片段从聚丙烯酰胺凝胶上切胶回收,加30 μL ddH2O,室温溶解24 h(让胶中的核酸溶解到ddH2O中)后取10 μL作为模板再次PCR,所用引物和程序与最初反应相同。用1%琼脂糖凝胶检测产物是否与原片断大小相同,回收大小相同的目的条带。
将回收的差异片段连接到pUCm-T载体上,转化大肠杆菌DH5α感受态细胞,进行蓝白斑筛选。挑取阳性克隆PCR检测后,送交上海生工进行测序。
1.2.4 测序结果同源对比分析 利用NCBI数据库的BLAST进行基因相似性比对,分析预测其功能。
1.2.5 差异片段的半定量RT-PCR验证 为了确保cDNA-SRAP分析结果的可靠性,以柱花草β-actin基因为内参,利用半定量RT-PCR(semi- quantitative reverse transcription and polymerase chain reaction, SqRT-PCR)对部分差异表达基因进行验证。以低磷胁迫0、1、3、7 d时的柱花草茎、叶为材料,重新提取总RNA、合成第一链后作为模板。利用Primer 5.0设计差异片段的特异引物(表2)。
2 结果与分析
2.1 柱花草RNA的质量和cDNA质量
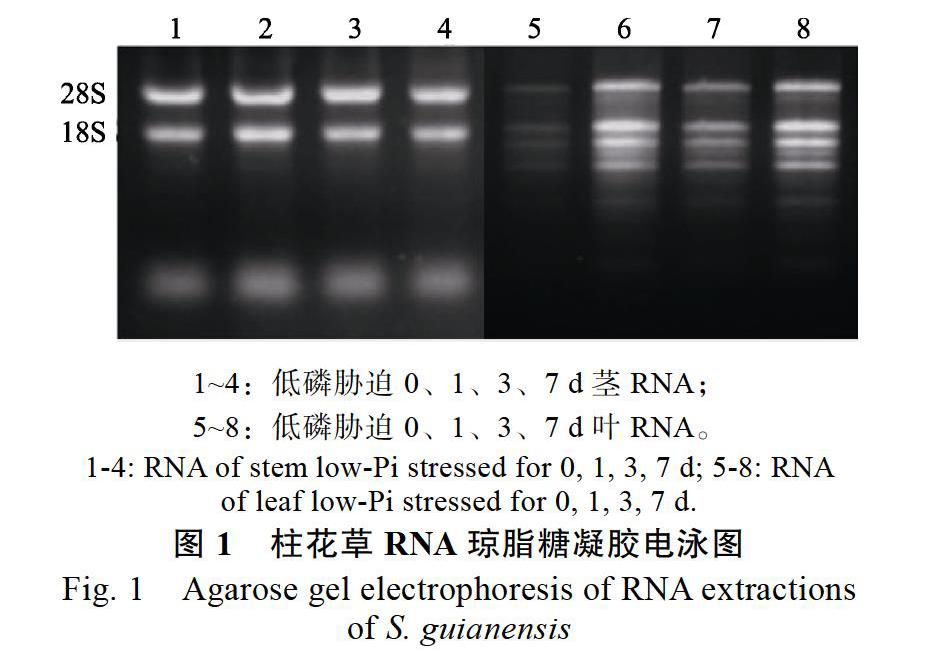
利用1%的琼脂糖凝胶电泳检测RNA质量,由柱花草RNA琼脂糖凝胶电泳结果(图1)可知,Trizol法提取柱花草茎的RNA带型清晰完整。因为柱花草叶片含有多酚多糖等次生代谢物,Trizol试剂提取得到的叶片RNA有杂质污染,不能满足实验要求,所以用天根RNAprep Pure多糖多酚植物总RNA提取试剂盒提取柱花草叶片的RNA,提出的RNA电泳结果显示有多条带,但是总体质量较好,能满足后续试验要求。
2.2 柱花草cDNA-SRAP扩增结果的分析
以合成的cDNA为模板进行SRAP-PCR扩增,由聚丙烯酰胺凝胶电泳检测结果可知(图2),8对引物组合均能扩出清晰条带,共扩出差异片段195条,大小均在50~1000 bp之间。
根据差异片段的有无和强弱将其分为以下几种(表3):抑制型表达、诱导表达、上调表达和下调表达。其中,诱导表达分为瞬时诱导和特殊诱导,瞬时诱导是指基因在低磷胁迫的某一特定时期开始表达,如低磷胁迫3、5、7 d;特殊诱导则是基因在某几个时期进行表达,如某些基因在胁迫处理3 d开始表达,在5 d时表达受到抑制,在7 d时基因的表达又被开启[15]。本研究诱导表达根据表达时间分为1 d诱导、3 d诱导、7 d诱导和特殊型诱导表达。抑制型表达片段有56条,诱导表达片段有92条,上调表达型差异片段36条,下调表达型片段11条。1 d诱导型33条,3 d诱导型23条,7 d诱导型20条,特殊诱导型16条。另外,有些片段在茎跟叶中均有表达,但是在茎叶中的表达量不同,这样的组织差异型片段有7条,其中叶比茎表达量大的有5条。
柱花草茎与叶的差异表达也有差异。茎中抑制型表达基因片段有38条,占茎总差异表达基因总数的35.5%;诱导表达基因片段有45条,占总数的42.1%;上调表达型和下调表达型基因片段分别有17和7条,占总数的15.9%和6.5%。叶中抑制型表达基因片段有18条,占叶总差异表达基因总数的20.5%;诱导表达基因片段有47条,占总数的53.4%;上调表达型和下调表达型基因片段分别有19和4条,占总数的21.6%和4.5%。
2.3 差异片段的二次扩增
选取条带亮、表达量高的69条差异片段进行回收再扩增,部分PCR产物电泳结果(图3),二次扩增产物只有一条特异条带,且片段大小与目的片段一致。
2.4 差异片段的克隆、测序及分析
将回收的二次扩增差异片段连接到pUCm-T载体上,转化入DH5α感受态细胞中。经过蓝白斑筛选,挑取白斑摇菌培养后,菌液检测阳性克隆,最终获得53个有效序列,重复率为76.8%。在NCBI上进行BLAST比对,共比对出14条差异片段的同源序列,其中9个差异表达的核苷酸序列与已知功能基因有较高同源性,5个序列与假定基因或预测基因同源性较高,剩余序列未找到同源序列,可能是一些新的柱花草與耐低磷相关基因,具体功能待进一步研究。8个同源基因的功能分别是JCVI-FLLj-1K4未知mRNA、NBS-LRR型抗病蛋白、醛固酮还原酶、叶绿体RF2、ATP合成酶,4个预测功能分别是UPF0051蛋白、蛋白酶启动子、SCEI结合酶、吲哚-3-丙酮酸盐单氧酶(表4)。
2.5 差异片段的半定量RT-PCR验证
为了确保cDNA-SRAP分析结果的可靠性,以柱花草β-actin基因为内参,半定量RT-PCR方法是探讨基因转录水平的有效手段,可用来检测基因的表达及其变化情况,并可进行半定量分析,具有费用低、简捷、灵敏、特异性等优点,在特异性引物的引导下,它能够从低丰度的mRNA逆转录产物中扩增出近μg级的cDNA产物[19],因此,采用该方法来研究差异基因在低磷胁迫下的表达模式。JCVI-FLLj-1K4未知mRNA基因和NBS- LRR型抗病蛋白在不同胁迫时间下呈差异表达,半定量RT-PCR的结果与cDNA-SRAP反应结果吻合(图4)。其中JCVI-FLLj-1K4未知mRNA 基因呈特殊诱导表达,NBS-LRR型抗病蛋白是在短时间内抑制表达,长时间的低磷胁迫又重新表达。
3 讨论
磷能促进柱花草的生长、植株干物质积累和植株对磷和氮量的吸收,适量的磷对柱花草的生长具有一定的促进作用[20]。磷元素也是植物生长发育中必不可少的营养元素,在植物的产量和种质资源保存方面有重要作用。随着分子标记技术的发展,有关cDNA-SRAP技术应用的报道有很多,如在烟草[21]、魔芋[22]、茶树[23]、甘蓝[24]等植物基因表达分析中的应用,说明该技术的有效性,但有关柱花草耐低磷基因的差异表达相关应用未见报道。本研究采用cDNA-SRAP分子标记技术,与张伟丽等[8]用SRAP分析柱花草遗传多样性所用模板DNA不同,cDNA-SRAP最佳反应体系与其有所区别。本研究用优化后cDNA- SRAP反应体系对差异表达基因进行分析,可得到较好的效果。
通过cDNA-SRAP分子标记技术分离柱花草响应低磷胁迫相关基因的差异表达片段,得到较多的差异表达片段。差异片段类型参照苏亮[15]划分标准进行分类,分为抑制型、诱导型(1 d诱导、3 d诱导、7 d诱导、特殊诱导)、上调表达型和下调表达型。抑制型表达基因占总差异片段的28.7%,诱导型表达基因占总差异片段的47.2%,上调表达型基因占总数的18.5%,下调表达型基因较少,仅占5.6%。通过对差异片段的分析筛选出9个柱花草耐低磷相关基因,分别是JCVI- FLLj-1K4未知mRNA、NBS-LRR型抗病蛋白、ATP合成酶、醛固酮还原酶、叶绿体RF2、UPF0051蛋白、蛋白酶启动子、SCEI结合酶、吲哚-3-丙酮酸盐单氧酶。
ATP合成酶是细胞能量转变过程中的关键酶[25],叶绿体中ATP合成酶利用光能驱动跨膜质子梯度合成ATP,植物所需的磷素缺少,会引起大量与能量合成有关的生物分子的减少,ATPase合成量减少,降低光合作用。王彦玲[26]指出在缺磷状态下ATP合成酶β亚基在‘郑58品种中发生表达下调,ATP合成酶σ亚基在‘昌7-2品种中发生表达下调现象,但在‘郑单958品种中并没有出现ATP合成酶的明显差异性表达,这可能暗示了‘郑单958适应磷胁迫的环境,同时说明ATP合成酶在磷素不同的情况下会出现差异表达。本研究中ATP合成酶的差异片段与其同源性高达93%。而且,此差异片段在柱花草茎、叶中均有表达,只是在叶中表达量大于茎,属于组织特异性差异表达片段。
薛莹莹等[27]认为NBS-LRR类为植物抗病基因,可能参与抗病信号的传导,NBS结构域是NBS-LRR基因编码蛋白中最保守的部分,能够结合ATP或GTP,含有8个保守基序,其中P-loop用于结合ATP或GTP的磷酸,Kinase-2a参与磷酸转移反应等。其他有关上述基因的研究未见文章发表,本课题后期将进一步丰富柱花草耐低磷方面的探索,为研究柱花草耐低磷胁迫响应的具体基因片段奠定基础。
参考文献
文亦芾, 单贵莲, 姜 飞, 等. 柱花草WRKY转录因子在低磷胁迫下的克隆与分析[J]. 西北植物学报, 2019, 39(2): 226-233.
余 爱, 张海达, 吴露露, 等. 不同供磷水平对柱花草和黑籽雀稗根际生理活性的影响[J]. 热带农业科学, 2011, 31(6): 7-10.
杜育梅, 白昌军, 田 江, 等. 柱花草适应酸性缺磷土壤的基因型差异及可能的生理机制[J]. 华南农业大学学报, 2008(4): 6-11.
蔡小艳, 赖志强, 易显凤, 等. 我国南方柱花草的利用现状及发展对策[J].上海畜牧兽医通讯, 2010(3): 51- 53.
余 爱, 杨 帆, 张 宇, 等. 不同施磷浓度对柱花草和黑籽雀稗根系分布的影响[J]. 草业学报, 2011, 20(3): 219-224.
杨茂, 严小龙. 酸性红壤区柱花草磷效率基因型差异[J].草地学报, 1999(2):113-120.
Li G, Quiros C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics, 2001, 103(2-3): 455-461.
张伟丽, 刘凤民, 刘 艾. 柱花草SRAP-PCR体系优化及其遗传多样性分析[J]. 草业学报, 2011, 20(4): 159- 168.
唐燕琼, 胡新文, 郭建春, 等. 柱花草种质遗传多样性的ISSR分析[J]. 草业学报, 2009, 18(1): 57-64.
蒋昌顺, 葛琴雅, 邹冬梅, 等. 柱花草RAPD反应体系的建立及其8个品种遗传多样性分析[J]. 广西植物, 2004(3): 243-247, 292.
傅小霞, 漆智平, 何华玄. 柱花草单粒种子DNA提取和RAPD扩增[J]. 热带农业科学, 2004(3): 28-30.
蒋昌顺, 贾虎森, 马欣荣, 等. 感病与抗病圭亚那柱花草遗传多样性的AFLP分析[J]. 植物学报, 2004, 46(4): 480-488.
蒋昌顺, 马欣荣, 邹冬梅, 等. 应用微卫星标记分析柱花草的遗传多样性[J]. 高技术通讯, 2004, 14(4): 25- 30.
桂 琴, 王嘉璐, 伍晓明, 等. SRAP-cDNA方法在植物基因差异表达分析中的应用[J]. 中国油料作物学报, 2007, 29(4): 497-502.
苏 亮. 利用cDNA-SRAP技术分析玉米耐低磷基因的差异表达[D]. 太原: 山西大学, 2010.
赵凯歌, 王文颖, 陈龙清. 用cDNA-SRAP技术分离蜡梅花发育不同时期差异表达基因片段[J]. 华中农业大学学报, 2012, 31(6): 693-698.
吴建明, 李杨瑞, 王爱勤, 等. 利用cDNA-SRAP分析赤霉素诱导甘蔗节间伸长的差异表达[J]. 中国农业科学, 2010, 43(19): 3937-3944.
韩蓉蓉, 史亮涛, 刘国道, 等. 柱花草cDNA-SRAP反应体系的建立[J]. 草业与畜牧, 2015(2): 8-11.
邓晓艳. 利用cDNA-AFLP技术分析棉花耐旱相关基因的表达[D]. 石河子: 石河子大学, 2010.
陈晓斌, 梁于朝, 孟 磊, 等. 3种柱花草磷营养特性研究初探[J]. 安徽农业科学, 2008(23): 9937-9938, 9943.
邹序生, 张启发, 谢 瑞, 等. 烟草杂交组合Florda301× GDH94的杂种优势表现和cDNA-SRAP分析[J]. 分子植物育种, 2018, 16(12): 3989-3995.
曾黎琼, 韩蓉蓉, 段玉云, 等. 不同钾水平下花魔芋差异表达基因分析[J]. 中国蔬菜, 2016(4): 38-41.
王 晓, 沈程文, 周跃斌, 等. 茶树cDNA-SRAP体系正交優化研究[J]. 茶叶通讯, 2015, 42(1): 22-26.
张云霞, 宋立晓, 曾爱松, 等. 利用cDNA-SRAP分离结球甘蓝抗黑腐病相关基因的研究[J]. 华北农学报, 2014, 29(5): 29-32.
徐卫红. ATP合成酶及其功能机制综述[J]. 上饶师范学院学报(自然科学版), 2004(3): 36-40, 78.
王彦玲. 我国玉米核心种质磷胁迫蛋白质表达差异和基因组SSR分析[D]. 郑州: 郑州大学, 2010.
薛莹莹, 孙守如, 孙德玺, 等. RGA法克隆NBS-LRR类抗病基因同源序列及其在葫芦科作物上应用的研究进展[J]. 中国瓜菜, 2014, 27(3): 1-4, 9.

