渗透胁迫下水杨酸诱导的小桐子甜菜碱积累涉及Ca2+/CaM信号
杨双龙 杨婷 龚明

摘 要:本研究以小桐子幼苗为材料,在水培条件下,研究了外源水杨酸(SA)对PEG 6000胁迫下小桐子幼苗甘氨酸甜菜碱含量、代谢关键酶BADH活性和相关基因表达,以及Ca2+和CaM抑制剂对SA诱导甜菜碱积累的影响。结果表明:外源1.5 mmol/L SA处理可显著提高渗透胁迫下小桐子幼苗的甜菜碱含量、增加甜菜碱合成关键酶BADH的活性,以及上调JcCMO和JcBADH的表达水平。与单独用PEG处理的幼苗相比,SA处理也提高了渗透胁迫下小桐子幼苗的钙调素(CaM)活性。此外,CaCl2处理能增强SA诱导的甜菜碱积累效应,提高BADH的活性和上調JcBADH的表达水平,而Ca2+通道阻断剂 LaCl3、CaM抑制剂CPZ和TFP处理得到相反的结果。这些结果表明,外源SA处理可提高渗透胁迫下小桐子幼苗甜菜碱的生物合成能力,且SA诱导的甜菜碱积累过程可能受到Ca2+/CaM信号的调控。
关键词:水杨酸;渗透胁迫;甘氨酸甜菜碱;小桐子;Ca2+/CaM信号
中图分类号:S718.3 文献标识码:A
Ca2+/CaM Signaling Involved in Salicylic Acid-Induced Glycine Betaine Accumulation in Jatropha curcas L. under Osmotic Stress
YANG Shuanglong, YANG Ting, GONG Ming*
College of Life Sciences / Engineering Research Center of Sustainable Development and Utilization of Biomass Energy, Ministry of Education / Key Laboratory of Biomass Energy and Environmental Biotechnology, Yunnan Normal University, Kunming, Yunnan 650500, China
Abstract: Hydroponic experiments were carried out to study the effect of exogenous salicylic acid (SA) on the content of glycine betaine (GB), the activity of the key enzyme betaine aldehyde dehydrogenase (BADH) of GB biosynthesis, and the expression of GB metabolism-related genes in the leaves of Jatropha curcas seedlings under PEG 6000 stress. Meanwhile, the effects of Ca2+ and calmodulin (CaM) antagonists on SA-induced GB accumulation were investigated too. SA treatment significantly enhanced the content of GB, increased the activity of BADH, and improved the expression level of JcCMO and JcBADH in the leaves of J. curcas seedlings under osmotic stress. Interestingly, compared to the seedlings exposed to PEG treatment alone, SA treatment significantly increased the activity of CaM under osmotic stress. Calcium chloride (CaCl2) treatment could promote SA-induced GB accumulation. It also induced an increase of BADH activity, and up-regulated JcBADH expression. The results indicate that exogenous SA treatment can enhance the biosynthesis of GB, and Ca2+/CaM signaling might be involved in the regulation of SA-induced GB accumulation.
Keywords: salicylic acid; osmotic stress; glycine betaine; Jatropha curcas L.; Ca2+/CaM signaling
DOI: 10.3969/j.issn.1000-2561.2020.05.013
小桐子(Jatropha curcas L.)又名青铜木、假花生树等,属大戟科麻疯树属,是非常重要的多用途树种 [1-3];小桐子耐土壤贫瘠、生长繁殖速度快、生物产量大,并且能绿化荒山、保水固土、增加土壤有机质等[2, 4]。此外,小桐子种子含油量在40%~60%,油质近似柴油,是一种具有巨大开发潜力的能源植物,因此受到广泛的关注[4-6]。小桐子起源于热带,一般都认为小桐子应具有较强的耐脱水能力[5-6],但是近年来的研究表明,冷敏感植物小桐子对低温和干旱诱导的渗透胁迫非常敏感,半干旱和干旱地区小桐子的产量远远低于降雨量较丰富的地区[5]。
干旱、低温和高盐等诱发的渗透胁迫是世界农业生产的主要自然灾害,也是影响植物生长的主要因素之一。渗透胁迫可损伤植物细胞膜、诱导过量的活性氧产生、抑制植物生长等[7-8];植物遭受渗透胁迫时会造成细胞失水,同时产生相应的渗透调节物质来抵抗胁迫环境[8]。甘氨酸甜菜碱(glycine betaine, GB)是一种季铵类化合物,也是最常见的渗透调节剂之一 [9-10]。近年来的研究显示,甜菜碱还具有保护细胞内代谢酶和蛋白质,以及稳定生物膜等作用[9]。植物体内甜菜碱的生物合成含两步重要的氧化反应。首先,由胆碱单加氧酶(choline monooxygenase, CMO)将胆碱催化为甜菜碱醛,然后由甜菜碱醛脱氢酶(be taine aldehyde dehydrogenase, BADH)将甜菜碱醛转化为甜菜碱。其中,BADH被认为是高等植物中甜菜碱生物合成的关键限速酶[10-11]。目前,已从拟南芥、水稻、小麦、玉米等多种草本植物中分离得到BADH基因,并广泛应用于植物的抗逆基因工程[9-11]。大量研究表明,植物在渗透胁迫下会积累甜菜碱,且大量积累的甜菜碱显著提高了植物的抗逆性[10-12]。但是,渗透胁迫诱发甜菜碱积累的机制尚不完全清楚。
干旱、低温和盐等逆境胁迫诱发植物甜菜碱积累的过程涉及复杂的信号转导过程,研究表明:该过程受脱落酸(abscisic acid, ABA)、Ca2+、NO和水杨酸(salicylic acid, SA)等信号分子的调控[13-16]。以钙离子(Ca2+)及其受体钙调素(calmodulin, CaM)为核心的钙信使系统在植物应对逆境胁迫的信号转导过程中发挥着中心作用[17-19]。已有少量研究证明,Ca2+/CaM信号参与了干旱和盐胁迫下植物体内甜菜碱的积累过程[14, 20]。然而,Ca2+/CaM信号调节植物甜菜碱代谢的机制还不清楚。SA作为一种重要的内源信号分子,在植物抵抗低温、干旱、盐胁迫等逆境胁迫造成的伤害时,起着重要作用[21-23]。Farhangi-Abriz等[16]研究结果表明,盐胁迫下,外源施加SA处理可以提高大豆植株的甜菜碱含量及耐盐性;Aghdam等[22]报道,外源SA预处理增加了红掌中甜菜碱的含量,并提高了红掌植株的耐冷性;Shaki等[23]的研究表明,SA提高了NaCl胁迫下红花体内甜菜碱、可溶性糖及叶绿素的含量。
然而,到目前为止,渗透胁迫下SA如何调控甜菜碱代谢,其中涉及的信号转导机制还不清楚。本研究采用外源施加SA处理渗透胁迫下的小桐子幼苗,研究了渗透胁迫下SA对小桐子幼苗甜菜碱含量、BADH活性、JcBADH和JcCMO表达量及Ca2+和CaM抑制剂对SA诱导甜菜碱积累的影响,试图初步探明渗透胁迫条件下SA调控小桐子甜菜碱代谢的机制及可能涉及的部分信號转导事件,为深入研究渗透胁迫诱发植物甜菜碱积累的机制提供借鉴。
1 材料与方法
1.1 材料
小桐子种子采购于云南省元谋县。首先挑选籽粒大小一致的种子,清洗干净,然后用1.5%(W/V)的硫酸铜溶液消毒30 min,蒸馏水清洗干净,放入25 ℃的培养箱中浸种16 h之后,播种于铺有6层湿滤纸的白磁盘中。种子于25 ℃下加盖暗萌发7 d。然后,将长势较一致的幼苗置于75%相对湿度的人工气候箱[培养条件为:25 ℃/20 ℃(昼/夜)、16 h光照强度300 μmol/(m2·s)]中砂培生长21 d,期间浇灌1/2 Hoagland营养液。
1.2 方法
小桐子幼苗长出第3片真叶时(培养28 d),取长势一致的小桐子幼苗,分别置于浓度为(0、0.5、1.0、1.5、2.0、2.5 mmol/L)SA和20% PEG 6000(模拟渗透胁迫)的1/2 Hoagland营养液中(对照为不同浓度SA+1/2 Hoagland营养液),在人工气候箱[25 ℃/20 ℃(昼/夜)、16 h光照强度300 μmol/(m2·s)、相对湿度为75%]中进行培养,每个处理180株,处理4 d后,取小桐子幼苗叶片,进行相关指标的测定。SA和PEG 6000选用的处理浓度设置均基于实验室的前期研究工作。
在上述实验基础上,取长势一致的小桐子幼苗,以1/2 Hoagland营养液培养的幼苗为对照,分别进行不同处理,详见表1(各处理浓度的选择基于实验室的前期研究工作,CPZ和TFP分别为CaM抑制剂氯丙嗪和三氟拉嗪),所有处理均在人工气候箱中进行[培养条件为:25 ℃/ 20 ℃(昼/夜)、16 h光照强度300 μmol/(m2·s)、相对湿度为75%],每个处理有6个重复,以及3次生物学重复。材料共处理2~4 d,在处理的0、1、2、3、4 d取小桐子幼苗叶片,进行相关指标的测定。
1.3 测定方法
1.3.1 甜菜碱含量的测定 取小桐子幼苗叶片0.1 g,加蒸馏水2 mL,少许石英砂充分研磨之后,在摇床上提取24 h。然后,提取液于10 000g、20 ℃下离心15 min,取上清液用盐酸将pH调至1.0,即为样品液。吸取500 μL样品液,加入浓度为3%的饱和雷氏盐溶液500 μL,放置于4 ℃下保存5 h,接着于10 000g下离心15 min,弃上清液,将所得沉淀用乙醚冲洗3次。最后,用2 mL 70%的丙酮充分溶解沉淀,并于525 nm波长下测定吸光度值,依据标准曲线计算样品甜菜碱的含量。
1.3.2 CaM和BADH活性的测定 CaM活性的测定按照Yang等[18]描述的方法进行,以pH 7.5、30 ℃和0.01 mmol/L Ca2+存在条件下,激活0.01个单位磷酸二酯酶(PDE)到50%最大活性所需的CaM量为一个活性单位(U);参照Yang等[2]的方法测定BADH酶的活性,按每分钟NADH的生成量计算酶活性。
1.3.3 RNA提取和qRT-PCR 采用TaKaRa公司的RNAiso? for Polysaccharide-rich Plant Tissue试剂盒提取RNA;采用ABI 7500 Fast Real-Time PCR实时荧光定量PCR仪对甜菜碱代谢关键酶基因JcBADH和JcCMO的表达进行检测,内参基因选用小桐子18s rRNA基因,引物序列详见表2。
按照One Step SYBR? PrimeScript? RT-PCR Kit II(TaKaRa)试剂盒说明书的操作步骤进行qRT-PCR反应。目标基因相对定量差异表达分析采用2–ΔΔCT法进行计算[24]。
1.4 数据处理
采用SPSS 19. 0软件对数据进行方差分析(实验数据多重比较采用Duncan法);采用Sigmaplot 13.0作图软件,图中的数据均为平均值±标准误。以不同的小写字母来表示不同处理间差异达到显著水平(P<0.05)。
2 结果与分析
2.1 外源SA处理对渗透胁迫下小桐子幼苗叶片甜菜碱含量的影响
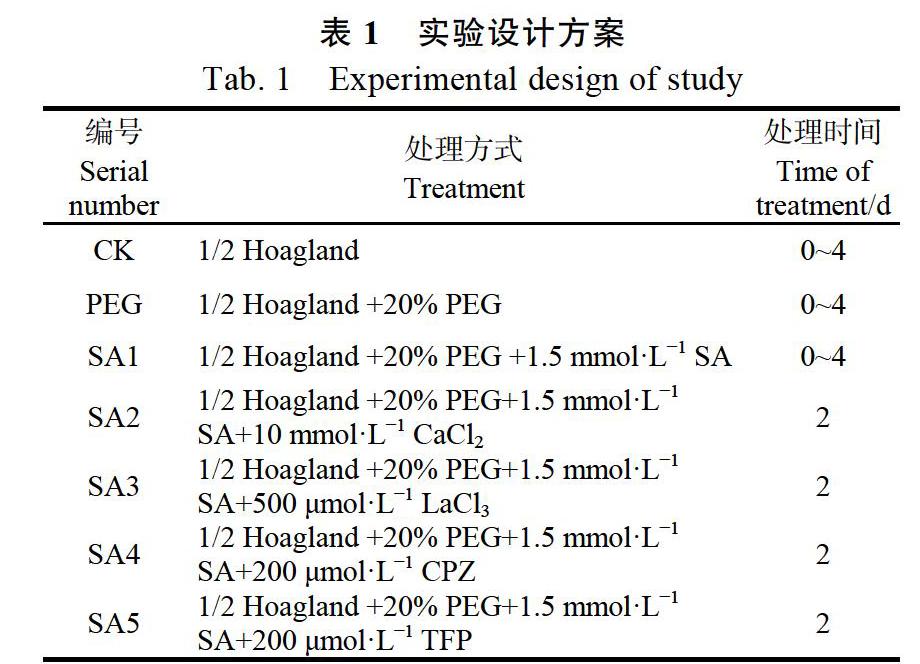
为了确定SA的适宜处理浓度,分别用0、0.5、1.0、1.5、2.0、2.5 mmol/L SA溶液处理正常生长和20% PEG 6000胁迫下的小桐子幼苗,处理4 d后,取小桐子幼苗叶片测定其甜菜碱含量。从图1可以看出,随着SA处理浓度的升高,20% PEG 6000胁迫下小桐子幼苗叶片的甜菜碱含量逐渐升高,在SA浓度为1.5 mmol/L时,甜菜碱含量最高,与单独用PEG 6000处理的小桐子幼苗相比,甜菜碱含量提高达33.1%。此后,随着SA处理浓度的增加,幼苗甜菜碱含量呈逐渐降低的趋势,但依然显著高于仅用PEG 6000处理的小桐子幼苗。然而,不同浓度的外源SA对正常生长条件下的小桐子幼苗甜菜碱含量均无显著影响(图1对照)。基于以上结果,本研究最终选用1.5 mmol/L的SA溶液来处理渗透胁迫下的小桐子幼苗,因为该浓度诱导甜菜碱积累的效果最显著。
图2的结果显示,对照组小桐子幼苗叶片甜菜碱的含量比较稳定,在0~4 d中变化不大(CK)。然而,PEG处理1~4 d则显著提高了小桐子幼苗叶片甜菜碱的含量。与对照(CK)相比,PEG处理4 d时小桐子幼苗叶片的甜菜碱含量上升了2.57倍;而SA1处理可进一步促进渗透胁迫下小桐子幼苗叶片甜菜碱的积累。说明SA1处理可显著提高渗透胁迫下小桐子幼苗甜菜碱的积累。
2.2 SA处理对渗透胁迫下小桐子幼苗叶片甜菜碱代谢关键酶活性及其基因表达的影响
图3为1.5 mmol/L SA对渗透胁迫下小桐子幼苗叶片BADH活性的影响。由图3可知,PEG处理可大幅上调小桐子幼苗叶片的BADH活性,其中0~2 d上升速度较快,2 d后上升幅度减缓,4 d内幼苗的BADH活性上升了1.40倍。SA1處理可进一步上调渗透胁迫下BADH的活性。
为了深入研究SA对渗透胁迫下小桐子幼苗甜菜碱生物合成的影响,实验中用qRT-PCR法检测了甜菜碱合成关键酶基因JcBADH和JcCMO的表达变化。检测结果如图4所示,PEG处理可大幅上调JcBADH(图4A)和JcCMO(图4B)的表达水平,在PEG 6000胁迫4 d时,小桐子幼苗JcBADH和JcCMO的表达水平与正常培养的幼苗(CK)相比分别上调了6.84倍和3.62倍。SA1处理则进一步上调了20% PEG 6000胁迫下JcBADH和JcCMO的表达水平,结果说明渗透胁迫下小桐子幼苗JcBADH和JcCMO的表达水平受到SA的调控。
2.3 Ca2+和CaM抑制剂对渗透胁迫下SA诱发小桐子幼苗甜菜碱积累的影响
CaM是Ca2+的受体,也是钙信使系统的重要组成成分[17-18]。图5为SA对20% PEG 6000胁迫下小桐子幼苗叶片CaM活性的影响。由图5可知,随着处理时间的延长,PEG 6000处理(PEG)对小桐子幼苗CaM活性的影响呈先升高后逐渐降低的趋势。当PEG 6000胁迫2 d时,小桐子幼苗的CaM活性达到峰值,与对照的幼苗相比(CK),上调了35.8%,之后逐渐下降,但依然显著高于对照。与单独用PEG处理的幼苗相比,SA1处理可进一步提高小桐子幼苗的CaM活性,这表明渗透胁迫下SA处理可提高小桐子幼苗的CaM活性。
为了弄清Ca2+/CaM信号在SA诱发甜菜碱代谢中的作用,实验中以不同的方式处理(PEG、SA1、SA2、SA3、SA4和SA5,表1)PEG 6000胁迫下的小桐子幼苗,研究了渗透胁迫下Ca2+和CaM抑制剂对SA诱发甜菜碱积累的影响。结果如图6A所示,20% PEG 6000胁迫下,SA1处理2 d显著提高了小桐子幼苗叶片的甜菜碱含量。外源CaCl2处理(SA2)则可进一步促进SA诱发的甜菜碱积累。然而,与单独用SA处理(SA1)的幼苗相比,Ca2+通道阻断剂 LaCl3(SA3)、钙调素抑制剂CPZ(SA4)和TFP(SA5)处理则显著降低了小桐子幼苗甜菜碱的含量。此外,与SA1处理的幼苗相比,CaCl2处理(SA2)2 d也大幅提高了渗透胁迫下小桐子幼苗的BADH活性,而Ca2+通道阻断剂 LaCl3(SA3)、钙调素抑制剂CPZ(SA4)和TFP(SA5)处理得到相反的结果(图6B)。这些结果表明渗透胁迫下SA诱发的甜菜碱积累可能涉及Ca2+/CaM信号调控。
对不同处理条件下小桐子幼苗叶片甜菜碱代谢关键酶基因JcBADH和JcCMO表达水平的检测结果显示,与单独用20% PEG 6000处理的幼苗相比,SA1处理2 d后JcBADH表达水平上调了61.3%,而CaCl2处理(SA2)下JcBADH表达水平上调达115.0%(图7A);与之相反,LaCl3(SA3)、CPZ(SA4)和TFP(SA5)处理显著抑制了渗透胁迫下小桐子幼苗JcBADH基因的表达(图7A)。然而,与单独用SA处理(SA1)的幼苗相比,不论是CaCl2(SA2),还是LaCl3(SA3)、CPZ(SA4)和TFP(SA5)处理,均对渗透胁迫下小桐子幼苗JcCMO表达无显著影响(图7B)。上述结果表明,渗透胁迫下SA活化的JcBADH表达受到Ca2+/ CaM信号调控。
3 討论
在盐碱、干旱和低温胁迫下,植物细胞会失水,从而造成渗透胁迫;为了应对渗透胁迫伤害,植物体内会积累大量的渗透调节物质,如脯氨酸、可溶性糖和甜菜碱等[7,25]。在众多渗透调节物质中,甜菜碱是研究最为广泛的渗透调节剂之一[9-10]。近年来的研究显示,在逆境胁迫下,甜菜
碱具有维持生物膜的稳定性、保护大分子蛋白质和一些酶类不被降解以及清除活性氧等作用[10-11]。目前,已有许多研究证实植物遭受渗透胁迫时会大量积累甜菜碱,然而渗透胁迫诱发甜菜碱积累的机制还不完全清楚。本研究结果显示,渗透胁迫(20% PEG 6000处理)可诱导小桐子幼苗叶片积累大量的甜菜碱(图2)。渗透胁迫也提高了甜菜碱合成关键酶BADH的活性,以及上调JcBADH和JcCMO的表达水平(图3和图4),表明渗透胁迫能激活小桐子甜菜碱的生物合成过程。
甜菜碱的积累涉及复杂的信号转导过程,受到许多因素调控,已有研究报道:ABA、Ca2+、NO、茉莉酸、SA等信号分子会诱发植物体内甜菜碱的积累[13-16]。SA是植物重要的内源生长调节物质,它在植物响应非生物和生物胁迫中发挥着非常重要的作用[21-23]。近年来的研究表明,外源SA处理可显著提高盐和低温胁迫下植物体内甜菜碱的积累,增强植物的抗逆性[16, 22]。Farooq等[26]研究发现,外源SA处理提高了干旱胁迫下水稻中有机渗透调节物质甜菜碱和脯氨酸的水平,从而增强了植株的耐旱性;Li[27]曾报道,高温胁迫下,SA可提高玉米幼苗甜菜碱、脯氨酸和海藻糖的含量,以及SOD、CAT和GR等抗氧化酶的活性。然而,迄今为止,SA如何调控渗透胁迫下植物甜菜碱代谢的具体机制还不清楚。本研究结果显示,渗透胁迫下外源施加1.5 mmol/L SA处理可显著提高小桐子幼苗的甜菜碱含量(图2),上调甜菜碱合成关键酶BADH的活性(图3),以及上调JcBADH和JcCMO的表达水平(图4)。上述结果表明,SA参与了渗透胁迫下小桐子幼苗甜菜碱积累的调控过程,且SA对甜菜碱合成的两步重要氧化反应均有促进作用。其中,SA对甜菜碱合成的第二步反应的促进作用尤为显著。
Ca2+是非常重要的第二信使,CaM是植物中最主要的钙结合蛋白[17, 19];Ca2+/CaM信号普遍参与了植物对高温、低温、干旱、重金属和盐碱等逆境胁迫响应的信号转导过程[17, 28]。许多研究证实,逆境胁迫下Ca2+能和其他信号分子,如H2O2、NO、ABA和SA等信号分子相互作用,相互协调(信号交谈),从而使植物体对各种胁迫刺激做出完整、迅速而准确的反应[28-31]。本研究结果显示,与单独用PEG 6000处理的幼苗相比,1.5 mmol/L SA处理显著提高了渗透胁迫下小桐子幼苗的CaM活性(图5),表明渗透胁迫下SA信号和Ca2+/CaM信号之间可能有“信号交谈”。进一步的实验结果证实,CaCl2处理显著提高了渗透胁迫下SA诱导的甜菜碱积累水平(图6A)。CaCl2处理也提高了甜菜碱合成关键酶BADH的活性(图6B),以及上调了JcBADH的表达水平(图7A)。然而,Ca2+通道阻断剂LaCl3,CaM抑制剂CPZ和TFP处理显著抑制了SA诱导的甜菜碱积累效应(图6和图7)。这些结果表明,渗透胁迫下SA诱导的小桐子甜菜碱积累过程涉及Ca2+/CaM信号调控,且Ca2+/CaM信号可能主要通过活化JcBADH表达促进甜菜碱的生物合成。
综上所述,外源施加1.5 mmol/L SA处理可显著提高渗透胁迫下小桐子幼苗的甜菜碱含量和BADH活性,上调甜菜碱合成关键酶基因JcBADH和JcCMO的表达水平,表明SA诱导的甜菜碱积累是其持续活化甜菜碱两步重要合成反应的结果。此外,CaCl2处理能提高SA诱导的甜菜碱积累水平,而LaCl3、CPZ和TFP处理得到相反的结果,显示渗透胁迫下Ca2+/CaM信号可能对SA诱导的小桐子甜菜碱积累具有重要调控作用。
参考文献
Ao P X, Li Z G, Gong M. Involvement of compatible solutes in chill hardening-induced chilling tolerance in Jatropha curcas seedlings[J]. Acta Physiologiae Plantarum, 2013, 35(12): 3457-3464.
Yang S L, Chen K, Wang S S, et al. Osmoregulation as a key factor in drought hardening-induced drought tolerance in Jatropha curcas[J]. Biologia Plantarum, 2015, 59(3): 529-536.
欧文军, 王文泉, 李开绵. 120份小桐子种质的分子遗传多样性分析[J]. 热带作物学报, 2009, 30(3): 284-292.
Montes J M, Melchinger A E. Domestication and breeding of Jatropha curcas L.[J]. Trends in Plant Science, 2016, 21(12): 1045-1057.
Maes W H A, Trabucco A, Achten W M J, et al. Climatic growing conditions of Jatropha curcas L.[J]. Biomass and Bioenergy, 2009, 33(10): 1481-1485.
Makkar H P S, Becker K. Jatropha curcas, a promising crop for the generation of biodiesel and value-added coproducts[J]. European Journal of Lipid Science and Technology, 2009, 111(8): 773-787.
Marcinska I, Czyczylo-Mysza I, Skrzypek E, et al. Impact of osmotic stress on physiological and biochemical characteristics in drought-susceptible and drought-resistant wheat genotypes[J]. Acta Physiologiae Plantarum, 2013, 35(2): 451-461.
Wu G Q, Feng R J, Shui Q Z. Effect of osmotic stress on growth and osmolytes accumulation in sugar beet (Beta vulgaris L.) plants[J]. Plant, Soil and Environment, 2016, 62(4): 189-194.
Khan M S, Yu X, Kikuchi A, et al. Genetic engineering of glycine betaine biosynthesis to enhance abiotic stress tolerance in plants[J]. Plant Biotechnology, 2009, 26(1): 125-134.
Chen, T H H, Murata N. Glycinebetaine: an effective protectant against abiotic stress in plants[J]. Trends in Plant Science, 2008, 13(9): 499-505.
Moghaieb R E A, Saneoka H, Fujita K. Effect of salinity on osmotic adjustment, glycinebetaine accumulation and the betaine aldehyde dehydrogenase gene expression in two halophytic plants, Salicornia europaea and Suaeda maritime[J]. Plant Science, 2004, 166(5): 1345-1349.
Chen T H H, Murata N. Glycinebetaine protects plants against abiotic stress: mechanisms and biotechnological applications[J]. Plant, Cell and Environment, 2011, 34(1): 1-20.
Gao X P, Pan Q H, Li M J, et al. Abscisic acid is involved in the water stress-induced betaine accumulation in pear leaves[J]. Plant Cell Physiology, 2004, 45(6): 742-750.
Ahire M L, Laxmi S, Walunj P R, et al. Effect of potassium chloride and calcium chloride induced stress on in vitro cultures of Bacopa monnieri (L.) Pennell and accumulation of medicinally important bacoside A[J]. Journal of Plant Biochemistry and Biotechnology, 2014, 23(4): 366-378.
Ullah S, Kolo Z, Egbichi I, et al. Nitric oxide influences glycine betaine content and ascorbate peroxidase activity in maize[J]. South African Journal of Botany, 2016, 105: 218-225.
Farhangi-Abriz S, Ghassemi-Golezani K. How can salicylic acid and jasmonic acid mitigate salt toxicity in soybean plants?[J]. Ecotoxicology and Environmental Safety, 2018, 147: 1010-1016.
Reddy A S N, Ali G S, Celesnik H, et al. Coping with stresses: roles of calcium- and calcium/calmodulin-regu lated gene expression[J]. The Plant Cell, 2011, 23(6): 2010-2032.
Yang S L, Lan S S, Deng F F, et al. Effects of calcium and calmodulin antagonists on chilling stress-induced proline accumulation in Jatropha curcas L.[J]. Journal of Plant Growth Regulation, 2016, 35(3): 815-826.
Yang T, Poovaiah B W. Calcium/calmodulin-mediated signal network in plants[J]. Trends in Plant Science, 2003, 8(10): 505-512.
Nayyar H. Variation in osmoregulation in differentially drought-sensitive wheat genotypes involves calcium[J]. Biologia Plantarum, 2003, 47(4): 541-547.
Naser Alavi S M, Arvin M J, Manoochehri Kalantari K, et al. Salicylic acid and nitric oxide alleviate osmotic stress in wheat (Triticum aestivum L.) seedlings[J]. Journal of Plant Interactions, 2014, 9(1): 683-688.
Aghdam M S, Jannatizadeh A, Sheikh-Assadi M, et al. Alleviation of postharvest chilling injury in anthurium cut flowers by salicylic acid treatment[J]. Scientia Horticulturae, 2016, 202: 70-76.
Shaki F, Maboud H E, Niknam V. Growth enhancement and salt tolerance of safflower (Carthamus tinctorius L.), by salicylic acid[J]. Current Plant Biology, 2018, 13: 16-22.
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
Xing D, Wu Y. Photosynthetic response of three climber plant species to osmotic stress induced by polyethylene glycol (PEG) 6000[J]. Acta Physiologiae Plantarum, 2012, 34(5): 1659-1668.
Farooq M, Basra S M A, Wahid A, et al. Improving the drought tolerance in rice (Oryza sativa L.) by exogenous application of salicylic acid[J]. Journal of Agronomy and Crop Science, 2009, 195(4): 237-246.
Li Z G. Synergistic effect of antioxidant system and osmolyte in hydrogen sulfide and salicylic acid crosstalk-induced heat tolerance in maize (Zea mays L.) seedlings[J]. Plant Signaling and Behavior, 2015, 10(9): e1051278.
Hu X L, Wang W, Li C, et al. Cross-talks between Ca2+/CaM and H2O2 in abscisic acid-induced antioxidant defense in leaves of maize plants exposed to water stress[J]. Plant Growth Regulation, 2008, 55(3): 183.
Guo H, Zhu N, Deyholos M K, et al. Calcium mobilization in salicylic acid-induced Salvia miltiorrhiza cell cultures and its effect on the accumulation of rosmarinic acid[J]. Applied Biochemistry and Biotechnology, 2015, 175(5): 2689-2702.
Niu L, Liao W. Hydrogen peroxide signaling in plant development and abiotic responses: crosstalk with nitric oxide and calcium[J]. Frontiers in Plant Science, 2016, 7: 230.
Niu L, Yu J, Liao W, et al. Calcium and calmodulin are involved in nitric oxide-induced adventitious rooting of cucumber under simulated osmotic stress[J]. Frontiers in Plant Science, 2017, 8: 1684.

