桦褐孔菌纯化多糖体外降血糖活性研究
王梦雅,赵喆禛,薛 娇,胡锦荣,张京生,刘 萍
(中国农业大学食品科学与营养工程学院,北京 100083)
桦褐孔菌(Inonotusobliquus),属于担子菌亚门,层菌纲,多孔菌目,多孔菌科木腐真菌,同时也是一种珍贵的白腐真菌[1]。主要生长繁殖在白桦树、榆树等树皮腋下,主要分布在北纬45°~50 °,包括中国的黑龙江、小兴安岭、长白山、日本的北海道以及西欧等地区[2-4]。16~17世纪以来,在俄罗斯和西伯利亚西部,这种真菌早已被用于民间医学治疗癌症[5-7],通过桦褐孔菌输液治疗来治疗牙周炎、湿疹、皮炎和牛皮藓,桦褐孔菌粉末用来治疗化脓性伤口[8-10]。此外,在乌克兰、白俄罗斯、波兰和大多数波罗的海国家,民间医学早有用桦褐孔菌来治疗肠道癌、心血管疾病和糖尿病的记录[11]。距今为止,从桦褐孔菌中分离出来的化学物质有:三萜类化合物、黑色素、类固醇、多糖等,均显示出一定的生物学活性[12-13]。目前,在桦褐孔菌液体深层发酵过程中,研究较多的活性成分为多糖和三萜类化合物。
桦褐孔菌多糖是桦褐孔菌中最主要的化学成分,但是由于其分离、纯化的难度较高,因此多报道的是粗多糖的含量,目前桦褐孔菌多糖的分离纯化一般通过DEAE-52离子交换柱层析、和Sephadex G-200柱层析等方法进行分离纯化,探究纯化多糖的降血糖活性对深入研究多糖降血糖机理有着重要意义。肝细胞是糖代谢作用的靶细胞之一,HepG2细胞是肝癌细胞的一种,形态、功能均类似于人体干细胞[14],可以利用此细胞来研究桦褐孔菌粗多糖的体外降血糖活性。此外,胰岛素抵抗(insulin resisitance,IR)是Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)的重要发病机制之一,胰岛抵抗现象一直存在于T2DM发展的整个过程[15-16]。HepG2细胞经诱导剂的刺激可使得表面胰岛素受体数目减少,从而使细胞呈现胰岛素抵抗状态[17],通过高糖高胰岛素法诱导建立HepG2细胞胰岛素抵抗模型,是体外研究功能活性成分改善胰岛素抵抗作用的良好实验模型。
本实验室前期分离纯化了四种子实体纯化多糖,发现4种纯化多糖均能促进HepG2细胞对葡萄糖的消耗[18-19],效果与二甲双胍和胰岛素相近,显著高于对照组,为进一步验证纯化多糖的活性,本文通过桦褐孔菌菌丝体液体深层发酵产生胞外多糖,并通过DEAE-52离子交换柱进行初步纯化,选用HepG2细胞来研究桦褐孔菌多糖的体外降血糖活性,为进一步纯化多糖生产药物提供理论基础。
1 材料与方法
1.1 材料与仪器
HepG2肝癌细胞株 北京博奥森生物公司;DMEM培养、胰蛋白酶消化液 北京科奥试剂有限公司;胎牛血清(FBS) 杭州四季青生物工程材料有限公司;四甲基偶氮唑蓝(MTT)、胰岛素 美国Sigma公司;二甲基亚砜(DMSO) 天津市富宇精细化工有限公司;盐酸二甲双胍(Met) 北京中惠药业有限公司;葡萄糖测定试剂盒 南京建成生物科技股份有限公司;磷酸缓冲液(PBS)、青霉素-链霉素双抗 北京索莱宝科技有限公司;阿卡波糖 上海源叶公司。
SW-CJ-2D超净工作台、YCP-50CO2培养箱 北京三木科技仪器有限公司;TG16-WS台式离心机 长沙湘仪离心机仪器有限公司;YXQ-SG41-280灭菌锅 四川射洪医疗器械厂;M200 pro多功能酶标仪 Tecan集团奥地利有限公司;细胞培养瓶 北京均利博科技有限公司;96孔细胞培养板 美国康宁公司;0.22 μm微孔滤膜 北京均利博科技有限公司。
1.2 实验方法
1.2.1 多糖的分离纯化 添加4 μg/mL VB6于发酵培养基中,发酵、浓缩、醇沉得到粗多糖。
1.2.1.1 种子培养 培养基:葡萄糖2%,胰蛋白胨0.4%,KH2PO40.1%,MgSO40.1%,pH自然。将桦褐孔菌PDA斜面菌种接入250 mL摇瓶,装液量100 mL,于28 ℃ 150 r/min振荡培养7 d,获得一级摇瓶种子。
1.2.1.2 发酵培养 同种子培养基成分。将长好的种子培养基以10%的接种量接入250 mL的锥形瓶中,添加4 μg/mL VB6于发酵培养基中,装液量100 mL,于28 ℃ 150 r/min振荡培养13 d。
1.2.1.3 粗多糖的分离 发酵培养基培养13 d后,抽滤获得发酵液,在40~65 ℃的条件下浓缩发酵液至10 mL,添加4倍体积的无水乙醇醇沉、过夜、烘干后即得到发酵粗多糖。
1.2.1.4 多糖纯化 采用Xue等[19]的方法并加以改进,DEAE-52纤维素为预溶胀型阴离子交换树脂。先将DEAE-52阴离子交换剂干粉浸泡于蒸馏水中约5 h,去除杂质;而后用0.5 mol/L的HCl溶液中浸泡1~2 h,用去离子水洗至pH为中性,抽滤、干燥后继续浸泡在0.5 mol/L的NaOH溶液中1~2 h,抽干后即得到处理好的DEAE-52纤维素。取干燥洁净的层析柱,竖直固定,然后加入1/3体积的蒸馏水,打开下端出口,排出气泡。沿内壁将预处理的DEAE-52纤维素缓慢倒入层析柱中,用平衡缓冲液平衡,直至流出液体的pH与缓冲液一致,待柱面高度不再变化准备上样。然后用去离子水、0.5 mol/L NaCl溶液对DEAE进行多糖溶液洗脱,得到的两种多糖洗脱液,洗脱峰单一,说明两种多糖均为纯多糖。将多糖洗脱液浓缩得到水洗多糖液和0.5 mol/L NaCl洗脱多糖液。将多糖洗脱液过0.45 μm滤膜,冻干后即得两种纯化多糖,记为EIOP1(ExtracellularInonotusobliquuspolysaccharides 1,水洗多糖)、EIOP2(0.5 mol/L NaCl洗脱多糖)。针对两种多糖,采用葡萄糖凝胶渗透色谱(GPC)进一步验证多糖的纯度。实验结果表明,EIOP1和EIOP2组分经过GPC分离后都只得到一个单峰,从而说明这两种多糖分布均匀,不含其他杂质,这与本实验室前期研究结果[20]一致,且两种纯化多糖的分子量分别为20240、202869 Da。
1.2.2α-葡萄糖苷酶抑制活性分析 用0.1 mol/L的磷酸钾缓冲液(PBS)稀释得到不同浓度粗多糖溶液,按表1加入各反应试剂。首先,加入浓度为10、20、40、80、160和320 μg/mL多糖样品溶液,在37 ℃下保持5 min,然后向反应体系中加入α-葡萄糖苷酶,在37 ℃下反应30 min,随后加入底物pNPG(对硝苯基-B-D-吡喃半乳糖苷)引发反应,继续在37 ℃下反应30 min。最后,向反应体系中加入Na2CO3终止反应,在405 nm处测量吸光度[21]。样品对照组用PBS代替α-葡萄糖苷酶,通过公式计算α-葡糖苷酶的抑制率(R),并用Origin 8.0计算IC50值。

表1 α-葡萄糖苷酶活性抑制率反应体系Table 1 Reaction system of inhibition activity against α-glucosidase
1.2.3 桦褐孔菌菌丝体多糖的HepG2细胞实验
1.2.3.1 HepG2细胞的复苏与培养 复苏HepG2细胞:从液氮罐中取出细胞冷冻管,迅速将其放入37 ℃水浴锅中,使细胞缓慢解冻。将细胞吸取至无菌细胞培养瓶中,加入含有5%胎牛血清的DMEM培养基,在37 ℃下,于5% CO2培养箱中孵育,直至大多数贴壁细胞能够存活并增殖。
传代培养HepG2细胞:将旧培养基吸弃,加入600 μL胰蛋白酶,消化结束后,迅速弃去胰蛋白酶,加入含10% FBS的新鲜培养基,反复轻轻吹打培养瓶壁,使所有细胞脱离瓶壁,经吹打后得到的细胞悬液以1∶3 (V/V)接种到新的培养瓶中,在5% CO2、95% O2、37 ℃条件下继续培养72 h。
1.2.3.2 不同刺激因子发酵胞外多糖对HepG2细胞增殖的作用 用胰蛋白酶溶液消化1.2.3.1中复苏后的细胞,用含10%胎牛血清的DMEM培养液吹打均匀,通过细胞计数,使单细胞悬液密度为1×106cell/mL,移液枪高压灭菌后吸取100 μL/孔接种。加入终浓度为10、20、40、80、160 μg/mL的多糖样品组,设置不加药物的对照组,此外,设置二甲双胍组(Met,终浓度为1×10-3mmol/L),分别孵育24、48 h后,于5% CO2、95% O2、37 ℃的CO2培养箱中培养24、48 h后,每孔加入20 μL浓度为5 mg/mL的MTT溶液,于培养箱中继续孵化4 h。吸弃旧培养基,加入二甲亚砜(DMSO)150 μL,用枪头吹吸均匀,结晶物充分溶解后,在570或490 nm处测定96孔板吸光值,通过吸光值的数值计算出活性细胞数量[22]。
1.2.3.3 不同刺激因子发酵胞外多糖对正常HepG2细胞葡萄糖消耗的影响 浓度为10、20、40、80 μg/mL的多糖样品对正常HepG2细胞葡萄糖消耗的影响参考文献[23]进行。首先将活化好的细胞培养至对数生长期,使每孔细胞密度为1×106cells/mL,以不含多糖样品的DMEM培养液作为空白对照组,以终浓度为10、20、40、80 μg/mL的多糖样品组为实验组。此外,设置阳性对照组:二甲双胍组(Met,终浓度为1×10-3mmol/L),孵育24 h后,按照试剂盒说明书的指示方法检测葡萄糖含量。
细胞的葡萄糖消耗量(ΔGC)=空白组上清液葡萄糖含量-实验组上清液葡萄糖含量。
为防止细胞增殖或死亡产生的误差,每孔加入20 μL的5 mg/mL MTT溶液继续培养4 h,培养结束后,每孔加入150 μL DMSO,振荡10 min,于570 nm处测定吸光值,结果以ΔGC/MTT表示。
1.2.3.4 HepG2细胞胰岛素抵抗模型的建立 建立胰岛素抵抗模型的方式有多种,本实验中采用高糖高胰岛素法,并加以改进[24]。调整细胞密度为2×106cell/mL,此密度大于正常HepG2细胞组,有利于胰岛素抵抗效果的检测。待细胞贴壁后,加入新配制的含有胰岛素的培养液,使其终浓度为10-5、10-6、10-7、10-8、10-9、10-10mol/L,并设无胰岛素的空白孔为正常对照组,在37 ℃、5% CO2培养箱中培养24 h。使用葡萄糖试剂盒检测葡萄糖含量,以葡萄糖消耗量最低者为胰岛素抵抗细胞模型的建立标准。
1.2.3.5 不同刺激因子发酵胞外多糖对胰岛素抵抗(IR)-HepG2细胞葡萄糖消耗的影响 按照文献[25]中记录的方法进行实验,并进行适当修改。以2×106cell/mL的密度铺板,加入合适浓度的胰岛素,使其达到诱导浓度(10-6mol/L),于37 ℃、5% CO2培养箱中培养24 h完成诱导,建立抵抗模型。随后,以加入浓度为10、20、40、80 μg/mL的多糖样品组为实验组,设置不加胰岛素组为空白对照组,二甲双胍组为阳性对照组,不加多糖样品IR组为阴性对照组。药物处理24 h后,同1.2.3.3处理,结果以ΔGC/MTT表示。
1.3 数据处理
实验均重复3次,结果用平均值±标准差表示。采用Excel、SPSS 22.0、Origin 8.0统计分析软件进行分析,多组间比较用ANOVA方差分析。
2 结果与分析
2.1 桦褐孔菌菌丝体纯化多糖对α-葡萄糖苷酶抑制活性的影响
阿卡波糖(Acarbose)是一种α-葡萄糖苷酶抑制剂,通过抑制食物中碳水化合物分解为葡萄糖,从而缓解餐后高血糖,达到降血糖的作用,是一种治疗糖尿病的药物[26]。桦褐孔菌菌丝体纯化多糖对α-葡萄糖苷酶的抑制活性见表2。由表可知,EIOP1、EIOP2的IC50值分别为39.18、29.87 μg/mL,均极显著低于阿卡波糖(P<0.01),IC50值为1020.89 μg/mL,显示出较高的α-葡萄糖苷酶抑制活性。此外,两种纯化多糖的α-葡萄糖苷酶抑制活性显著高于未纯化的粗多糖(P<0.05),说明经过分离提纯后的桦褐孔菌菌丝体纯化多糖具有较强的α-葡萄糖苷酶抑制活性。

表2 不同浓度纯化多糖对α-葡萄糖苷酶抑制活性的影响Table 2 Effect of different concentrations of purifiedpolysaccharides on α-glucosidase inhibitory activity
2.2 不同浓度桦褐孔菌菌丝体纯化多糖对HepG2细胞增殖的影响
不同浓度桦褐孔菌菌丝体纯化多糖对HepG2细胞增殖的影响如表3所示,随着多糖浓度的增大,细胞增殖率逐渐变小。将细胞分别培养24、48 h,当纯化多糖浓度为10~80 μg/mL时,EIOP1、EIOP2对细胞活性影响不大,细胞增殖率大于90%,表明此浓度范围内的多糖溶液对HepG2细胞没有生理毒性,而浓度为160 μg/mL时,EIOP1细胞增殖率小于90%,与对照相比有极显著差异(P<0.01),说明浓度过高会给细胞产生一定的毒性影响,此外二甲双胍组与对照组相比无显著差异,说明此浓度(10-3mmol/L)的二甲双胍对HepG2细胞的生理活性没有影响。因此选择样品浓度为10、20、40和80 μg/mL为安全给药范围继续后续研究。

表3 不同浓度纯化多糖对HepG2细胞增殖作用的影响Table 3 Effects of purified polysaccharides at differentconcentrations on proliferation of HepG2 cells
2.3 HepG2细胞葡萄糖消耗情况
2.3.1 不同浓度胰岛素对HepG2细胞葡萄糖消耗的影响 由图1所示,利用高糖高胰岛素对HepG2细胞进行诱导,使其对胰岛素产生抵抗,模拟Ⅱ型糖尿病细胞模型。由图1可知,当胰岛素浓度为10-6mol/L时,其葡萄糖消耗量最低,极显著低于对照组与其他组(P<0.01),说明模型建立成功,因此,选用浓度为10-6mol/L胰岛素诱导的HepG2细胞为胰岛素抵抗型细胞进行后续实验。

图1 不同浓度胰岛素对HepG2细胞葡萄糖消耗的影响Fig.1 Effect of different concentrations ofinsulin on glucose consumption in HepG2 cells 注:与对照组细胞相比,***表示P<0.01差异极显著,*表示P<0.05差异显著;与10-6 mol/L组相比,&&表示P<0.01差异极显著,&表示P<0.05差异显著。
2.3.2 桦褐孔菌菌丝体胞外纯化多糖EIOP1对体外细胞降血糖活性的影响 桦褐孔菌菌丝体纯化多糖EIOP1对正常HepG2细胞24 h的葡萄糖消耗的影响如图2A所示,培养24 h后,与对照组相比,EIOP1在浓度为40~80 μg/mL时,均能促进HepG2细胞的葡萄糖消耗量,随着样品浓度的增加,其促进葡萄糖消耗率的趋势逐渐升高后逐渐稳定。当样品组浓度为80 μg/mL时,促进效果最好,葡萄糖消耗量比对照组提高30.62%,具有极显著差异(P<0.01)。

图2 不同浓度EIOP1对HepG2细胞葡萄糖消耗的影响Fig.2 Effect of different concentrations ofEIOP1 on glucose consumption in HepG2 cells注:A:HepG2细胞;B:IR-HepG2细胞;与对照组细胞相比,***P<0.01差异极显著,*P<0.05差异显著;与IR组相比,&&P<0.01差异极显著,&P<0.05差异显著;与二甲双胍组相比,##P<0.01差异极显著,#P<0.05差异显著;图3同。
桦褐孔菌菌丝体纯化多糖EIOP1对IR-HepG2细胞24 h的葡萄糖消耗实验如图2B所示。,与IR组相比,多糖浓度在10~40 μg/mL时能够极显著促进胰岛素抵抗细胞的葡萄糖消耗(P<0.01),其中样品组浓度为40 μg/mL时,促进效果最好,比IR组提高了30.00%,接近于Met(二甲双胍)组。随着样品浓度的增加,其促进葡萄糖消耗率的趋势逐渐升高并达到最大,随后下降,多糖浓度在80 μg/mL时其促进葡萄糖消耗量降低,接近IR组,可能是由于高浓度多糖溶液对IR-HepG2细胞产生了生理毒害作用[27],具体机制有待进一步研究。
2.3.3 桦褐孔菌菌丝体胞外纯化多糖EIOP2对体外细胞降血糖活性的影响 桦褐孔菌菌丝体纯化多糖EIOP2对正常HepG2细胞24 h的葡萄糖消耗实验如图3A所示。与对照组相比,EIOP2在10~80 μg/mL时都能提高HepG2细胞的葡萄糖消耗量。当样品浓度在40 μg/mL时,极显著促进了葡萄糖消耗(P<0.01),比对照组提高了75.99%。
胰岛素抵抗是Ⅱ型糖尿病的重要的发生机制之一,改善胰岛素的敏感性,增强胰岛素调节血糖功能是降血糖重要机制之一[28]。桦褐孔菌菌丝体纯化多糖EIOP2对IR-HepG2细胞24 h的葡萄糖消耗实验如图3B所示,与IR组相比,EIOP2在10~80 μg/mL时,能够显著促进细胞的葡萄糖消耗,具有极显著差异(P<0.01),其中样品组浓度为80 μg/mL时,促进效果最好,比IR组提高了90.49%(P<0.01),高于Met组,差异有极显著性(P<0.01)。说明桦褐孔菌纯化多糖能够显著提高胰岛素抵抗型HepG2细胞的葡萄糖消耗能力,改善胰岛素抵抗状态[28]。
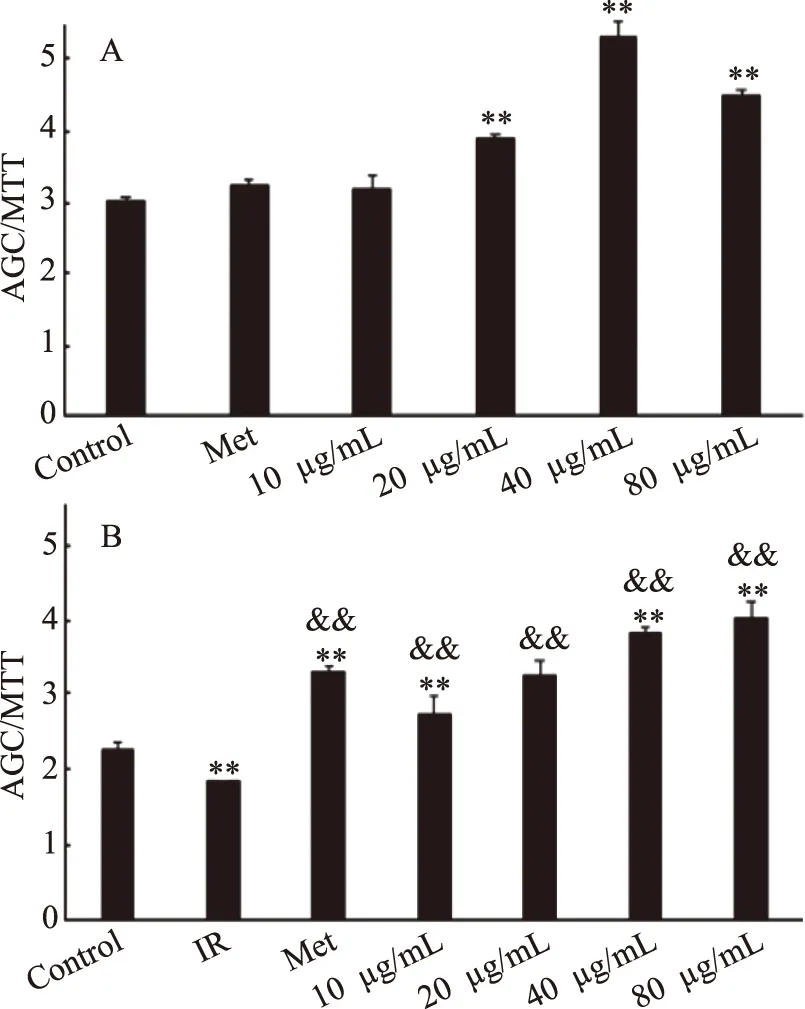
图3 不同浓度EIOP2对HepG2细胞葡萄糖消耗的影响Fig.3 Effect of polysaccharides eluted with differentconcentrations of EIOP2 on glucose consumption in HepG2 cells
3 讨论与结论
α-葡萄糖苷酶抑制剂因对④型糖尿病有治疗作用而备受关注,它能减少进入肠胃中的食物中葡萄糖的释放,从而降低餐后血糖,机理主要是抑制剂通过降低人体内小肠内绒毛膜的麦芽三糖、双糖类水解酶以及结合酶的活力,从而降低血糖[29]。本文将发酵醇沉得到粗多糖过DEAE-52纤维素柱进行分离纯化,探究了桦褐孔菌菌丝体发酵纯化多糖体外降血糖活性,结果表明,EIOP1、EIOP2均能够抑制α-葡萄糖苷酶活性,且IC50均显著低于阳性对照临床药用阿卡波糖(P<0.01)和粗多糖(P<0.05)。
胰岛素抵抗是多种代谢相关疾病的共同病理生理基础及共有的危险因素,已成为Ⅱ型糖尿病发病的中心环节,因此可从防治及其糖脂代谢紊乱入手从中药中寻找优良的治疗糖尿病新药[30]。本文选用人源HepG2细胞,研究了桦褐孔菌多糖对正常HepG2细胞和IR-HepG细胞的葡萄糖消耗作用,实验结果表明纯化后的桦褐孔菌多糖能显著促进高胰岛素诱导的IR-HepG2细胞的葡萄糖消耗,使IR-HepG2细胞的葡萄糖消耗量明显增加,其作用程度优于二甲双胍,说明桦褐孔菌纯化多糖能够改善的胰岛素抵抗状态,增强细胞对葡萄糖的摄取和利用,这与龙凯等[29]和李长贵等[31]的研究结果相一致。高浓度(80 μg/mL)的EIOP1其促进IR-HepG2细胞的葡萄糖消耗的效果降低,而相同浓度的EIOP2对促进葡萄糖消耗作用却保持不变,推测原因可能是与其理化性质、单糖组成、分子量大小和结构特征等紧密相关[20]。实验结果还表明,两种桦褐孔菌多糖一定浓度范围内均能够显著促进HepG2和IR-HepG2细胞的葡萄糖消耗,且不同浓度桦褐孔菌对促进葡萄糖消耗具有不同的效果,后续研究可以注重于探究桦褐孔菌多糖对糖代谢关键酶活性的影响。
综上,纯化后的两种多糖其α-葡萄糖苷酶抑制活性显著高于粗多糖,而促进体外细胞的葡萄糖消耗效果不等同于粗多糖,可能是因为桦褐孔菌粗多糖中多糖成分复杂,互相之间能起到协同作用,具体协同机制有待研究。

