242份小麦品种(系)成株期抗条锈病鉴定及分子标记检测
周 军,李魁印,张 立,彭 琴,徐如宏,任明见
(1.贵州大学 农学院/国家小麦改良中心贵州分中心,贵州 贵阳 550025;2.安顺学院,贵州 安顺 561000)
小麦条锈病是由条形柄锈菌(Pucciniastriiformisf.sp.Tritici)引起的气传性叶部病害[1],具有发生强度高、流行范围广等特点,严重威胁我国小麦生产。实践证明,选育与合理使用抗病品种是控制小麦条锈病最经济、安全、有效的措施。病原菌的高度变异性和抗性资源的不恰当使用,致使生理小种基因突变或遗传重组,与寄主协同进化[2],克服寄主原有抗性。目前,小麦抗病育种面临的主要问题是抗源匮乏、抗性遗传基础狭窄[3-4]。要解决上述问题,只有寻找新的抗源,挖掘潜在抗性基因,拓宽广谱抗性基础,增加其遗传多样性。迄今为止,已发现小麦抗条锈基因共130个,其中被正式命名的抗性基因83个(全生育期抗性基因55个,成株期抗性基因28个)[5]。明确小麦种质的抗性水平和抗病基因是实现小麦种质合理布局、抗性基因有效利用的关键环节和重要前提。条中32(CYR32)和条中33(CYR33)成为条锈菌优势生理小种以来,对小麦抗源产生了巨大毒性[6-7]。目前,仅有少数抗条锈病基因(Yr10、Yr18、Yr26等)保持良好抗性[8-9]。在四川、甘肃等省相继发现对抗条锈基因Yr26和Yr10具有联合毒性的新菌株CM42-3、G22(代号V26),极有可能上升为新的优势生理小种,对小麦生产造成巨大危害[10-11]。不断发掘不同类型的抗源,促进小麦抗性基因的多样化,是防治小麦条锈病的重要手段。近年来,国内学者为此做了大量研究。韩德俊等[12]通过田间抗性鉴定和抗条锈病分子标记对1 980份小麦种质进行检测,筛选出50份优异的抗源种质;周新力等[13]通过对80份国外春小麦种质进行抗条锈病鉴定,发现80份种质中大部分对当前条锈病菌生理小种(CYR31、CYR33等)等表现出良好的抗性;李艳丽等[14]利用条锈菌生理小种条中32、条中33及混合菌种对67份引进的小麦种质进行抗病鉴定,发现这批种质含有丰富的抗条锈病基因;侯璐等[15-16]对81份春小麦种质进行抗条锈病鉴定,发现具有全生育期抗性、成株期抗性的种质仅有7、39份。综上,目前尚未见对贵州省自育小麦材料和其他小麦材料同时进行抗条锈病鉴定和分子检测的研究。为此,依托贵州省复杂的条锈菌源群体,对242份小麦材料进行田间成株期抗条锈病鉴定,旨在明确供试材料的抗性水平和抗性基因类型,综合评价各抗源的利用价值,为合理使用、布局小麦种质资源奠定基础。
1 材料和方法
1.1 供试材料
供试小麦品种(品系)来自贵州、四川、山东、河南等省,共242份,辉县红为小麦条锈病感病对照,所有材料均由国家小麦改良中心贵州分中心保存并提供。
1.2 试验方法
1.2.1 成株期抗条锈病鉴定 在贵州大学教学试验场国家小麦改良中心育种基地进行条锈病田间自然诱发试验。对供试小麦材料进行条播,每份材料播种2行,每隔10行种植2行感病对照材料辉县红。当感病品种充分发病后,进行田间病情调查。按照国家农业行业标准(NY/T 1443.1—2007)进行小麦抗条锈病鉴定[17]。每份材料随机调查50片叶,分别记录病级、严重度及发病率,计算病情指数,共调查2次,2次调查间隔15 d。小麦病级分为7个等级:0;0’;1-、1、1+;2-、2、2+;3-4;3;4。抗性水平分为7个等级:免疫(I)、近免疫(NIM)、高抗(HR)、中抗(MR)、慢锈(SR)、中感(MS)、高感(HS)。
1.2.2 小麦基因组DNA的提取与分子检测 将供试小麦材料穴播于装有营养土的育苗盘内,待其幼苗两叶期剪取叶片,用改进CTAB法[18]提取基因组DNA,然后进行Yr基因检测,用于检测Yr基因的分子标记引物由生工生物工程(上海)股份有限公司合成(表1)。
1.2.3 PCR扩增体系及产物检测 PCR反应体系为10 μL,包含10×buffer(含Mg2+)1 μL,上、下游引物各1 μL,Taq0.1 μL,dNTP 0.2 μL,DNA 2 uL,其余用双蒸水补齐。PCR反应程序为:94 ℃预变性4 min;94 ℃变性40 s,50~60 ℃退火45 s,72 ℃延伸1 min,35~40个循环;72 ℃延伸10 min,4 ℃保存。产物均用8%非变性聚丙烯酰胺凝胶电泳检测,并在胶片观察灯上观察记录扩增条带。
1.3 数据处理
数据处理分析采用SPSS 17.0和Excel 2010。

表1 小麦Yr基因的分子标记Tab.1 Molecular markers of wheat Yr genes
2 结果与分析
2.1 供试小麦材料成株期抗条锈评价
供试242份小麦材料的田间成株期抗条锈鉴定结果见表2,贵协2号、贵农25号等116份材料在田间表现为成株期抗条锈病,占供试材料的47.93%。其中,表现免疫或近免疫的材料有贵农19号、贵协3号等38份,占供试材料的15.70%;表现为高抗的材料有贵农25号、川辐9号等41份,占16.94%;表现为中抗的有贵农麦32号、贵农28号等37份,占15.29%。表现慢锈的材料有1份,占0.41%。表现中感和高感的材料有125份,占51.65%。
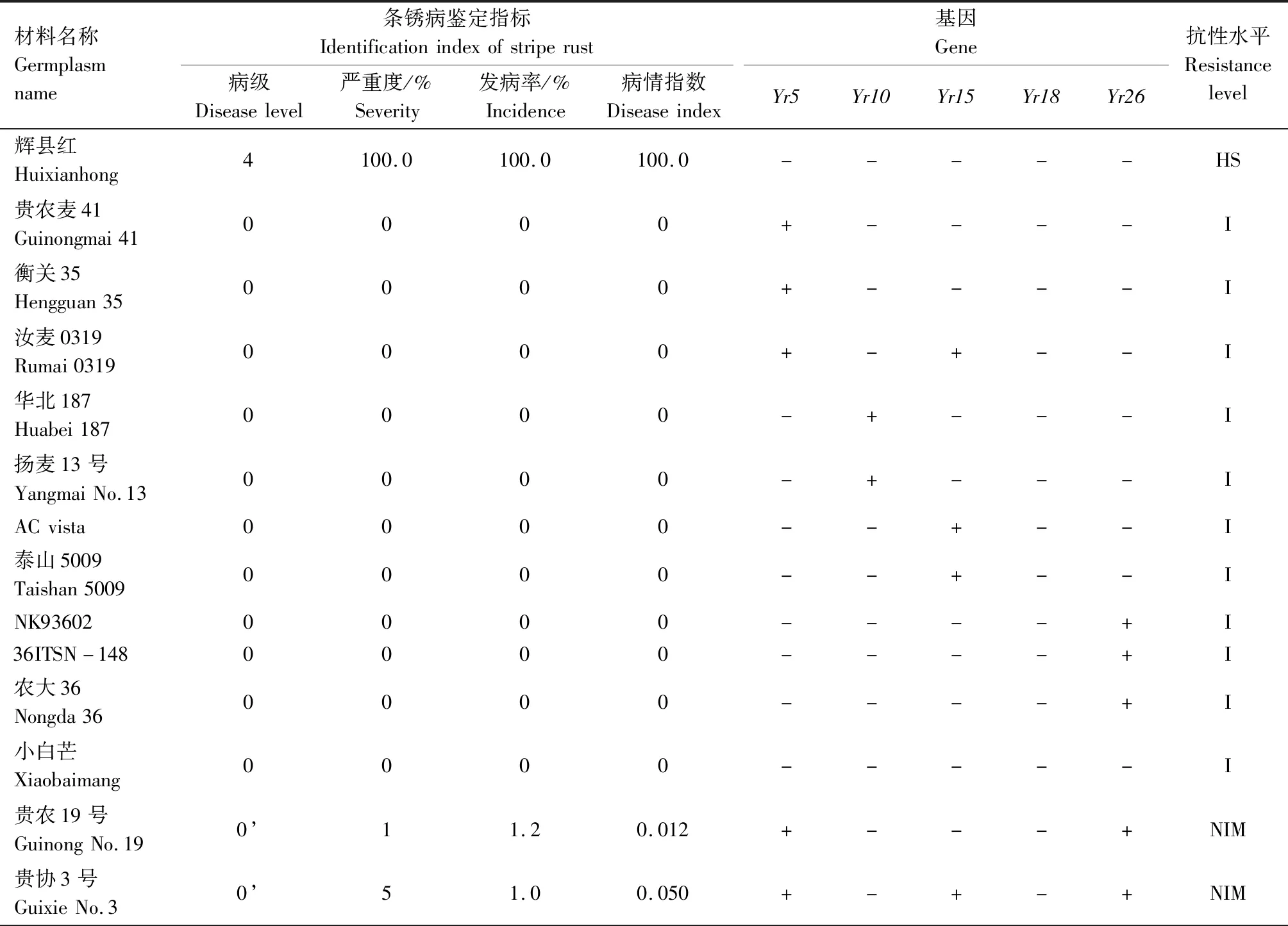
表2 小麦材料成株期抗条锈鉴定及分子检测结果Tab.2 Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials
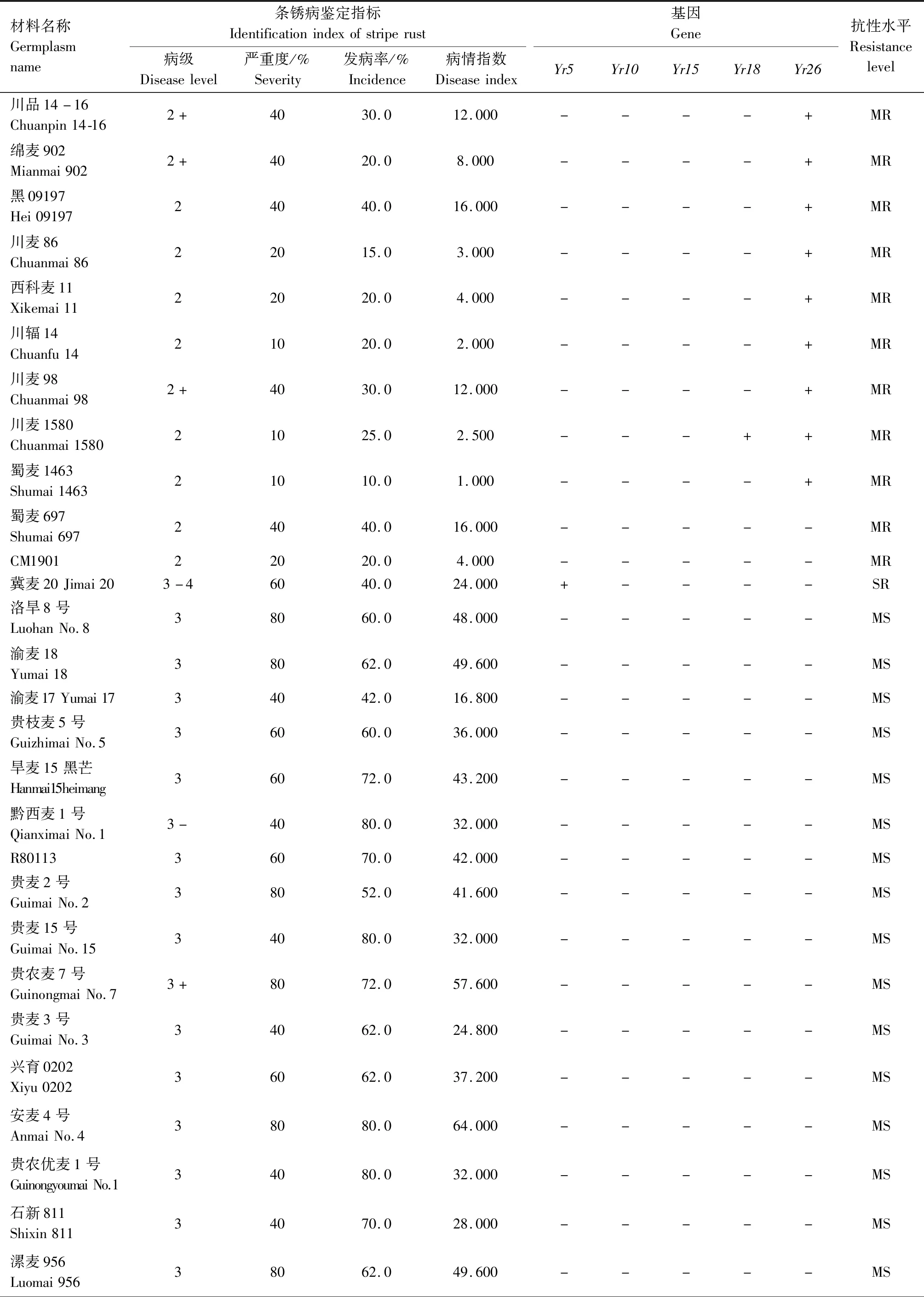
续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials

续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials
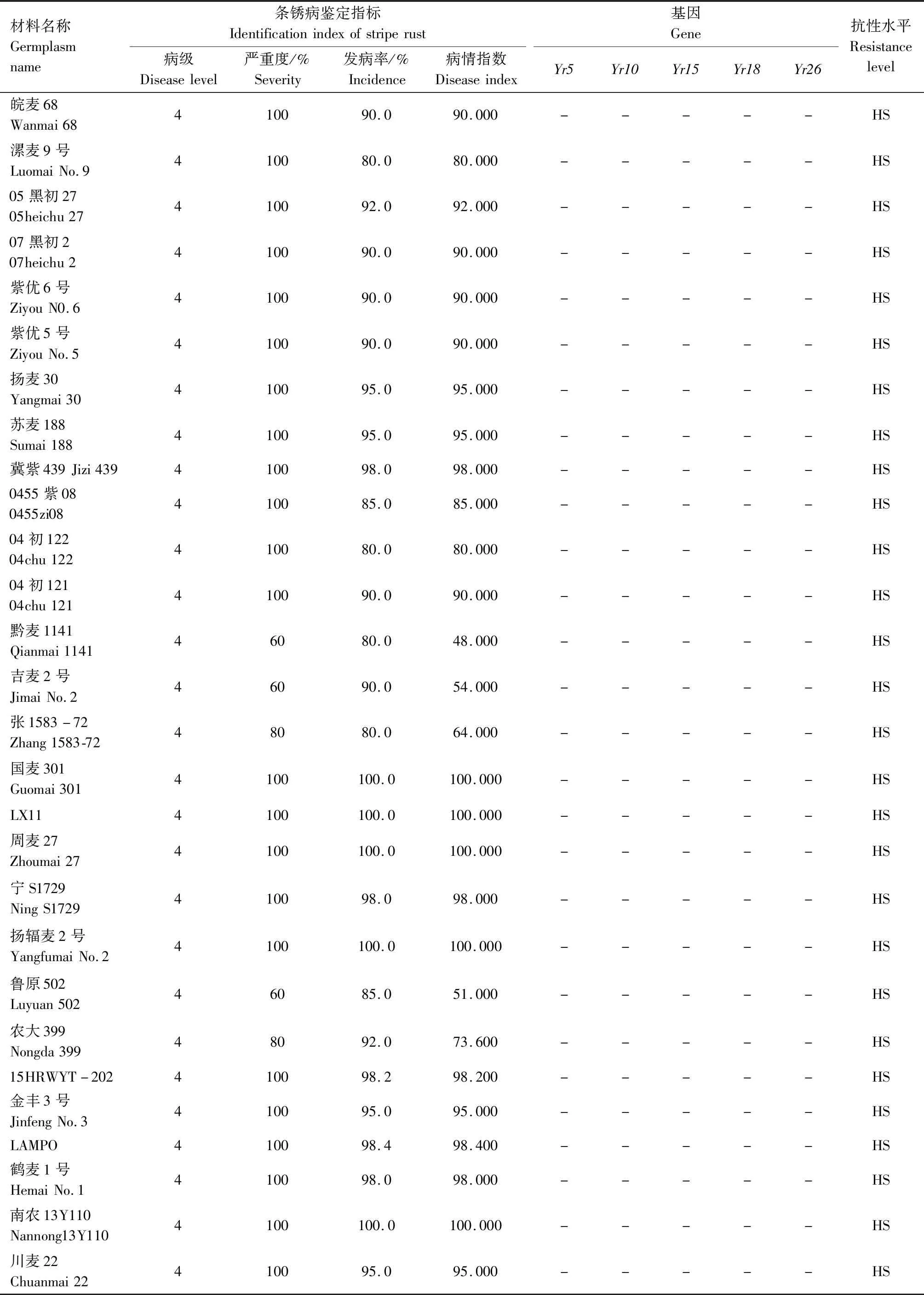
续表2 小麦材料成株期抗条锈性鉴定及分子检测结果Tab.2(Continued) Identification and molecular detection of resistance to stripe rust in wheat materials
2.2 242份小麦材料Yr基因的分子检测
利用已知的抗条锈基因(Yr5、Yr10、Yr15、Yr18、Yr26)分子标记对242份小麦材料进行检测,以便明确其利用价值。
2.2.1Yr5和Yr10本研究利用MURPHY等[19]开发的SSR标记Xwmc175检测Yr5基因,结果显示,贵农28号、贵农25号等52份材料含有该基因(表2)。利用邵映田等[20]开发的SCAR标记SC200检测Yr10基因,结果显示,遗51485等14份材料检测呈阳性(出现200 bp特异条带)(图1、表2)。

M:DNA Marker Ⅰ;1:辉县红;2:R802;3:贵农28号;4:贵农775;5:贵农25号;6:西科麦10号;7:R205;8:遗51485;9:R232;10:贵麦1925;11:贵农18-9;12:兴育11043;13:贵农麦32号Marker:DNA Marker Ⅰ;1:Huixianhong;2:R802;3:Guinong No.28;4:Guinong 775;5:Guinong No.25;6:Xikemai No.10;7:R205;8:Yi 51485;9:R232;10:Guimai 1925;11:Guinong 18-9;12:Xingyu 11043;13:Guinongmai No.32图1 部分小麦材料的Yr10基因检测Fig.1 Detection of Yr10 gene of some wheat materials
2.2.2Yr15和Yr18利用STS标记Xbarc8[21]检测Yr15基因,结果发现,有21份小麦材料检测到该基因(表2)。利用STS标记CsLv34[22]检测Yr18基因,结果发现13份材料含有Yr18基因(扩增出150 bp特异条带)(图2、表2)。

M:DNA Marker Ⅰ;1:川麦1580;2:辉县红;3:贵农28号;4:贵农775;5:贵农25号;6:西科麦10号;7:34ITSN-25;8:川麦602;9:KAUZ’S/FLORKWA-1;10:Cimrmanova;11:京771;12:HUBARA-5/AAGI-1;13:百农3217;14:鲫鱼麦;15:绵阳20;16:中科糯麦1号;17:川麦1456;18:139易2011-1M:DNA Marker Ⅰ;1:Chuanmai 1580;2:Huixianhong;3:Guinong No.28;4:Guinong 775;5:Guinong No.25;6:Xikemai No.10;7:34ITSN-25;8:Chuanmai 602;9:KAUZ’S/FLORKWA-1;10:Cimrmanova;11:Jing 771;12:HUBARA-5/AAGI-1;13:Bainong 3217;14:Jiyumai;15:Mianyang 20;16:Zhongkenuomai No.1;17:Chuanmai 1456;18:139yi2011-1图2 部分小麦材料的Yr18基因检测Fig.2 Detection of Yr18 gene of some wheat materials
2.2.3Yr26根据WU等[23]、王春梅[24]开发的STS标记(Xwe173)检测Yr26基因,结果发现59份材料含有Yr26基因(出现451 bp特异条带)(图3、表2)。
2.3 抗条锈小麦材料中Yr基因组合的分子检测
由表2可知,同时检测到含有2个抗病基因的材料39份,其中Yr26+Yr15组合1份(贵协2号),Yr26+Yr18组合3份(中科糯麦1号等),Yr26+Yr10组合1份(新麦13),Yr26+Yr5组合22份(贵绿枝麦1号、贵农19号等),Yr5+Yr10组合1份(百农3217),Yr18+Yr10组合1份(RC63),Yr18+Yr5组合4份(绵阳20、蜀麦830等),Yr10+Yr15组合1份(兴育11043),Yr5+Yr15组合5份(黔麦19等)。7份材料能同时检测到3个抗病基因,其中Yr26+Yr15+Yr5组合4份(贵农775、蜀麦1731、贵协3号等),Yr18+Yr15+Yr5组合1份(34ITSN-25),Yr5+Yr18+Yr26组合1份(邯6172),Yr5+Yr10+Yr26组合1份(西科麦10号)。同时含有4个抗病基因的材料1份,为Yr26+Yr15+Yr5+Yr10组合(80F-1-4-2)。检测到含有多个抗性基因的小麦材料(贵协2号、贵农19号等)在田间表现出高抗,甚至近免疫或免疫。

M:DNA Marker D2000;1:贵农28号;2:贵农775;3:贵农25号;4:西科麦10号;5:贵协2号;6:贵紫麦1905;7:贵协3号;8:贵绿麦13;9:贵绿枝麦1号;10:丰优7号;11:贵麦1925;12:36ITSN-148;13:(01)124-2-31;14:川麦602;15:衡关35;16:农大36;17:蜀麦697;18:绵麦16250;19:川麦65;20:川麦604;21:蜀麦137M:DNA Marker D2000;1:Guinong No.28;2:Guinong 775;3:Guinong No.25;4:Xikemai No.10;5:Guixie No.2;6:Guizimai 1905;7:Guixie No.3;8:Guilümai 13;9:Guilüzhimai No.1;10:Fengyou No.7;11:Guimai 1925;12:36ITSN-148;13:(01)124-2-31;14:Chuanmai 602;15:Hengguan 35;16:Nongda 36;17:Shumai 697;18:Mianmai 16250;19:Chuanmai 65;20:Chuanmai 604;21:Shumai 137图3 部分小麦材料的Yr26基因检测Fig.3 Detection of Yr26 gene of some wheat materials
3 结论与讨论
3.1 充分的发病条件是抗病鉴定的基础和保障
由于贵州独特的气候与环境,使该地区的生理小种复杂多变且独立流行,同时也是条锈菌主要越夏区[25]。因菌源量大,常年条锈病发生普遍且严重,可借助自然病圃鉴定小麦材料的条锈病抗性,掌握小麦材料在自然条件下对当地菌源群体的抗病表现[26],以便抗病资源的合理有效利用。本研究通过对242份小麦材料进行田间自然诱发集中鉴定,筛选出116份成株期表现稳定抗条锈病的材料,其中表现为免疫、近免疫、高抗和中抗的材料分别为11份、27份、41份和37份。传统田间抗病鉴定只能鉴定小麦材料的表型抗性,且常因病原菌生理小种不足或其他因素影响抗病鉴定的可靠性和准确性,因此,需要借助分子检测手段进行鉴定。
3.2 分子标记检测是抗病鉴定的必要手段
分子标记检测技术可有效明确抗性材料所含抗病基因的种类和抗性水平,有利于抗病种质(基因)的科学合理利用。小麦抗条锈基因Yr5、Yr10、Yr18等对我国当前主要流行生理小种条中32等有着良好的田间抗性,并且抗条锈基因Yr18已被证实与多个抗病基因位点连锁,是具有持久抗谱的抗病基因,还抵御多种真菌病害[27]。本研究分子标记检测结果显示,携带Yr5、Yr10、Yr15、Yr18、Yr26基因的材料分别有52、14、21、13、59份,分别占供试材料的21.49%、5.79%、8.68%、5.37%、24.38%;其余抗性材料未检测到上述抗性基因,可能含有其他抗病基因。黄苗苗等[28]对小麦种质资源进行抗条锈基因分子检测,结果显示,供试材料中携带Yr26基因的频率较高(50.22%),其余抗性基因的分布频率较低。本研究中,用CsLv34标记检测到携带Yr18基因的小麦材料仅13份(占供试材料的5.37%),在今后抗病育种中可加强对该基因的利用。针对某些抗条锈基因使用频率高的情况,应综合利用不同类型的抗性基因,降低对条锈菌的选择压力,避免产生新的生理小种。
3.3 分子检测有利于实现多个抗病基因聚合育种
不同抗性基因通过基因聚合手段实现有效结合,不仅可弥补抗性基因间的差异,还能提高抗病基因强度,延长抗性基因使用寿命,使抗病表现更加持久[29]。本试验的研究结果表明,含有2个或3个抗病基因的材料,在田间均表现出优异的抗病性,如贵农19号、贵农775、贵协3号等。寄主的抗病性与抗性基因的质量、数量和遗传背景有关,如小麦品种贵农19号(黔审麦2007002)自2007年审定以来,高抗条锈、白粉病。在多个抗病基因聚合育种实践中,仅凭田间抗性鉴定难以实现不同抗病基因的有效结合,建议结合分子检测开展多个抗病基因的聚合育种。

