超声辅助提取山茱萸熊果酸工艺优化及其抗氧化和抑菌性
张立攀,赵梦瑶,周 莉,李鹏冲,高火亮,王法云
(河南省商业科学研究所有限责任公司,河南郑州 450000)
随着经济发展和生活水平提高,人们的健康养生观念不断提升,药食同源观念逐渐受到人们重视。在我国,药食同源具备独特的优势,早在2000多年前的《黄帝内经》中就提出了“药食同源、未病先防”的观点[1]。中国同时具有悠久的饮食和中医药文化,形成了独具特色的药食同源营养保健理念[2-3]。山茱萸(CornusofficinalisSieb. et Zucc),是我国传统中药材,有着悠久的用药历史,最早记载于《神农本草经》,有补益肝肾、涩精固脱的功效[4-6]。山茱萸在我国河南、陕西、山西、四川等地均有分布,在当地存在长期食用的历史,如煲汤、做菜或制作果酒等,未见不良反应报道[7-8]。2018年国家卫健委发布《关于征求将党参等9种物质作为按照传统既是食品又是中药材物质管理意见的函》,将山茱萸照药食物质进行试生产,山茱萸将获批为药食同源物质。
山茱萸作为传统中药材,以往的研究多集中在药用方面[9-10]。从普通和功能食品角度研究山茱萸,对其作为药食同源物质的开发利用,具有积极的意义。山茱萸营养丰富,含有葡萄糖、蛋白质和氨基酸等多种人体必需的营养成分[11-12];同时,还含有环烯醚萜类、皂苷、多糖、熊果酸、齐墩果酸、鞣质等[8,13-15]等活性物质。熊果酸是山茱萸重要的质控指标,除了具有降低血糖[16-19]、抗菌[16,20-21]、抗炎[16,20-23]和抗癌[20]等生物活性,还具有明显的抗氧化功能,是优良的天然抗氧化剂和抑菌剂[23-26]。研究表明[13],氧化应激反应对人体衰老和健康具有非常重大的影响,各种因素导致的过量自由基可以引发一系列的健康问题。因此,应用抗氧化剂对维持人体健康、延缓衰老有着积极的作用[9,13],抗氧化型功能食品是开发功能食品的重要方向[27]。因此,研究山茱萸熊果酸提取工艺及抗氧化、抗菌性能,对开发山茱萸在功能食品领域的应用,充分利用该药食同源资源,有积极的意义。
目前熊果酸的提取方法主要有:有机溶剂回流提取、微波提取、超临界萃取等[28-29],这些方法存在工艺复杂、效率较低等缺点。本文采用超声细胞破碎法,通过单因素及正交试验对从山茱萸中提取熊果酸的工艺进行了优化,同时对山茱萸熊果酸体外抗氧化性和抑菌活性进行了评价,为研究开发山茱萸熊果酸相关功能食品,提供理论参考。
1 材料与方法
1.1 材料与仪器
山茱萸 河南省洛阳市栾川县山区,野生;熊果酸 HPLC≥98%,上海安谱实验科技股份有限公司;金黄色葡萄球菌、大肠杆菌、变形杆菌、枯草杆菌和黑曲霉菌 河南省商业科学研究所有限责任公司微生物实验室提供;无水乙醇、乙酸乙酯 分析纯,天津市富宇精细化工有限公司;香兰素 分析纯,天津市福晨化学试剂厂;冰乙酸 分析纯,天津市科密欧化学试剂有限公司;高氯酸 分析纯,州派尼化学试剂公司;DPPH(2,2-二苯基-1-三硝基苯肼) 99%,Sigma-Aldrich;抗坏血酸(VC) 99%,国药集团;M-H药敏试验琼脂平板 广东环凯微生物科技有限公司;猪油 买自市场,新鲜炼得;其余试剂 均为市售分析纯。
FA2004电子天平 上海衡际科学仪器有限公司;QJ-08B粉碎机 上海兆申科技有限公司;DHG-9052A台式电热干燥箱 上海捷呈实验仪器有限公司;SCIENTZ-IID超声细胞破碎机 宁波新芝生物科技股份有限公司;AL204-ICF分析天平 梅特勒-托利多国际贸易有限公司;RE-2000A快速旋转蒸发仪 上海亚荣生化仪器厂;UV-8000ST双光束紫外可见分光光度计 上海元析仪器有限公司;KW-1000DC恒温水浴锅 江苏中大仪器厂。
1.2 实验方法
1.2.1 样品预处理 取成熟的山茱萸鲜果,经清洗处理后在-2 ℃冷冻处理25 h,然后将冷冻后的山茱萸鲜果直接加入75 ℃的热水中煮3 min后捞出,进行脱核处理,得到山茱萸果肉;自然晾干后,粉碎机磨碎后过40目筛,于50 ℃烘干(8 h),得到山茱萸干果粉[30]。
1.2.2 山茱萸中熊果酸的超声波辅助提取工艺 称取一定质量的山茱萸干果粉,加入一定浓度和体积的溶剂中;然后,按照一定的超声浸提时间、超声浸提温度和超声浸提次数进行提取。提取物经过滤,少量溶剂润洗滤渣;所有滤液合并旋干,残留物用60%乙醇(体积比)溶解,并定容至250 mL容量瓶中,为样品待测储备液。
1.2.3 山茱萸熊果酸超声辅助提取单因素实验
1.2.3.1 超声浸提时间对熊果酸得率的影响 溶剂中乙醇浓度恒定取60%,功率取200 W,料液比取1∶20 (g/mL),超声浸提温度取40 ℃,工作/间歇时间比取5 s/5 s,超声浸提次数1次,超声浸提时间分别取10、15、20、25、30 min,进行提取实验,考察超声浸提时间对熊果酸得率的影响。
1.2.3.2 溶剂中乙醇浓度对熊果酸得率的影响 功率取200 W,料液比取1∶20 (g/mL),超声浸提时间取25 min,超声浸提温度取40 ℃,工作间歇时间比取5 s/5 s,浸提次数1次,溶剂中乙醇浓度分别取40%、50%、60%、70%和80%,进行提取实验,考察溶剂中乙醇浓度对熊果酸得率的影响。
1.2.3.3 超声功率对熊果酸得率的影响 溶剂中乙醇浓度恒定取50%,料液比取1∶20 (g/mL),超声浸提温度取40 ℃,超声浸提时间取25 min,工作/间歇时间比取5 s/5 s,浸提次数1次,功率分别取100、150、200、250、300 W,进行提取实验,考察超声功率对熊果酸得率的影响。
1.2.3.4 超声浸提温度对熊果酸得率的影响 溶剂中乙醇浓度恒定取50%,功率取200 W,超声浸提时间取25 min,料液比取1∶20 (g/mL),工作间歇/时间比取5 s/5 s,浸提次数1次,超声浸提温度分别取 20、30、40、50、60 ℃,进行提取实验,考察超声浸提温度对熊果酸得率的影响。
1.2.3.5 料液比对熊果酸得率的影响 溶剂中乙醇浓度恒定取50%,功率取200 W,超声浸提时间取25 min,超声浸提温度取40 ℃,工作/间歇时间比取5 s/5 s,浸提次数1次,料液比分别取1∶15、1∶20、1∶25、1∶30、1∶35 (g/mL),进行提取实验,考察料液比对熊果酸得率的影响。
1.2.3.6 工作/间歇时间比对熊果酸得率的影响 溶剂中乙醇浓度恒定取50%,功率取200 W,超声浸提时间取25 min,超声浸提温度取40 ℃,料液比取1∶25 (g/mL),浸提次数1次,工作/间歇时间比分别取1 s/5 s、3 s/5 s、5 s/5 s、7 s/5 s、9 s/5 s、10 s/5 s,进行提取实验,考察工作/间歇时间比对熊果酸得率的影响。
1.2.3.7 浸提次数对熊果酸得率的影响 溶剂中乙醇浓度恒定取50%,功率取200 W,超声浸提时间取25 min,超声浸提温度取40 ℃,料液比取1∶25 (g/mL),工作间歇时间比取7 s/5 s,浸提次数分别取1、2、3、4,进行提取实验,考察浸提次数对熊果酸得率的影响。
1.2.4 山茱萸熊果酸超声波辅助提取的正交试验 根据单因素实验结果,固定超声浸提温度为40 ℃,料液比为1∶25 (g/mL),浸提次数为2次,以熊果酸得率为正交试验的评价指标,选取时间、乙醇浓度、功率和超声工作/间歇时间比四个因素设计四因素三水平正交试验。正交试验设计的因素水平见表1。

表1 正交试验因素水平Table 1 Factors and levels of orthogonal test
1.2.5 熊果酸得率的测定
1.2.5.1 标准曲线的绘制 采用分光光度法测量[16]。称取约0.02 g熊果酸标准品,用无水乙醇定容至50 mL容量瓶中,得到熊果酸标准溶液。分别吸取0、0.1、0.2、0.3、0.4、0.6、0.7 mL熊果酸标准溶液于10 mL比色管,加热去除乙醇。冷却后,分别加入0.8 mL 5%香兰素冰乙酸溶液、2 mL高氯酸。放置于60 ℃水浴中保温30 min左右,冷却至室温,用乙酸乙酯定容至10 mL。在波长546 nm处测定吸光度,以吸光度和浓度建立标准曲线。测定熊果酸的标准曲线为:y=37.862x-0.0188,R2=0.9991。
1.2.5.2 熊果酸含量的测定 吸取0.5 mL样品储备液加入到10 mL比色管,加热去除乙醇。冷却后,分别加入0.8 mL 5%香兰素冰乙酸溶液、2 mL高氯酸。放置于60 ℃水浴中保温30 min左右,冷却至室温,用乙酸乙酯定容至10 mL。在波长546 nm处测定吸光度。根据式(1)计算山茱萸提取物熊果酸得率。
式(1)
式中:w为熊果酸得率,%;c为测定液中熊果酸的浓度,mg/mL;m为称取的山茱萸粉样品的质量,g;5为换算系数。
1.2.6 山茱萸熊果酸的初步提纯 参考文献[16]并进行修改。采取正交优化后的组合条件得到山茱萸熊果酸提取液,将该储备液浓缩至原体积的三分之一以下,静置,以转速4000 r/min离心15 min得到沉淀物1;使用无水乙醇在超声下重新溶解沉淀物,然后加入1∶1体积的水,静置沉淀,经3000 r/min离心10 min后得到沉淀物2,经水洗,在50 ℃下真空干燥后,得到初步提纯的熊果酸,用无水乙醇以1 g∶2000 mL的比例制成待测液,按照1.2.5.2进行熊果酸纯度的测定。初步提纯的山茱萸熊果酸,可用于活性测定研究。
1.2.7 山茱萸熊果酸体外抗氧化活性测定
1.2.7.1 还原能力 以山茱萸熊果酸初步提纯产物作为样品,参考文献[31],以相同浓度的VC溶液作阳性对照,进行还原能力的测定,还原能力计算按如下公式:
H=A1-A2
式中:H:还原能力;A1:样品吸光度;A2:空白组吸光度。
1.2.7.2 清除DPPH·能力 参考文献[32]的方法,用无水乙醇代替甲醇,配制0.1 mmol/L 的DPPH溶液,移取1 mL不同浓度的样品溶液于10 mL试管中,加入2 mL蒸馏水和2 mL DPPH溶液,摇匀后室温放置 20 min,于517 nm测吸光值A4,相同体积的蒸馏水和DPPH溶液混匀后的吸光值为A0,1 mL样品溶液和2 mL蒸馏水与2 mL无水乙醇混匀后的吸光值为A3,平行测定3次,取平均值。以VC作阳性对照,按如下公式计算DPPH·的清除率:
式中,R:自由基清除率,%;A4:样品吸光度;A3:对照组吸光度;A0:空白组吸光度。
1.2.7.3 清除·OH能力 参考文献[33]的方法,取1.5 mL不同质量浓度的样品溶液,分别加入1.0 mL 2.5 mmol/L的水杨酸溶液、1.0 mL 5 mmol/L的FeSO4溶液和2.0 mL蒸馏水,充分混匀,加入1.0 mL 5 mmol/L的H2O2,置于37 ℃恒温水浴锅中反应30 min,再置于510 nm波长处测定其吸光度,以蒸馏水作空白对照,同时以VC作阳性对照。按如下公式计算·OH清除率:
羟自由基清除率(%)=[空白对照吸光度-(加H2O2样品溶液吸光度-不加H2O2样品溶液吸光度)]/空白对照吸光度×100
1.2.7.4 对猪油的抗氧化能力 参考文献[34]的方法,以空白油脂为对照,将添加量为0.25%、0.5%和0.75%的山茱萸熊果酸与0.25% VC处理的猪油进行对比;猪油样品过氧化值测定参照GB/T 5538-2005 的碘量法,进行测定。
1.2.8 山茱萸熊果酸抑菌试验
1.2.8.1 药敏试验 参考文献[21]的方法,取直径为6 mm的无菌空白纸片,121 ℃高压蒸汽灭菌15 min,待用。取20 μL用无菌水制备的50 mg/mL熊果酸溶液,滴加于灭菌的空白纸片上,备用。采用纸片琼脂扩散法测定抑菌活性,将菌株菌液调整为1.0×108CFU/mL,涂布于M-H平板上,将熊果酸纸片贴于 M-H 平板上,以无菌水作为空白对照,置于37 ℃培养箱 16~24 h,测量抑菌圈直径。
1.2.8.2 MIC 测定 采用无菌MH肉汤培养基制备稀释系列,用对倍稀释法进行测定。将山茱萸熊果酸配制成100、50、25、12.5、6.25、3.125 mg/mL药液,以不加药液为阳性对照,各试管的菌液接种量均为2×106CFU/mL,同时设置不加药液、不接种菌的为阴性对照,37 ℃培养 24 h,取出观察,以浓度低而无肉眼可见菌生长的一管浓度为山茱萸熊果酸对该菌的MIC[35]。
1.3 数据处理
所有实验均平行进行三次,实验数据以Excel 2013进行作图和统计分析,正交试验以正交设计助手II V3.1进行实验设计和数据的统计分析。
2 结果与讨论
2.1 单因素实验
2.1.1 超声浸提时间对熊果酸得率的影响 由图1可知,随着超声浸提时间的增加,熊果酸得率呈现出先上升后下降的趋势。当浸提时间为25 min时,得率最大。随着时间的延长,进入到溶剂中的熊果酸分子增多,但熊果酸与周围溶剂之间存在传质平衡,当平衡达到之后,再增加时间,由于其他杂质的不断溶出,反而对熊果酸的溶解产生了影响,导致熊果酸得率在25 min后呈下降趋势[29]。故选择浸提时间为25 min。

图1 提取时间对山茱萸熊果酸提取得率的影响Fig.1 The effect of extraction time on the yield ofursolic acid from Cornus officinalis
2.1.2 乙醇浓度对熊果酸得率的影响 由图2可知,随着乙醇浓度的增加,熊果酸的提取得率增加,当乙醇浓度为50%时,达到最大值,再增加乙醇浓度,熊果酸得率反而下降。由相似相溶原理可知,当溶剂极性与熊果酸的极性相近时,熊果酸易于溶解。50%乙醇溶液的极性与熊果酸较为接近,而乙醇浓度减小或增大时都会导致极性相差变大,所以得率较低[29]。故选择乙醇浓度为50%。
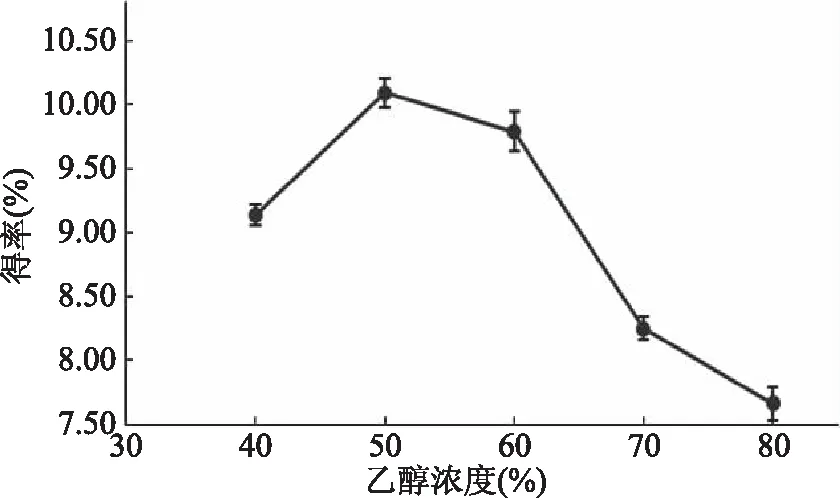
图2 乙醇浓度对山茱萸熊果酸提取得率的影响Fig.2 The effect of alcohol concentration on theyield of ursolic acid from Cornus officinalis
2.1.3 超声功率对熊果酸得率的影响 图3显示,随着功率的增大,山茱萸中熊果酸的得率起初迅速上升,达到200 W时,得率达到最大,之后反而呈下降的趋势。功率超过200 W时,由于细胞破碎程度过高,导致原本扩散较慢的其他成分分子扩散速率大幅提高,影响了熊果酸分子本身的扩散速率,反而不利于熊果酸的提取。因此功率过大时得率反而下降。故选择功率为200 W。
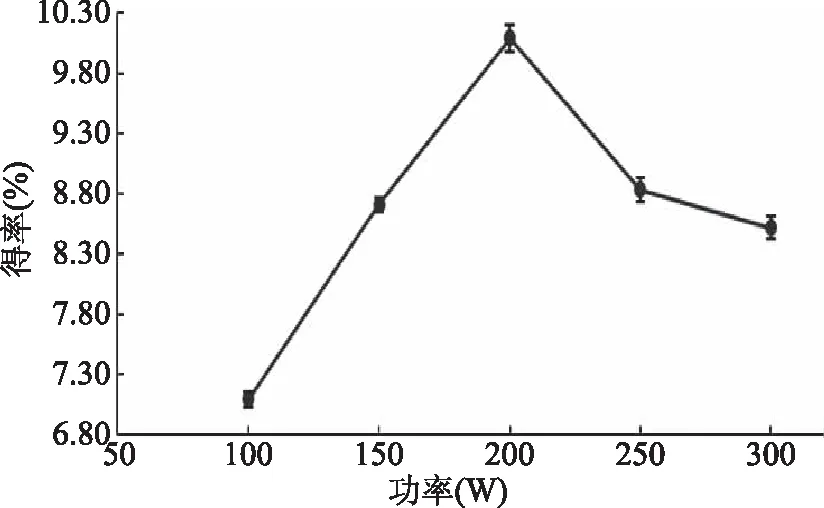
图3 超声功率对山茱萸熊果酸提取得率的影响Fig.3 The effect of ultrasonic power on theyield of ursolic acid from Cornus officinalis
2.1.4 温度对熊果酸得率的影响 由图4可知,得率随着温度的增大呈现出先上升后下降的趋势。在温度为40 ℃时得率最大。当温度较低时,分子扩散速度较慢,进入溶剂中的熊果酸分子较少,随着温度升高,分子运动加快,使得溶剂中熊果酸溶解增多。但温度过高时,部分多糖和蛋白质物质开始大量溶出,对熊果酸的溶解产生了抑制作用,导致得率降低。故选择提取温度为40 ℃。

图4 温度对山茱萸熊果酸提取得率的影响Fig.4 The effect of extraction temperature on theyield of ursolic acid from Cornus officinalis
2.1.5 料液比对熊果酸得率的影响 图5显示熊果酸得率随料液比的变化趋势。当料液比由1∶15 (g/mL)变为1∶25 (g/mL)的过程中,随着料液比的增加,扩散进入溶剂的熊果酸分子不断增多,得率逐渐升高,在1∶25 (g/mL)时达到峰值;而料液比高于1∶25 (g/mL)后,其他杂质的溶出增多,影响熊果酸分子的溶出程度,得率呈现出下降的趋势。故选择料液比为1∶25 (g/mL)。

图5 料液比对山茱萸熊果酸提取得率的影响Fig.5 The effect of ratio of solid to liquid on theyield of ursolic acid from Cornus officinalis
2.1.6 工作/间歇时间比对熊果酸得率的影响 由图6可知,熊果酸得率随着超声工作/间歇时间比的增大呈现出先增大后减小的趋势。超声细胞破碎的过程中会释放出能量使得体系温度升高。当间歇时间过短时,体系温度来不及降低,不利于条件控制;同时,由于连续工作时间过长,超声导致的分子碰撞作用力可能破坏熊果酸的物质结构,反而使得总的得率下降[36]。而间歇时间过长时,实际工作的时间相对来说又缩短,导致得率都会受到影响。故选择超声工作/间歇时间比为7 s/5 s。

图6 工作间歇时间比对山茱萸熊果酸提取得率的影响Fig.6 The effect of the ratio of treatment to intermissionon the yield of ursolic acid from Cornus officinalis
2.1.7 浸提次数对熊果酸得率的影响 由图7可知,随着浸提次数的增加,熊果酸得率增加。当提取次数为2次时,得率增加较大,继续增加提取次数,得率虽然仍呈现出增大的趋势,但增幅不明显。故综合考虑成本及操作的简便,选取浸提次数为2次。
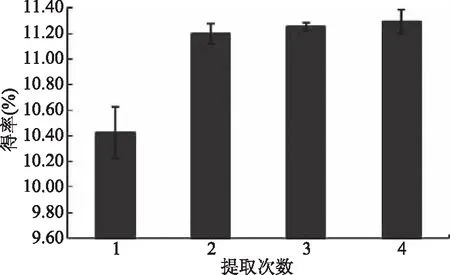
图7 浸提次数对山茱萸熊果酸提取得率的影响Fig.7 The effect of extraction times on theyield of ursolic acid from Cornus officinalis
2.2 山茱萸中熊果酸提取的正交试验
依据单因素实验的结果,选取影响较大的超声时间、乙醇浓度、超声功率、超声工作/间歇时间比这四个因素,选取不同的实验水平,设计正交试验进一步找出最佳的熊果酸提取工艺。正交试验结果如表2所示。

表2 正交试验结果Table 2 Results of orthogonal experiment
由表2可知,这四种因素对熊果酸提取的影响大小排序为:超声时间>超声工作/间歇时间比>超声功率>乙醇浓度。通过表3可知,超声时间和超声工作/间歇时间比这两个因素具有显著性,说明其对采用超声辅助法从山茱萸中提取熊果酸的影响较大,起到主要的作用。正交优化所得到的最佳提取条件组合为A2B2C3D3,即提取时间为25 min,乙醇浓度为50%,超声功率为225 W,超声工作/间歇时间比为8 s/5 s。为验证正交设计试验的结果,在此最优条件下进行3次平行试验,得率平均值达到13.16%。
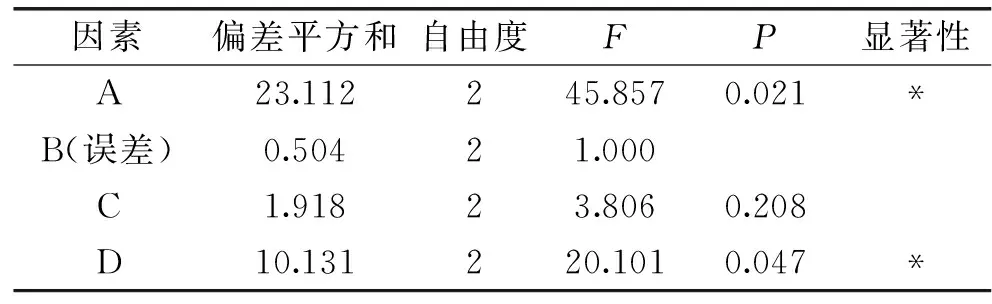
表3 方差分析Table 3 Variance analysis
由最佳工艺得到提取物按照1.2.6进行提纯,所得山茱萸熊果酸的纯度达78%,用于活性测定。
2.3 山茱萸熊果酸抗氧化活性
2.3.1 山茱萸熊果酸还原能力测定 还原能力是评价物质抗氧化活性的重要指标[30]。由图8可知,山茱萸熊果酸具有明显的还原能力,但在相同浓度下山茱萸熊果酸还原能力要弱于VC,并且0.04 mg/mL山茱萸熊果酸的还原能力与0.01 mg/mL的VC相当。

图8 山茱萸熊果酸的还原能力Fig.8 Reducing powers of ursolic acid from Cornus officinalis
2.3.2 山茱萸熊果酸对DPPH·清除能力 由图9可知,山茱萸熊果酸和VC对DPPH·都具有明显的清除能力。当浓度从0.01 mg/mL上升至0.06 mg/mL时,山茱萸熊果酸对DPPH·的清除率随着浓度增加而逐渐增大;当浓度大于0.06 mg/mL时,茱萸熊果酸对DPPH·的清除率变化幅度较小,清除率与VC接近。当山茱萸熊果酸的浓度为0.1 mg/mL时,清除率最大为88.1%。
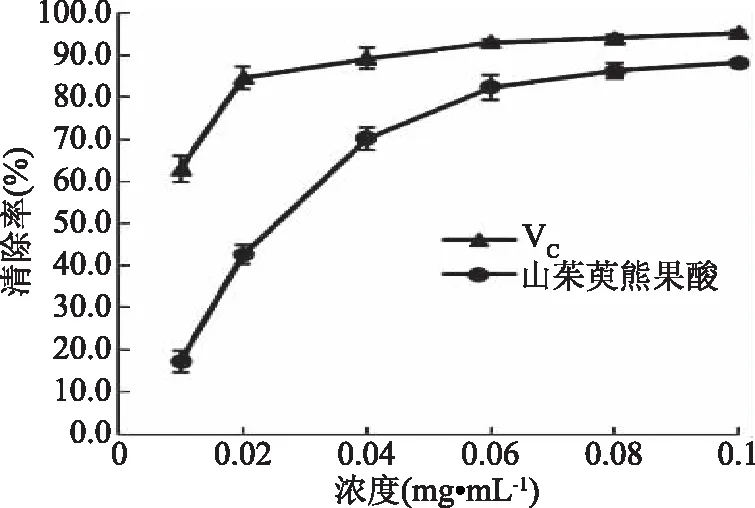
图9 山茱萸熊果酸对DPPH·的清除能力Fig.9 Scavenging effects of ursolic acidfrom Cornus officinalis on DPPH·
2.3.3 山茱萸熊果酸对·OH清除能力 由图10可知,山茱萸熊果酸对·OH具有明显的清除能力。相同浓度下,山茱萸熊果酸对·OH的清除能力要小于VC。在0.01~0.04和0.06~0.1 mg/mL两个浓度范围内,山茱萸熊果酸对·OH的清除率与浓度基本呈线性关系变化。当山茱萸熊果酸的浓度为 0.1 mg/mL时,对·OH清除率最大为68.6%。

图10 山茱萸熊果酸对·OH的清除能力Fig.10 Scavenging effects of ursolic acidfrom Cornus officinalis on hydroxyl
2.3.4 山茱萸熊果酸猪油抗氧化性试验 由图11可知,山茱萸熊果酸和VC对猪油都有抗氧化作用。随着山茱萸熊果酸使用量的增加,对猪油的抗氧化能力增强;当山茱萸熊果酸的添加量达到0.75%时,对猪油的抗氧化能力,与添加浓度为0.25%的VC接近。
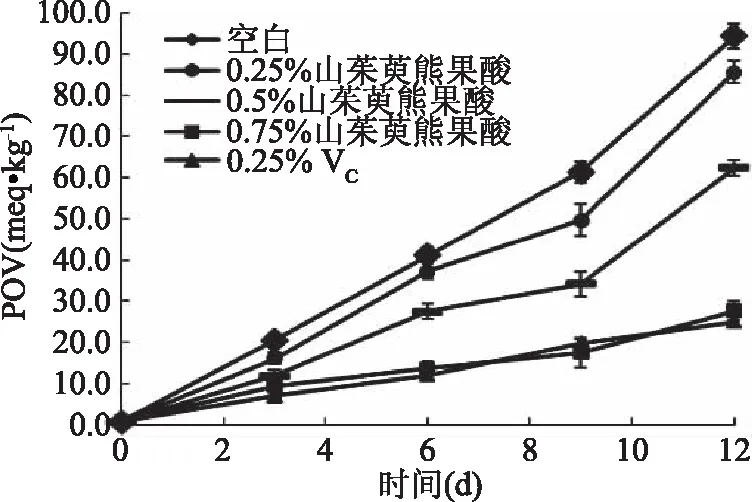
图11 山茱萸熊果酸对猪油的抗氧化效果Fig.11 Antioxidant effect of ursolic acidfrom Cornus officinalis lard
综上所述,在不同方法的抗氧化实验中,山茱萸熊果酸均体现出了抗氧化活性,由于山茱萸熊果酸对不同自由基的清除机制各有不同,其抗氧化指标也表现不同。因此,需要结合多种方法来对其抗氧化能力进行综合评价。
2.4 山茱萸抑菌活性实验
2.4.1 山茱萸中熊果酸对5种标准菌株药敏试验 由表4可知,山茱萸熊果酸对食品领域常见的金黄色葡萄球菌、大肠杆菌、变形杆菌、枯草杆菌和黑曲霉菌均有抑制作用,对5种菌的抑菌能力大小为:大肠杆菌>金黄色葡萄球菌>枯草杆菌>变形杆菌>黑曲霉菌。

表4 山茱萸熊果酸抑菌直径Table 4 Inhibitory zone diameters of ursolic acidfrom Cornus officinali against different microorganisms
2.4.2 山茱萸中熊果酸对各种试验菌株的MIC测定 由表5可见,对不同菌,山茱萸熊果酸达到一定浓度才显示出抑菌活性。山茱萸熊果酸对大肠杆菌的MIC为6.25 mg/mL,对金黄色葡萄球菌和枯草杆菌的MIC为12.5 mg/mL,对变形杆菌、黑曲霉菌的MIC为25 mg/mL。
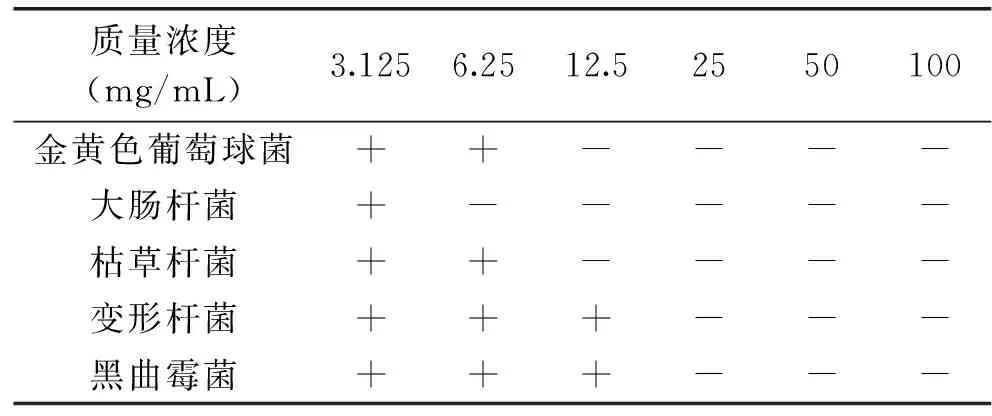
表5 熊果酸对标准菌株的MIC值Table 5 MIC of ursolic acid fromCornus officinalis against different strains
3 结论
采用单因素实验,对各因素对熊果酸得率的影响趋势进行了研究,然后在单因素实验的基础上,选取出四种主要因素,通过设计正交试验进一步优化得到山茱萸中熊果酸提取的最佳工艺条件。结果表明:几种因素对提取的影响大小排序为超声时间>超声工作/间歇时间比>超声功率>乙醇浓度,最佳的提取工艺条件为:提取时间25 min,乙醇浓度50%,超声功率225 W,超声工作/间歇时间比8 s/5 s,提取次数2次,温度40 ℃,料液比1∶25 (g/mL)。在此优化条件下进行验证试验,测定平均得率可达13.16%。
山茱萸熊果酸具有明显的抗氧化能力:山茱萸熊果酸对DPPH·和·OH都具有明显的清除能力,0.04 mg/mL山茱萸熊果酸的还原能力与0.01 mg/mL的VC相当;浓度大于0.06 mg/mL时,茱萸熊果酸对DPPH·的清除率与VC接近,当浓度为 0.1 mg/mL时,对DPPH·清除率最大为88.1%;在0.01~0.04和0.06~0.1 mg/mL两个浓度范围内,山茱萸熊果酸对·OH的清除率与浓度基本呈线性关系,当浓度为 0.1 mg/mL时,清除率最大为68.6%;山茱萸熊果酸对猪油有抗氧化作用,当山茱萸熊果酸的添加量达到0.75%时,对猪油的抗氧化能力,与添加浓度为0.25%的VC接近。
山茱萸熊果酸具有较强的抑菌作用,5种菌的抑菌能力大小为:大肠杆菌>金黄色葡萄球菌>枯草杆菌>变形杆菌>黑曲霉菌;对大肠杆菌的MIC为6.25 mg/mL,对金黄色葡萄球菌和枯草杆菌的MIC为12.5 mg/mL,对变形杆菌、黑曲霉菌的MIC为 25 mg/mL。

