云南小粒咖啡果皮中果胶的提取及其水解物抑菌活性研究
李晓娇,付文相,杨丽华,侯洪波,宋志姣
(保山学院资源环境学院,云南保山 678000)
咖啡属茜草科(Rubiaceae)咖啡属(Coffea)多年生常绿灌木或小乔木,原产于非洲埃塞俄比亚,其中以小粒种(Coffeaarabica)、中粒种(C.canephora)和大粒种(C.liberica)咖啡栽培较多[1]。我国的咖啡主产区在云南,其中小粒咖啡的产量占全国98.80%,因其独特的气候条件,所产的小粒咖啡品质优异,云南省中以普洱市、保山市、临沧市和德宏州为主要种植区[2]。咖啡加工过程中会产生大量的咖啡果皮[3],Emaille等[4]和Saenger等[5]的研究报道表明,干法加工每生产1 t咖啡豆,大约会产生1 t的咖啡果皮,而在湿法加工产生咖啡果皮的量可达到2 t以上。大量的咖啡果皮通常会被丢弃,或用作堆肥,不仅资源浪费,而且在一定程度上污染环境[6]。
果胶是由α-1,4糖苷键连接半乳糖醛酸与鼠李糖、阿拉伯糖等中性糖聚合而成的杂多糖,主要是由原果胶、果胶酯酸和果胶酸组成[7],具有良好的生理和药理活性,如抑癌、降糖、降脂和调节机体免疫等作用[8-9]。果胶经果胶酶降解成的低聚物具有明显的抑菌活性,可作为一种新型的天然抑菌剂[10-11],柚皮果胶的水解和抑菌研究结果表明,其对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌有明显的抑菌和杀菌效果[12]。常见的果胶提取方法主要有酸法、超声波、微波辅助法、碱法、酶法、盐提法和离子交换法等[13]。其中酸法是工业中使用最广泛的果胶提取方法,其优点是成本较低,得率稳定,反应条件容易控制。目前,国内外对小粒咖啡果渣资源利用的研究主要集中在提取咖啡因、土壤调节剂、作为燃料、饲料、重金属的生物吸附剂和硬质纤维板的原料等方面[14-17],而从小粒咖啡果皮中提取果胶还未见报道。市场上的商品果胶主要提取自柠檬、苹果、柑桔,对小粒咖啡果皮果胶的提取研究还比较少,也无小粒咖啡果皮果胶水解物的抑菌活性研究的相关报道。
考虑到提取成本,以及后期果胶的中试生产的研究,本文采用酸法对小粒咖啡果皮果胶进行提取。以云南保山小粒咖啡果皮为原料,以果胶得率为指标,在单因素实验基础上通过正交试验优化小粒咖啡果皮果胶的提取工艺,并测定其半乳糖醛酸含量、干燥失重、总灰分、pH、酯化度等理化性质及对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑制作用,以期为小粒咖啡果皮果胶的开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
小粒咖啡果皮 云南保山老基地咖啡有限公司提供;无水乙醇、浓盐酸、浓硫酸 均为分析纯,重庆川东化工有限公司;半乳糖醛酸、咔唑、柠檬酸 均为分析纯,国药集团化学试剂有限公司;磷酸氢二钠 分析纯,成都化学试剂厂;果胶酶(酶活力≥500000 U/g)成都科隆化学品有限公司;牛肉膏、蛋白胨 北京奥博星生物技术有限公司;氯化钠 分析纯,南汇彭镇营房化工厂;琼脂条 福建省石狮市环球琼胶工业有限公司;商品果胶 进口分装,Sigma;供试菌种:大肠杆菌Escherichiacoli(标准菌株ATCC25922)、金黄色葡萄球菌Staphyloccocusaureus(标准菌株ATCC259226538)、枯草芽孢杆菌Bacillussubtilis(标准菌株ATCC6633) 均购自广东省微生物菌种保藏中心。
UV5100紫外-可见分光光度计 上海菁华科技仪器有限公司;FE20 pH酸度计 梅特勒-托利多仪器(上海)有限公司;NDJ-85旋转粘度计 上海昌吉质地仪器有限公司;HZQ-X100A恒温培养振荡器、DZF-602真空干燥箱 上海一恒科学仪器有限公司;LDZX--75KB立式压力蒸汽灭菌器 上海申安医疗器械厂。
1.2 实验方法
1.2.1 小粒咖啡果皮预处理 小粒咖啡果皮(湿法加工),60 ℃下烘干至恒重后粉碎,过20目筛,于干燥器中保存备用。
1.2.2 小粒咖啡果皮中果胶的提取与鉴别
1.2.2.1 小粒咖啡果皮中果胶的提取 称取10.00 g粉碎后的小粒咖啡果皮于250 mL锥形瓶中,加适量蒸馏水,在90~100 ℃下煮沸5 min。趁热过滤,滤渣用80%的乙醇洗涤3次,每次洗涤5 min(除去色素、糖酸等),洗涤完后于80 ℃烘箱中烘干。然后置于250 mL锥形瓶中,按一定料液比加入一定浓度的稀盐酸溶液,在50 ℃下提取60 min,提取结束后冷却、抽滤,滤液浓缩至50 mL,快速用冰水冷却后加入1.5倍体积的无水乙醇进行醇析,减压过滤,滤出物用一倍量的75%酒精洗涤,除去醇溶性杂质。4000 r/min离心5 min分离,滤渣于40 ℃下真空干燥至恒重,得果胶固体,称重计算得率。
1.2.2.2 果胶的鉴别实验 根据国标GB 25533-2010方法对所提取的小粒咖啡果皮果胶做验证试验。准确称取1 g小粒咖啡果皮果胶,加入40 mL蒸馏水,不断搅拌,看是否形成凝胶或稠状液体。用移液管移取5 mL该粘稠状溶液于25 mL试管中,加入1 mL氢氧化钠(1.25 mol/L)溶液,静置20 min,看是否出现半透明或不透明的凝胶沉淀。同时测定小粒咖啡果皮果胶的红外光谱,并与商品标准果胶的红外光谱进行对比分析,鉴别提取物。
1.2.3 单因素实验
1.2.3.1 料液比对果胶得率的影响 在提取温度50 ℃、提取时间为60 min、提取液pH为1.5的条件下,考察不同料液比(1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)对果胶得率的影响。
1.2.3.2 提取液pH对果胶得率的影响 在料液比1∶25 g/mL、提取温度为50 ℃、提时间为60 min的条件下,考察提取液不同pH(1.0、1.5、2.0、2.5、3)对果胶得率的影响。
1.2.3.3 提取温度对果胶得率的影响 在料液比1∶25 g/mL、提取时间为60 min、提取液pH为1.5的条件下,考察不同提取温度(30、40、50、60、70 ℃)对果胶得率的影响。
1.2.3.4 提取时间对果胶得率的影响 在料液比1∶25 g/mL、提取温度为50 ℃、提取液pH为1.5的条件下,考察不同提取时间(40、60、80、100、120 min)对果胶得率的影响。
1.2.4 正交试验 根据单因素实验结果,以半乳糖醛酸含量为指标,选取料液比(A)、提取液pH(B)、提取温度(C)、提取时间(D)四个单因素进行L9(34)正交试验,试验因素水平表见表1。

表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal experiment
1.2.5 果胶得率计算 采用重量法[18]测定小粒咖啡果皮果胶得率。
果胶得率(%)=m/m0×100
式中:m为提取的小粒咖啡果皮果胶质量,g;m0为小粒咖啡果皮质量,g。
1.2.6 小粒咖啡果皮果胶理化性质的测定 小粒咖啡果皮果胶的理化性质测定参照GB 5009.3-2016(干燥失重)、GB 25533-2010(酯化度、感官指标)、GB 5009.4-2016(灰分测定)、半乳糖醛酸含量采用采用咔唑硫酸法[19],pH、酸不溶灰分等理化指标检测均按果胶国家标准GB 2484-2000来进行。
1.2.7 小粒咖啡果皮果胶热稳定性的测定 按1.2.2的方法,提取条件为:料液比为1∶30 g/mL,pH1.5,提取温度70 ℃,提取时间100 min,提取小粒咖啡果皮果胶,并配制100 mL 1%的果胶溶液,置于95 ℃的烘箱内,分别干燥0、2、4、6、8、10 min后取出样品,冷却至室温后,测定其相对粘度[20-21]。
1.2.8 培养基制作及菌种活化培养
1.2.8.1 固体培养基 称取牛肉膏6.0 g、蛋白胨20.0 g、氯化钠10.0 g、琼脂30.0~40.0 g配置2000 mL pH7.4~7.6的培养基。121 ℃、0.1 MPa高压蒸汽灭菌30 min。灭菌后于超净工作台中向培养皿中倒入约25 mL培养基,冷却后倒置培养皿,备用。
1.2.8.2 液体培养基 称取牛肉膏0.9 g、蛋白胨3.0 g、氯化钠1.5 g以蒸馏水配置300 mL pH7.4~7.6的液体培养基。分三份加入三个锥形瓶中,121 ℃、0.1 MPa高压蒸汽灭菌30 min,备用。
1.2.8.3 菌种活化培养 菌种活化:无菌环境,接种环划线将供试菌种接种于固体培养基内,37 ℃培养72 h。菌种培养:配制液体培养基,高压灭菌处理冷却后接种大肠杆菌和枯草芽孢杆菌,放置于培养箱中37 ℃培养20 h,使菌种浓度达到106~107CFU/mL,即紫外分光光度计最大吸收波长600 nm处测定吸光度在1.4~1.5左右。若吸光度低于1.4,则继续培养至适宜浓度。若吸光度大于1.5,则需加适量无菌生理盐水稀释[22]。
1.2.9 小粒咖啡果皮果胶水解物抑菌活性测定
1.2.9.1 不同水解时间果胶水解物的制备 配制0.2 mol/L磷酸氢二钠500 mL,0.1 mol/L柠檬酸溶液500 mL,并制备磷酸氢二钠-柠檬酸缓冲溶液(pH=4.4)。称取8.0 g果胶,缓冲液溶解并定容至500 mL,得果胶液。加入0.8 g果胶酶于500 mL果胶液中,混匀后将该混合液置于50 ℃水浴中进行水解,分别于反应0、30、60、90、120、150、180、210、240 min时取样50 ml,迅速将其于沸水中加热10 min灭酶,冷却后3500 r/min离心5 min,将上清液浓缩至原体积的1/2,冷藏备用[23]。
1.2.9.2 不同水解时间果胶水解物抑菌效果采用滤纸片法[24],测定抑菌圈大小,表征抑菌效果。于无菌操作台内,移取150 μL浓度为106~107CFU/mL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的菌悬液,均匀涂布在固体培养基上。取6 mm滤纸片三片,分别移取5 μL不同水解时间的果胶水解物滴于滤纸片上均匀润湿,平铺于培养基上,放于培养箱中37 ℃培养24 h并做空白对照。观察有无抑菌圈,用游标卡尺十字交叉法测定抑菌圈直径。实验平行重复三次,比较抑菌效果,通过抑菌圈大小确定最佳水解时间。
1.2.9.3 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定 采用二倍稀释法测定具有最大抑菌圈直径水解物的MIC和MBC。第1~7管的样品质量浓度分别为16、8、4、2、1、0.5 g/L。吸取1 mL大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的菌悬液(106~107CFU/mL),将各试管置于37 ℃下培养24 h,观察细菌生长情况,以完全无菌生长的浓度为其MIC。分别从样品浓度不低于MIC的各试管中取1 mL培养液于营养琼脂平板上,涂布均匀后于37 ℃下继续培养24 h,观察细菌生长情况。以仍无菌生长或菌落总数小于5的浓度为样品的MBC,同时以相同浓度的山梨酸钾作对照实验[17]。试验重复3次。
1.3 数据处理
采用Origin 9.5软件作图,SPSS 22.0软件进行方差分析。
2 结果与分析
2.1 小粒咖啡果皮果胶的鉴别实验
2.1.1 表观特征鉴别实验 小粒咖啡果皮果胶中加蒸馏水得到粘稠状液体,然后加氢氧化钠出现了半透明的凝胶沉淀。该鉴别实验说明小粒咖啡果皮果胶符合果胶的表观特征。
2.1.2 小粒咖啡果胶的红外光谱分析 小粒咖啡果皮果胶的红外光谱如图1所示,小粒咖啡果皮果胶在3580~3100 cm-1出现一个来自-OH伸缩振动的宽峰,该区域的形成主要是由于分子间和分子内半乳糖醛酸聚合物的氢键作用[25]。在2920 cm-1附近出现的尖锐的吸收峰是烷基的伸缩振动,1732和1261 cm-1是酯化的羧基(-COOR)和羧基(COO-)中羰基的吸收峰,1048 cm-1是糖苷键(C-O-C)的弯曲振动峰,1200~1000 cm-1的强吸收峰是果胶分子的指纹区,对比商品果胶的红外光谱图[26],两者红外光谱图相似,并结合果胶表观特征和表4中半乳糖醛酸的含量已达到国家标准,可以确定小粒咖啡果皮提取物为果胶。

表4 云南小粒咖啡果皮果胶的理化性质Table 4 Physicochemical property of pectin from Coffea arabica pericarp
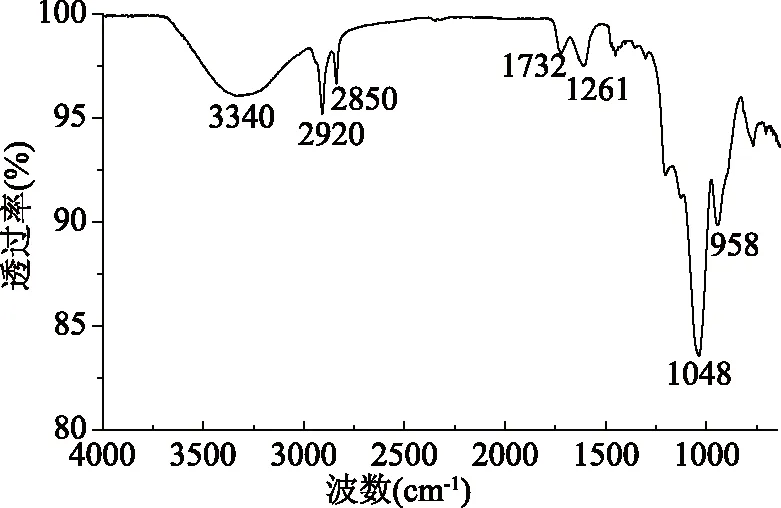
图1 小粒咖啡果皮果胶红外光谱图Fig.1 FT-IR spectroscopy of pectinfrom Coffea arabica pericarp
2.2 单因素实验
2.2.1 料液比对得率的影响 由图2可见,随着提取剂用量的增大,果胶得率先增加后下降。当料液比为1∶15和1∶20 g/mL时,果胶得率较低,可能因为溶剂量少,使得物料粘度大,且浓度梯度小,扩散速度慢,原料中的果胶难以大量转移到提取液中,使得提取不完全,产率低且过滤困难[27]。当料液比为1∶30 g/mL时果胶得率最高为10.05%。继续增加提取剂用量,则醇析消耗的乙醇量增大,浓缩时间增长、能耗增加,考虑到成本和后续浓缩环节[28],料液比应控制在1∶30 g/mL为宜。通过单因素方差分析,当料液比范围在1∶15~1∶20 g/mL和1∶25~1∶35 g/mL时,料液比对果胶得率影响不显著(P>0.05),但两段料液比对果胶得率存在显著差异(P<0.05)。
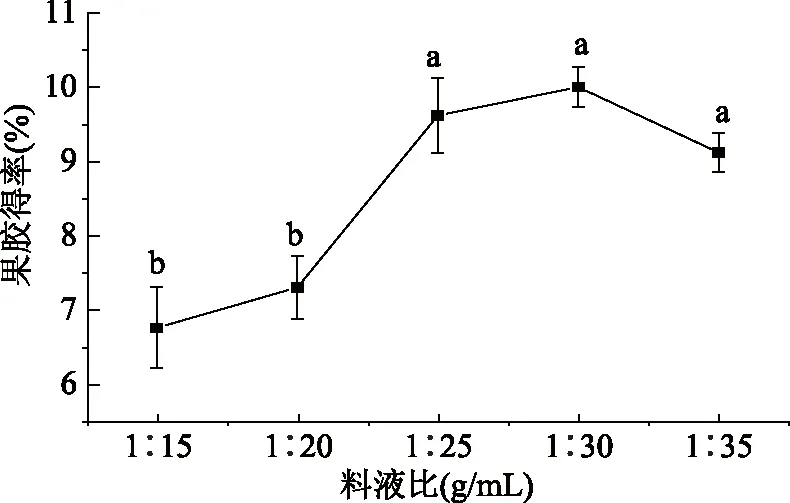
图2 料液比对果胶得率的影响Fig.2 The effect of material liquid ratioon extraction rate of pectin注:不同字母表示差异显著(P<0.05),图3~图5同。
2.2.2 提取液pH对得率的影响 由图3可知,随着pH的升高,果胶得率先增加后降低。当提取液pH为1时,果胶得率较低,这可能是因为当提取液的pH过低时,提取液的极性较强,果胶分子的甙键和酯键断裂,果胶会发生解聚[29],且pH越低,溶液颜色越趋于红褐色,影响果胶产品颜色。当提取液pH为1.5时,果胶会逐渐转化为水溶性果胶,果胶得率最高为9.56%。当pH进一步增加时,果胶可能会转化为果胶酸[30],得率降低。因此,选择提取液pH为1.5为宜。通过单因素方差分析,除pH为1.0和2.0、2.5和3.0时果胶得率差异不显著(P>0.05),其余不同pH下果胶得率均存在显著性差异(P<0.05)。
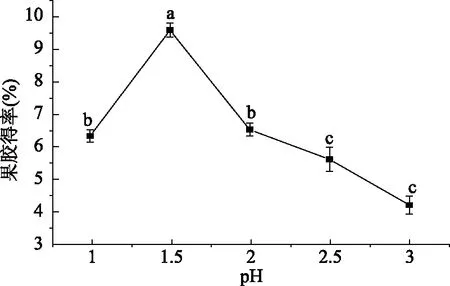
图3 提取液pH对果胶得率的影响Fig.3 The effect of pH on extraction rate of pectin
2.2.3 提取温度对得率的影响 由图4可知,随着提取温度的上升,果胶得率也迅速增加,当提取温度达到50 ℃,得率最高为10.18%,显著高于其它提取温度(P<0.05)。由于原果胶水解为水溶性果胶需要在一定的温度下才能进行,温度太低,只有部分原果胶转化为果胶,水解不完全,得率较低。当提取温度过高时,由于果胶的耐热性较差,会使生成的果胶因为水解程度剧烈而进一步降解成果胶酸,导致得率下降[30]。因此,选择提取温度50 ℃为宜。
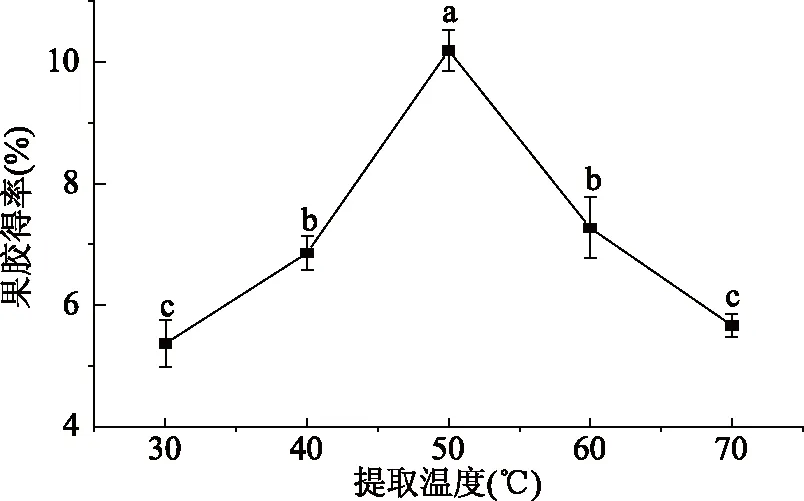
图4 提取温度对果胶得率的影响Fig.4 The effect of temperature on extraction rate of pectin
2.2.4 提取时间对得率的影响 由图5可知,果胶得率随提取时间的增加出现先升高后降低的趋势。提取时间为100 min时,果胶得率最高为12.75%,显著高于其它提取时间(P<0.05),随着提取时间的延长,小粒咖啡果皮中的果胶得到充分水解,果胶得率也迅速升高。当提取时间过长时,则会造成果胶分子链发生热降解反应,致使果胶产率下降,且在酸性条件下放置太长时间也会造成酸性降解[31-32],所以100 min是最适宜提取时间。考虑到提取时间过长,耗能增多,果胶在酸性溶液中时间过长会部分分解,所以选择60、80、100 min进行正交试验。
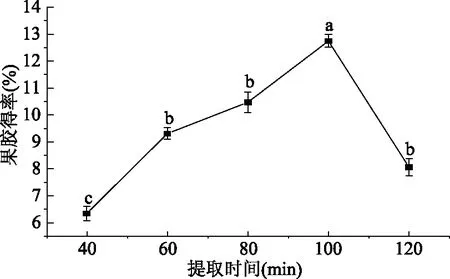
图5 提取时间对果胶得率的影响Fig.5 The effect of extraction time on extraction rate of pectin
2.3 正交试验结果
正交试验结果如表2所示。采用酸法提取小粒咖啡果皮中的果胶,对得率影响的大小顺序为:提取温度(C)>提取液pH(B)>提取时间(D)>料液比(A),最佳提取工艺为:A2B2C3D3,即料液比为1∶30 g/mL,pH为1.5,提取温度60 ℃,提取时间为100 min。并在该工艺条件下,进行3组平行试验,果胶的平均得率为15.13%。
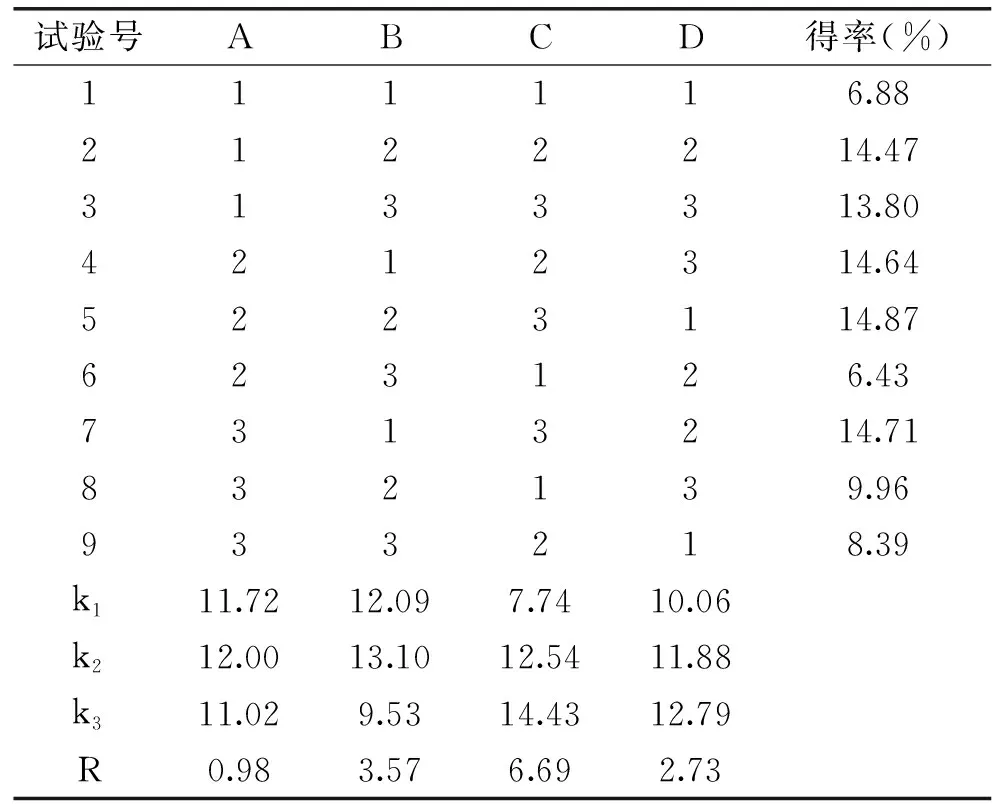
表2 正交试验结果Table 2 Orthogonal test results
表3表明,提取温度(C)、提取液pH(B)和提取时间(D)对小粒咖啡果皮果胶的得率影响极显著(P<0.01),而料液比(A)对小粒咖啡果皮果胶的得率影响显著(P<0.05)。因素对得率影响的大小顺序为:C>B>D>A,与极差分析结果一致。
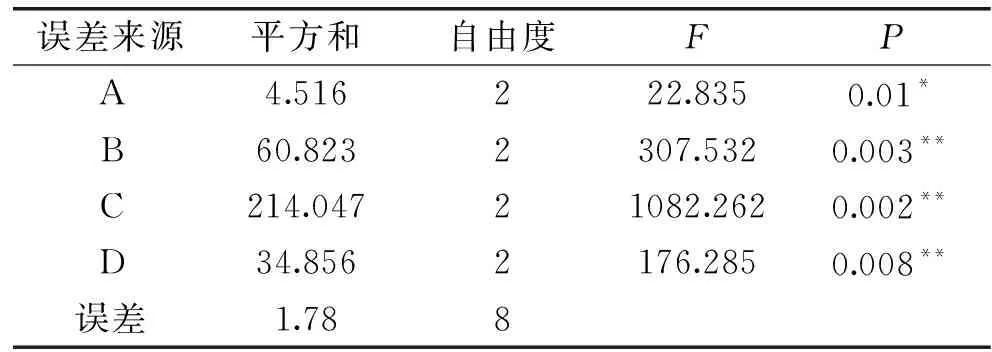
表3 方差分析Table 3 Analysis of variance
2.4 小粒咖啡果皮果胶理化性质
如表4所示,通过测定发现,小粒咖啡果皮果胶中半乳糖醛酸的含量为67.71%,均符合GB 25533-2010和QB-2482-2000标准要求。干燥失重为10.17%、总灰分22.75%、pH2.61均达到GB 25533-2010和QB-2482-2000相应的要求。酯化度在50%~75%的范围内,属于高酯果胶。酸不溶性灰分为1.57%,超过国家标准范围(≤1),由于小粒咖啡果皮果胶为天然提取物,因此无机营养元素含量相对较高。
2.5 小粒咖啡果皮果胶热稳定性
本实验在60 ℃下提取小粒咖啡果皮中的果胶,其半乳糖醛酸的含量为67.71%,达到了国家标准,可见在60 ℃下小粒咖啡果皮果胶是稳定的,但由于醇析后需要对果胶进行干燥处理,因此需考虑干燥时间对果胶稳定性的影响。由图6可知,随着干燥时间的增加,小粒咖啡果皮果胶粘度呈下降趋势。在干燥初始的0~4 min内,咖啡果胶粘度极速下降,在4 min后下降趋势稍缓,这可能是由于在干燥初始时,果胶链间原本存在的交联作用而产生的聚合物被热力作用迅速破坏,故而使其粘度下降明显。随着时间的延长(4~10 min),因为果胶分子内部的作用力早已破坏,其粘度下降趋势较为缓慢[33]。因此,本实验采用了真空干燥(40 ℃)小粒咖啡果皮果胶,以确保在干燥过程中果胶的稳定性。
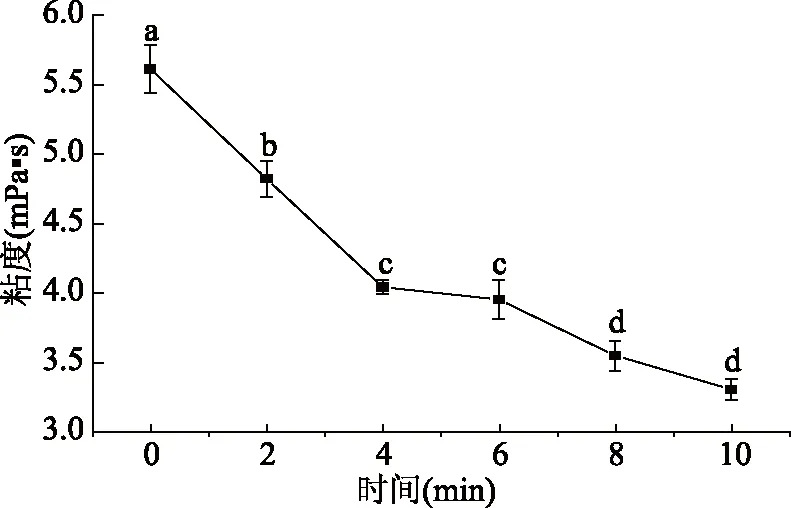
图6 干燥时间对咖啡果皮果胶粘度的影响Fig.6 The effect of drying timeon pectin viscosity of coffee pericarp
2.6 小粒咖啡果皮果胶水解物抑菌活性
2.6.1 不同水解时间对果胶水解物抑菌活性的影响 如表5所示,在咖啡果皮果胶未水解时,就有一定的抑菌活性,在0~180 min内,果胶水解物的抑菌效果随时间延长而提高,进一步延长水解时间,果胶水解物的抑菌活性开始降低。这可能是因为一定条件下,大分子的果胶水解生成小分子低聚半乳糖醛酸,低聚半乳糖醛酸具有抗菌作用,但随着水解时间进一步延长,低聚半乳糖醛酸水解生成D-半乳糖醛酸,宁恩创等[16]、马庆一等[15]、李学红等[23]也发现果胶的酶解最终产物和酸解产物均无抑菌活性,因此随着水解时间的继续延长,抑菌活性降低,故抑制大肠杆菌、草芽孢杆菌、黄色葡萄球菌的最佳水解时间分别为180、150、150 min。在最佳水解时间下水解咖啡果皮果胶,测定其对三种菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)。
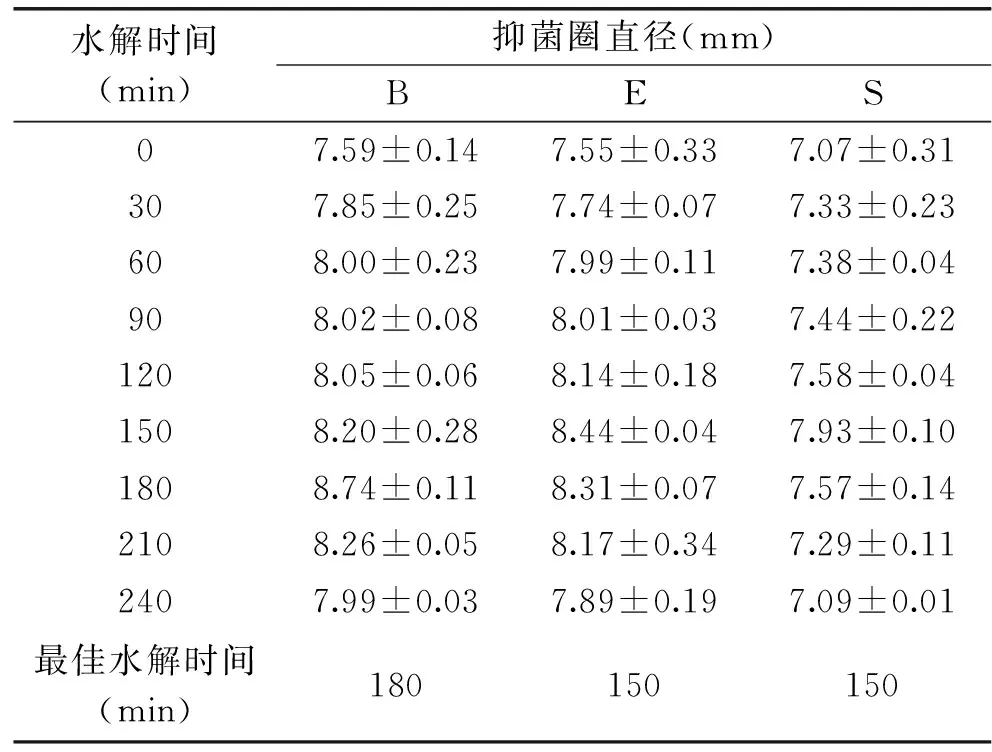
表5 不同水解时间对咖啡果皮果胶水解物抑菌活性影响Table 5 Effect of different hydrolysis time on bacteriostaticactivity of pectin hydrolysate from coffee pericarp
2.6.2 果胶水解物的最低抑菌浓度(MIC) 表6所示,咖啡果皮果胶水解物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的MIC分别为8、4、8 g/L,而对照山梨酸钾对三种菌的MIC分别为:2、4、4 g/L,可见,咖啡果皮果胶水解物对大肠杆菌和金黄色葡萄球菌的抑菌活性不如山梨酸钾,但对枯草芽孢杆菌的抑菌活性与山梨酸钾相当。
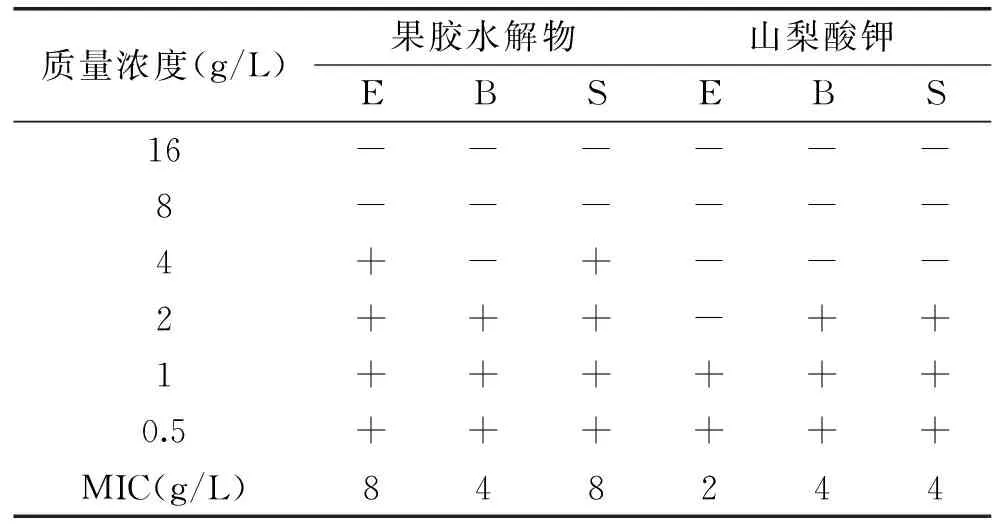
表6 咖啡果皮果胶水解物对三种菌的MICTable 6 MIC of pectin hydrolysatefrom coffee pericarp to three bacterias
2.6.3 果胶水解物的最低杀菌浓度(MBC) 如表7所示,小粒咖啡果皮果胶水解物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的MBC分别为16、8、16 g/L。对照组山梨酸钾为4、8、8 g/L。结果表明,在浓度较高时果胶的水解物对三种供试菌具有杀菌作用,且对枯草芽孢杆菌的杀菌作用与山梨酸钾相当,但对大肠杆菌和金黄色葡萄球菌的杀菌作用低于山梨酸钾。
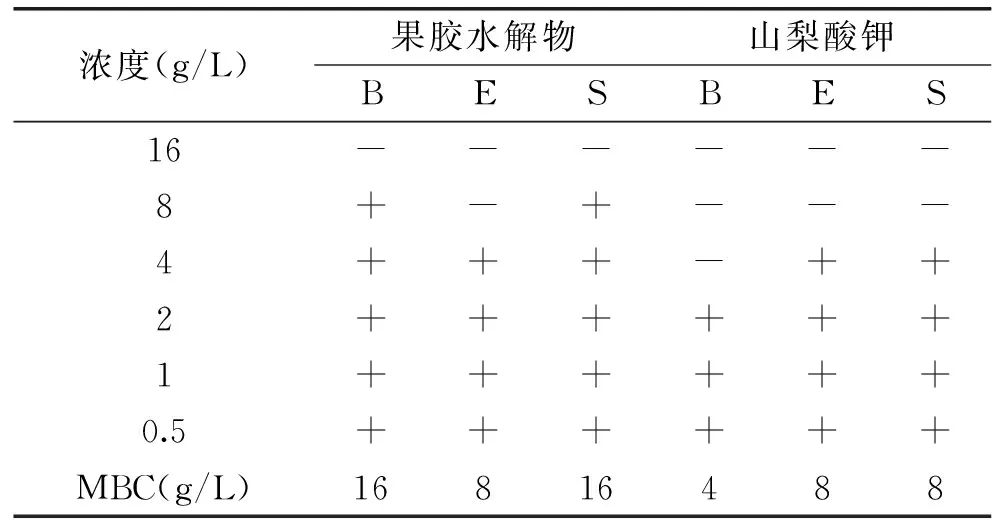
表7 咖啡果皮果胶水解物对三种菌的MBC Table 7 MBC of pectin hydrolysatefrom coffee pericarp to three bacterias
3 结论
首次从云南小粒咖啡果皮中提取果胶,采用单因素正交试验优化得到果胶的最佳提取工艺为:料液比1∶30 g/mL,pH为1.5,提取温度60 ℃,提取时间为100 min,在此工艺条件下咖啡果皮果胶的得率为15.13%。采用果胶酶对小粒咖啡果皮果胶进行水解,考察果胶水解物的抑菌效果,结果表明,小粒咖啡果皮果胶水解物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌均有抑菌活性。其中,果胶水解物对大肠杆菌和金黄色葡萄球菌的MIC均为:8 g/L,MBC均为:16 g/L,比山梨酸钾的活性弱。而果胶水解物对枯草芽孢杆菌的MIC和MBC分别为:4、8 g/L,抑菌活性和山梨酸钾相当。该提取方法相对简单,能耗较小,适合于乡镇咖啡果皮废料提取果胶,并且提取的咖啡果皮果胶理化性质符合果胶标准,有较好的抑菌活性,可开发成为一种新的天然食品防腐剂,为云南小粒咖啡果皮的高值化综合加工利用提供了新途径。

