迷走神经电刺激对化疗诱发周围神经病变有短期治疗作用 *
张 冉 甘 宇 冯 艺, 李 君
(北京大学人民医院1 麻醉科;2 疼痛医学科,北京 100044)
化疗是恶性肿瘤治疗的重要辅助手段,化疗后疼痛是癌症病人最常发生的症状之一,化疗引起疼痛一个很重要的原因是化疗诱发周围神经病变 (chemotherapy induced peripheral neuropathy, CIPN)。临床常用化疗药如长春碱类、紫杉碱类、铂类化合物等均可诱发CIPN,据报道60%以上肿瘤病人伴有CIPN[1]。化疗诱发外周神经性疾病属于神经病理性疼痛,严重影响病人的生活质量,而且还有可能限制化疗药物的使用,以致病人不能继续化疗或不能接受足够剂量的化疗,影响对癌症的进一步治疗。由于CIPN 的发病机制尚未阐明,至今国内外文献尚未报道明确有效的防治方法。因此,在规范使用包括神经毒性化疗药物治疗并提高肿瘤病人生存率的同时,进一步明确CIPN 发生机制并进行有效防治是亟待解决的临床问题[2]。
既往研究显示,炎症免疫机制在CIPN 中发挥重要作用,CIPN 大鼠血浆IL-1β, IL-6 和TNF-α 等炎症因子水平,均高于对照组大鼠[3],其背根神经节 (dorsal root ganglion, DRG) 有大量巨噬细胞浸润,抑制TNF-α 或IL-1β 后,大鼠的机械痛阈和冷痛阈明显改善。迷走神经电刺激 (vagus nerve stimulation, VNS) 此前用于治疗惊厥、抑郁症等疾病。迷走神经的胆碱能抗炎通路被证实后,迷走神经电刺激进入了更多学科的视野,在此基础上发展出迷走神经电刺激治疗类风湿性关节炎、炎性肠病、心肌缺血再灌注损伤等疾病[4]。本研究的目的是探讨颈部迷走神经电刺激能否通过抑制炎症反应发挥治疗CIPN 的作用,为CIPN 治疗提供更多思路。本研究创新性的从迷走神经电刺激的抗炎作用角度探讨治疗CIPN 的可能性,此前未见相关报道。
方 法
1.实验材料
本实验已获北京大学人民医院伦理委员会批准。选取雄性SD 大鼠72 只,6~8 周龄,体重220~250 g(由北京维通利华公司提供)。于SPF级实验动物房饲养,分别于0 天、2 天、4 天、6 天腹腔注射紫杉醇(北京协和药厂,批号170903)2 mg/kg。建模成功的定义为:第28 天测量大鼠对4 g von Frey 纤维机械缩足反射阈值(mechanical withdrawal threshold, MWT)大于0 或对15 g von Frey纤维MWT 大于10%。按随机数字表法将建模成功的大鼠分为迷走神经电刺激组(VNS 组,n = 36)和仅放置电极不刺激的假手术组(Sham 组,n = 36)。
2.实验方法
迷走神经电刺激组(VNS 组)大鼠第28 天吸入异氟醚麻醉后,仰卧固定,颈部正中切口,暴露右侧颈动脉鞘,分离出右侧迷走神经干约1 cm,双铂保护电极刺激(见图1)[5],电极外接电刺激仪 (济南益延科技,YLS-9A)。刺激参数:波宽1 ms,频率10 Hz,电压1~2 V,随心率调整,保持心率下降 < 10%,刺激时间30 s,间歇5 min,重复10 次。迷走神经刺激成功的标志为心率较基础值下降。
假手术组(Sham 组)大鼠仅暴露分离右侧颈部迷走神经,双铂保护电极接触迷走神经但不予以电刺激,持续时间同VNS 组。
分别于0天(制模前)、28天(迷走神经刺激前)、29 天(迷走神经刺激后1 天)和35 天(迷走神经刺激后7 天)测量大鼠的MWT 及热缩足反射潜伏期(thermal withdrawal latency, TWL)。分别于0 天(制模前)、28 天(迷走神经刺激后即刻)、29 天(迷走神经刺激后1 天)和35 天(迷走神经刺激后7 天)取材测量双侧L4-6DRG 中的NF-κB、TNF-α 和IL-10表达。
3. MWT 测定
将大鼠置于金属网上,盖以透明的有机玻璃罩。测试前先让大鼠适应环境15 min,待大鼠的梳理和探究活动基本停止后,用4 g 和15 g 的von Frey 纤维分别刺激大鼠后肢双侧足底中间的区域,使之稍成S 形,持续5 s,观察是否出现缩足反应,每足重复5 次,每次间隔15 min。大鼠在刺激时间内或在移开von Frey 纤维时立即出现快速的缩足反应,记为阳性反应,而身体活动所引起的缩足反应不记作阳性反应。缩回反应的总和用反应百分比表示(后足缩回数/10×100)。

图1 大鼠颈部迷走神经电刺激电极位置 [5]Fig. 1 Placement of the electrode for cervical vagus nerve stimulation [5]
4. TWL 测定
将大鼠置于薄玻璃板上,盖以透明的有机玻璃罩。先让大鼠适应环境15 min,待大鼠的梳理和探究活动基本消失后,利用手控热辐射仪分别照射大鼠后肢双侧足底正中间,记录从开始照射至抬足之间的时间即为此足的TWL。每只脚重复3 次,每次间隔15 min,取平均值。
5. Western blot 法检测定NF-κB、TNF-α 和IL-10表达
分别于28 天、29 天和35 天每组随机选择6 只大鼠,MWT 和TWL 测定结束后,将大鼠麻醉后取L4-6DRG, 分别加入RIPA 裂解液(Thermo), 电动匀浆粉碎组织后,12 000 r/min 离心10 min,取上清,使用BCA 法对DRG 总蛋白进行定量,蛋白定量后使用10% SDS-PAGE 凝胶进行电泳分离,并湿转入PVDF 膜上,经5% 脱脂牛奶封闭1 h 后,分别使用NF-κB p65 抗体、TNF-α、IL-10 抗体(1:1000)于4℃孵育过夜,再以辣根过氧化物酶标记的山羊抗兔IgG(北京中杉金桥,1:2000)37℃孵育1 h;ECL显色曝光。采用Image J 软件对Western 印迹显示的免疫反应阳性条带进行灰度测定,以NF-κB、TNF-α、IL-10 和β-actin 条 带 灰 度 的 比 值 代 表NF-κB、TNF-α 和IL-10 表达的相对水平。
6.免疫组化法检测NF-κB、TNF-α 和IL-10 表达
分别于28 天、29 天和35 天每组随机选择6只大鼠,MWT 和TWL 测定结束后,将大鼠麻醉后经左心室灌流固定,先以37℃生理盐水快速冲洗,直至由右心耳流出的液体清亮无色,用4℃预冷的4% 多聚甲醛先快后慢灌流固定,灌注完毕后取L4-6DRG,入4%多聚甲醛固定液固定24 h后,L4-6DRG 经脱水,石蜡包埋、切片、厚度为4 μm。按照试剂盒说明书进行NF-κB、TNF-α 和IL-10 免疫组织化学染色。免疫组化量化评估采用Image J 软件IHC profiler 插件自动评分系统,强阳性为4 分,阳性为3 分,弱阳性为2 分,阴性为1 分。
7. 统计学分析
以SPSS 13.0 及graphpad prism 6.0 对数据进行统计学分析处理。组间TWL 采用成组t 检验,组内TWL 采用单因素方差分析,P < 0.05 为差异有统计学意义。MWT 的非正态分布数据组间比较采用非参数检验,同一时间点组间比较,采用Kruskal-Wallis Test 和Mann-Whitney Test 两两比较,不同时间点组内比较,采用Friedman-Test 和Wilconxon Signed Ranks Test 两两配对比较。MWT 的正态分布数据组间比较采用单因素方差分析,正态分布数据的组内比较均采用重复测量方差分析,P < 0.05为差异有统计学意义。两组不同时间点NF-κB、TNF-α 和IL-10 Western blot 条带进行灰度分析后,使用双因素方差分析进行比较,P < 0.05 为差异有统计学意义。
结 果
两组大鼠体重、MWT 和TWL 的基础值均无显著性差异(P > 0.05)。
1.迷走神经电刺激对MWT 的影响
各时间点VNS 组和Sham 组的4 g MWT 均为0。两组大鼠建模后在28 天均出现15 g MWT 升高和TWL 下降。在第28 天给予单次颈迷走神经电刺激后,VNS 组15 g MWT 在29 天和35 天分别为10.8%和5.0%,而Sham 组分别为35.0%和28.3%,VNS 后CIPN 大鼠的15 g MWT 显著下降,与Sham 组相比有显著性差异(P < 0.001,见图2),与基础值相比无显著性差异(P > 0.05),说明VNS显著改善了CIPN 大鼠的MWT。
2. 迷走神经电刺激对TWL 的影响
在第28 天给予单次迷走神经电刺激后,VNS 组TWL 在29 天和35 天提高至10.7 s 和10.6 s,而Sham组分别为6.2 s 和6.6 s,VNS 后CIPN 大鼠的TWL 显著提高,与Sham 组相比有显著性差异(P < 0.001,见图3),与基础值相比无显著性差异(P > 0.05),说明VNS 显著改善了CIPN 大鼠的TWL。
3.迷走神经电刺激对CIPN 大鼠L4-6 DRG 中NF-κB、TNF-α 和IL-10 表达的影响 (Western blot)
单次颈迷走神经电刺激后,VNS 组大鼠DRG中NF-κB 在28 天表达下降,灰度值约为Sham 组的33.3%,有显著性差异(P < 0.05,见图4)。VNS 组大鼠DRG 中TNF-α 在28 天表达升高,灰度值约为Sham 组的3.7 倍,有显著性差异(P < 0.05,见图4)。VNS 组大鼠DRG 中IL-10 在28 天和29天表达升高,灰度值分别为Sham 组的11.7 倍和1.9倍,有显著性差异(P < 0.05,见图4)。
4.迷走神经电刺激对CIPN 大鼠L4-6 DRG 中NF-κB、TNF-α 和IL-10 表达的影响(免疫组化)
单次颈迷走神经电刺激后,与Sham 组相比,VNS 组DRG 中TNF-α 在28 天着色明显增强,有显著性差异(P < 0.05,见图5)。与Sham 组相比,VNS 组DRG 中IL-10 在28 天和29 天着色明显增强,有显著性差异(P < 0.05,见图5)。
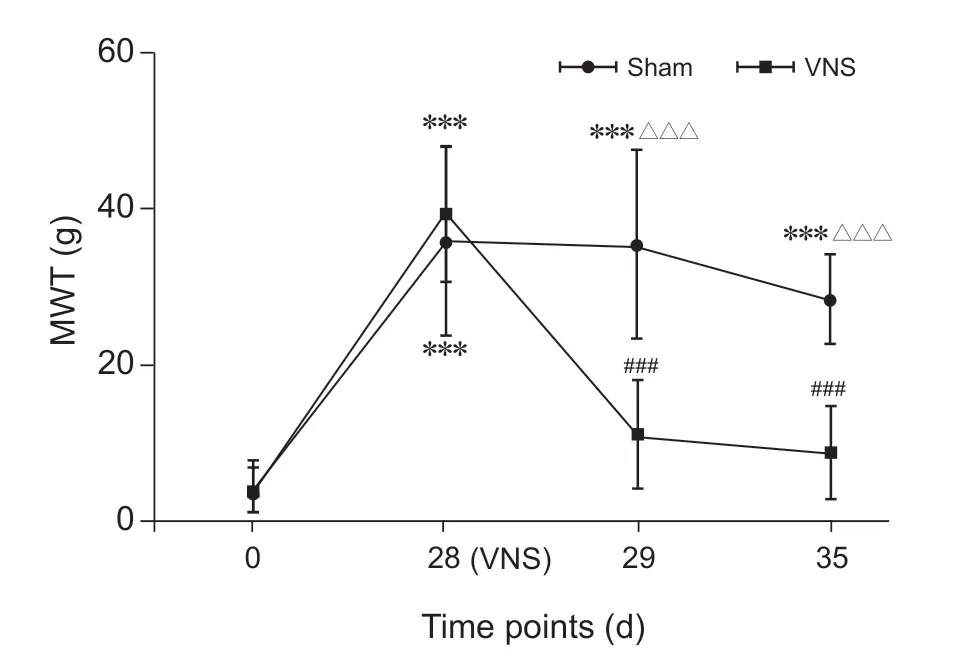
图2 大鼠各时间点的15 g 机械缩足反射阈值 (n = 36) ***P < 0.001,与0 天相比;###P < 0.001,与28天相比; △△△P < 0.001,与VNS 组相比Fig. 2 15 g MWT of rats at each time point (n = 36) ***P < 0.001, compared with 0 d; ###P < 0.001, compared with 28 d; △△△P < 0.001, compared with group VNS.

图3 大鼠各时间点的热缩足反射潜伏期 (n = 36) ***P < 0.001,与0 天相比;###P < 0.001,与28 天相比; △△△P < 0.001,与VNS 组相比Fig. 3 TWL of rats at each time point (n = 36) ***P < 0.001, compared with 0 d; ###P < 0.001, compared with 28 d; △△△P < 0.001, compared with group VNS.
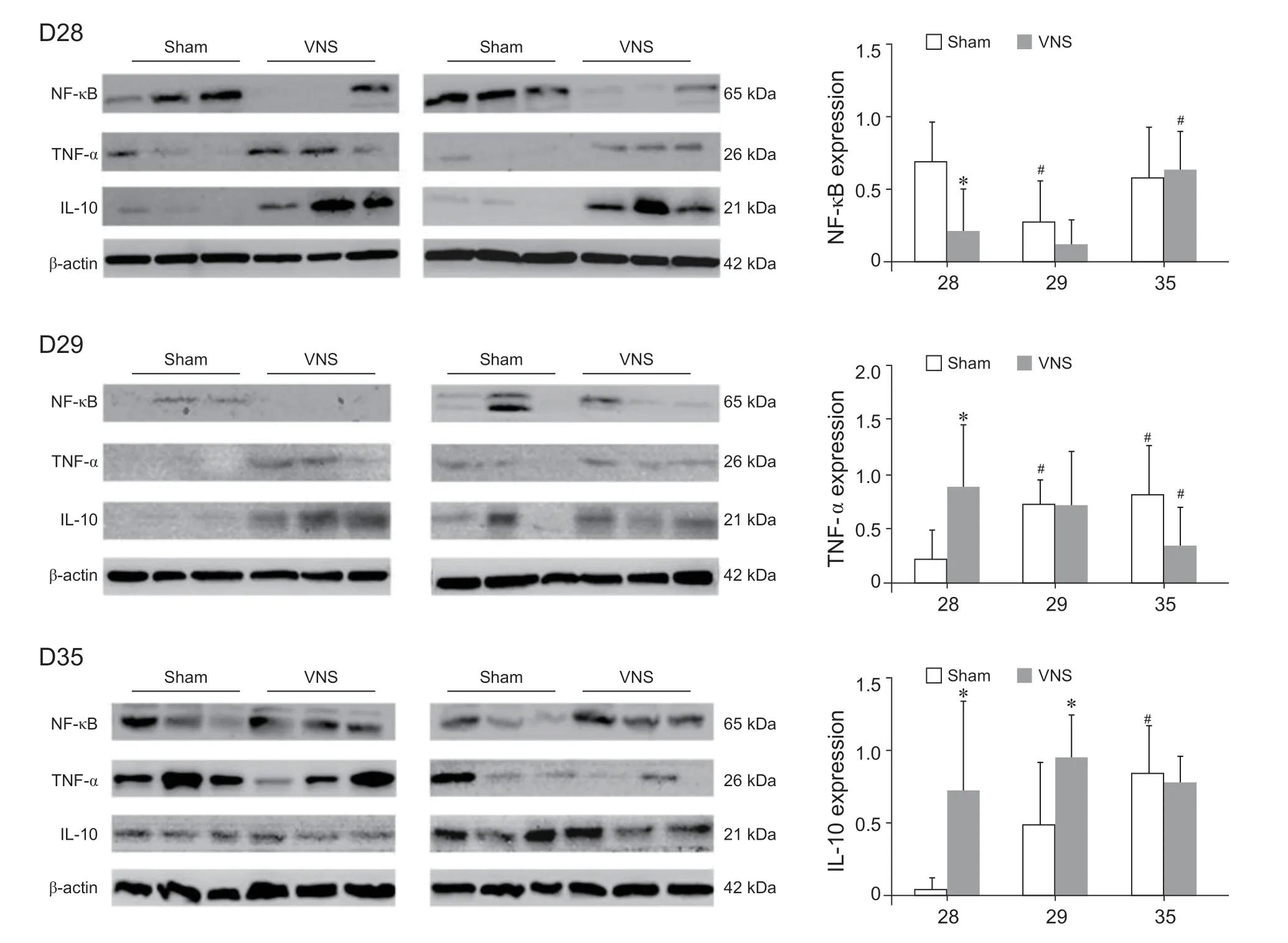
图4 Western blot 法检测两组不同时间点背根神经节中NF-κB, TNF-α 和IL-10 的表达 (n = 6) *P < 0.05,与Sham 组相比;#P < 0.05,与28 天相比Fig. 4 Expression of NF-κB、TNF-α and IL-10 in DRG of VNS and Sham group by Western blot at each time point (n = 6) *P < 0.05, compared with group Sham; #P < 0.05, compared with 28 d.
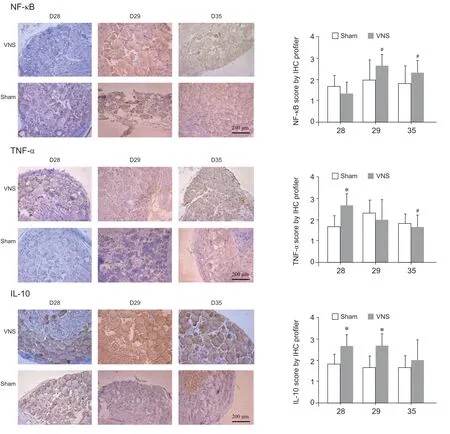
图5 免疫组化法检测两组不同时间点DRG 中NF-κB, TNF-α 和IL-10 的表达(n = 6) *P < 0.05,与Sham 组相比;#P < 0.05,与28 天相比Fig. 5 Expression of NF-κB, TNF-α and IL-10in DRG of VNS and Sham group by immunohistochemical staining at each time point (n = 6) *P < 0.05, compared with group Sham; #P < 0.05, compared with 28 d.
讨 论
多项研究表明,炎症免疫机制在神经病理性疼痛发生发展中有重要作用。CIPN 是典型外周性神经病理性疼痛,CIPN 小鼠建模后7 天和13 天血液中CD4+和CD8+T 淋巴细胞均增加,脾脏中IL-4+淋巴细胞显著增多,脊髓背角内细胞因子和趋化因子(TNF-α, IFN-γ 等)均升高[6]。说明炎症反应在CIPN 的发生与维持中发挥重要作用。
通过适当的方式刺激迷走神经能够治疗以过度和失调炎症反应为特征的疾病。2002 年Tracey 提出了“炎症反射”的概念,即迷走神经调节炎症反应的整个过程[7],这一通路被称为胆碱能抗炎通路。迷走神经传出纤维激活后通过位于巨噬细胞和其他免疫细胞表面的α7 烟碱型乙酰胆碱受体而减少细胞因子产生,而且这一通路同时具有免疫监测和免疫抑制的双重功能。
已经有一些证据证明刺激迷走神经可能对CIPN 有治疗作用。Busch 等[8]对48 名健康志愿者进行经皮刺激迷走神经耳支后,结果显示这些志愿者的机械痛阈升高,机械疼痛敏感性降低,热痛评分下降 。给予CIPN 小鼠α7 烟碱型乙酰胆碱受体激动剂尼古丁可以抑制机械痛觉超敏,并抑制皮内神经纤维的减少[9]。在CIPN 病人中发现迷走神经活性越低疼痛敏感性越高[10],这为进一步研究迷走神经电刺激对CIPN 的作用提供了理论依据。
我们此前研究发现CIPN 大鼠疼痛行为学改变于建模后第28 天达到峰值[11],因此本次研究在第28 天进行迷走神经电刺激,观察疼痛最强时给予迷走神经电刺激后大鼠疼痛行为学的变化,并与Sham 组比较,借此评价迷走神经电刺激对CIPN 的治疗效果。结果表明单次颈部迷走神经刺激后1 天和7 天(29 天和35 天),VNS 组大鼠的MWT 和TWL 较Sham 组均有显著改善,较28 天也明显改善,与建模前相比差异无统计学意义。Western blot 法和免疫组化法均发现单次颈部迷走神经刺激后即刻和1 天(28 天和29 天),VNS 组大鼠L4-6DRG 中IL-10 表达显著高于Sham 组(见图4、5)。VNS组DRG 中NF-κB 在迷走神经刺激后即刻(28 天)受到显著抑制,低于Sham 组(见图4),但维持时间不长,35 天即升高,与Sham 组差异无统计学意义(见图4、5)。以上结果提示单次颈部迷走神经刺激在刺激后即刻至1天起到了升高DRG 中IL-10、抑制DRG 中NF-κB,改善CIPN 大鼠疼痛行为学的作用更长,可持续到刺激后7 天。
VNS 组炎症抑制因子IL-10 较Sham 组明显升高。Krukowski 等[12]发现鞘内给予CIPN 大鼠IL-10 可缓解痛觉超敏,敲除IL-10 基因的大鼠CIPN 恢复延迟,IL-10 通过抑制DRG 神经元自发放电,促进CIPN 恢复,说明IL-10 在CIPN大鼠恢复中起到重要作用,VNS 有可能通过促进IL-10 合成、抑制DRG 神经元自发放电,起到改善CIPN 的作用。
此前我们的研究发现,CIPN 大鼠脊髓背角和DRG 中NF-κB 表达增加[13],而NF-κB 是主要参与机体免疫与炎症因子表达调控的转录因子,是TNF-α的上游因子。在本次研究中观察到单次颈部迷走神经刺激后即刻,VNS 组DRG 中NF-κB 受到显著抑制,这符合我们的预期,但TNF-α 的表达出乎意料的高于Sham 组,考虑一方面原因是NF-κB 为上游核因子,并未立即对TNF-α 产生作用;另一可能原因是VNS 会激活星形胶质细胞,而星形胶质细胞与DRG 内的卫星胶质细胞有很多相似之处,有可能DRG 内的卫星胶质细胞也被激活,这一过程中会产生TNF-α,下一步研究中可增加对卫星胶质细胞的检测,验证并探索是否有TNF-α 升高及其意义。在VNS 之后,虽然致炎因子TNF-α 增加,但炎症抑制因子IL-10 也明显增加,最终整体炎症是否增加取决于致炎因子和炎症抑制因子之间哪一种占优势,本研究未能给出直接答案,这也是下一步研究的目标之一。
Sham 组TNF-α 和IL-10 在28 天 和29 天 也 都出现了显著变化,可能是由于大鼠经历了麻醉和颈部迷走神经暴露手术后的打击出现的变化,致炎因子TNF-α 和炎症抑制因子IL-10 同时增加。VNS 组IL-10 在28 天和29 天均较Sham 组明显升高,是迷走神经电刺激增加炎症抑制因子,对炎症正向保护作用的表现。VNS 组随时间推移逐渐表现出对TNF-α 的抑制作用,35 天低于Sham 组。Sham 组TNF-α 和IL-10 的量在28 天和29 天变化的幅度较VNS 组更显著的原因可能是由于VNS 组迷走神经刺激发挥作用抑制了麻醉和手术后TNF-α 和IL-10的变化。
综上所述,单次颈部迷走神经刺激有助于短期内改善CIPN 大鼠疼痛行为学,提高DRG 内IL-10,降低DRG 内NF-κB。颈部迷走神经电刺激对CIPN有治疗作用,机制可能与抑制炎症反应有关,这为临床上治疗CIPN 病人提供了一种新的可能性,将来可进一步探讨多次或持续颈部迷走神经电刺激对CIPN 的治疗作用。

