基于网络药理学研究南五味子对肝损伤的保护作用机制分析
姜海慧,唐 凯,张化为,姜 祎,宋小妹,黄文丽,邓 翀
陕西中医药大学 陕西省秦岭中草药应用开发工程技术研究中心 陕西省中药基础与新药研究重点实验室,咸阳 712046
肝脏是人体内新陈代谢的中心站,被喻为“人体最大的化工厂”。肝损伤包括物理性肝损伤、化学性肝损伤、酒精性肝损伤、环境性肝损伤等[1]。临床上保护肝脏的特异性药物数量少,且易产生毒副反应,而具有多成分、多靶点作用的中药及中药方剂对于肝损伤有一定的促进再生和修复作用,但大多作用机制尚不十分清楚。因此探讨保肝中药治疗肝损伤的多靶点、多途径作用机制是目前的研究热点之一。
网络药理学是建立在计算机虚拟计算、高通量组学数据分析等技术基础上,利用了生物信息学方法,研究多成分-多靶点-多疾病的整合机制,因而具有整体性和系统性的优势,现广泛应用于中药复方及单味药的作用机制研究中[2]。
南五味子为木兰科植物华中五味子(Schisandrasphenanthera.Rehdet Wils.)的干燥成熟果实,具有收敛固涩、益气生津、补肾宁心的功效[3],含有有木脂素、多糖、三萜、挥发油等化学成分[4]。近年来,临床和实验研究表明南五味子具有保肝作用[5],其中木脂素类具有降低谷丙转氨酶、抗炎、抗氧化、抗肿瘤等药理作用[6]。南五味子多糖能够致小鼠急性肝损伤后的ALT和AST水平明显降低,使小鼠肝脏损伤的到有效改善[7]。南五味子能够促进胆汁分泌,使肝内有毒物质加速排泄,南五味子中含有多种活性成分能够使SOD、GSH-Px等酶的生物活性增强,具有促进蛋白质生物合成、抗脂质过氧化、促进肝糖原生成、保护肝细胞膜等作用,同时南五味子能够促进肝脏解毒过程,使肝脏收到良好的保护,并能够使受肝损伤组织再生,能够使外界因素导致肝组织中不断升高的转氨酶有效降低[8]。但对南五味子而言究竟哪些成分都发挥保肝功效,其治疗肝损伤的作用机制均不清楚。基于此,本研究通过网络药理学,整理南五味子活性成分、关键靶点、作用通路之间的关系,结合分子对接验证的方法,探讨南五味子保肝的作用机理,从而为南五味子对治疗肝损伤提供理论依据。
1 材料与方法
1.1 南五味子活性成分的筛选
在中药系统药理学数据库与分析平台TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)和一些已发表的文献中检索南五味子的所有化学成分,通过OB(口服生物利用度)≥20%,DL(类药性)≥0.1及Lipinski原则[9]筛选出活性成分。
1.2 南五味子靶点的整理
在PubChem(https://pubchem.ncbi.nlm.nih.gov/)检索活性成分对应的2D结构式,通过Swiss数据库(http://www.swisstargetprediction.ch/)进行靶点的预测富集,将TCMSP数据库检测到的靶点与其整合,使用Uniprot数据库(https://www.uniprot.org),搜索靶点的基因名,去重整合。
1.3 收集疾病相关靶点
在Genecard与OMIM中搜索关键词“hepatic injury”,整合肝损伤疾病相关靶点的基因名。然后通过Venny2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html)把南五味子的活性成分的预测靶点与肝损伤疾病的靶点绘制韦恩图并取交集,整理共同的靶基因。
1.4 构建关键靶点的蛋白互作网络
STRING数据库(https://string-db.org/)收录了计算、实验、文献等方法的蛋白相互作用关系,是目前常用构建蛋白-蛋白相互作用(PPI)网络的数据库。将上述分析取到的关键靶基因导入STRING数据库,选择物种为人,得到南五味子治疗肝损伤的PPI网络,在构建的PPI网络中,节点的大小和颜色深浅反映自由度(degree)值大小,边粗细反映组合分数(combine score)大小。分析PPI网络,计算网络中节点度值,度值越大代表节点在网络中越处于核心地位。用其得到的“TSV”文件通过Cytoscape(版本3.2.1)中NetworkAnalyzer工具进行拓扑分析。
1.5 构建“药物成分-靶点”网络并分析
Cytoscape3.2.1(可视化网络构建与分析软件)是构建与研究中药网络的常用软件。导入南五味子活性成分与肝损伤相关疾病的靶点,构建“药物成分-靶点”网络。
1.6 关键靶点的GO分析与KEGG富集分析
使用半编程性质的脚本软件R project,可以用于实现多种生物信息分析与结果可视化。使用其生物学分析功能,对南五味子治疗肝损伤的关键靶点进行GO与KEGG分析,设置P<0.05,Q<0.05,其中GO分析包括生物过程(BP)、细胞成分(CC)和分子功能(MF)分析,分析结果以柱形图的形式予以展示。
1.7 活性成分与关键靶点的分子对接验证
将上述筛选出的南五味子的活性成分在PubChem平台中查询其结构式,并通过SMILES导出,在DISCOVERY STUDIO软件中打开并在Macromolecules模块下对每个小分子进行优化处理,PPI网络中“degree”值前20的靶点作为受体,在PDB数据库(http://www.rcsb.org/)中下载其靶点的蛋白结构,然后导入DISCOVERY STUDIO软件进行分子结构常规预处理,接着选择Libdock对接模块中设定docking preference为user specified,设定minimum LibDockscore为105分,其他参数取默认值,进行分子对接。打分函数LibDock Score分数越高,其对接的结合的活性越好。
2 结果
2.1 南五味子活性成分的筛选
一共整理了南五味子的化学成分共149个,经筛选,共有31个活性成分纳入研究(见表1)。
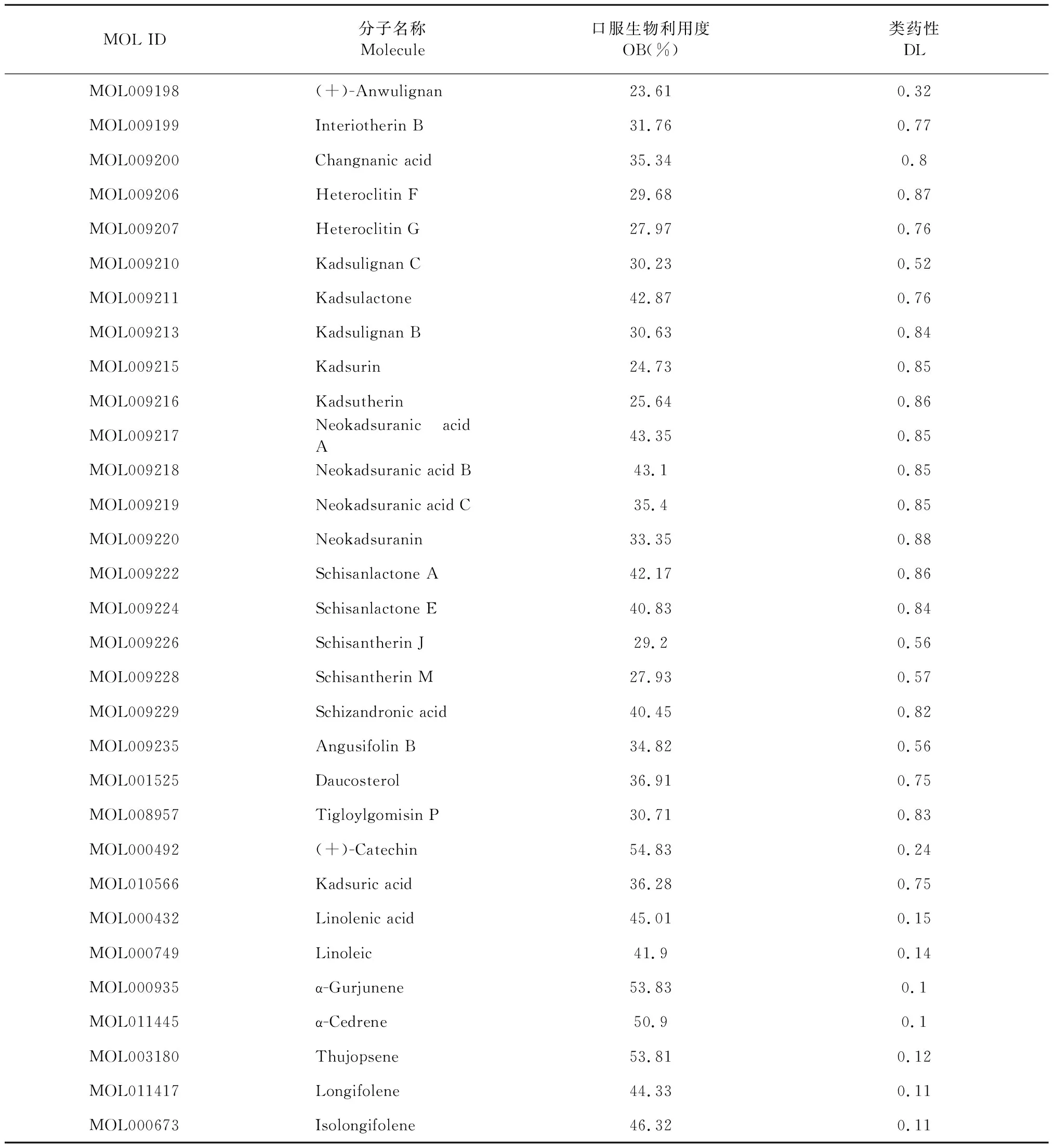
表1 南五味子的主要活性成分Table 1 Main active ingredients of Schisandra sphenanthera
2.2 收集南五味子有效活性成分的作用靶点
通过TCMSP和Swiss检索的靶点,收录的南五味子中成分的作用靶点共1 639个。使用Uniprot数据库收集作用靶点的基因名,删除无效与重复靶点,共获取南五味子有效活性成分作用靶点537个。
2.3 收集肝损伤疾病的相关基因
检索OMIM和Genecard数据库,整理并去重,共收集到肝损伤相关疾病靶点3 493个。将上述南五味子有效成分的作用靶点映射到其中,共获得交集358个,见图1,将其定义为南五味子治疗肝损伤的“关键靶点”。

图1 南五味子作用靶点与肝损伤相关靶点交集Fig.1 Intersection of target of S.sphenantheraand related target of hepatic injury
2.4 构建并分析关键靶点的PPI网络
将上述358个关键靶点输入STRING数据库,构建成分与疾病靶点的PPI网络,PPI网络中包含节点308个,边2 036条。将其“TSV”文件导入Cytoscape,构建南五味子与肝损伤靶点的PPI网络,并通过R语言制作柱形图,其中展示了PPI网络中Degree值较高的前20位,见图2,将其定义为“核心靶点”。选取 degree值排名前六的核心靶点:PIK3CA、APP、SRC、MAPK1、MAPK3、STAT3。其中PIK3CA(磷脂酰肌醇-3-激酶)在细胞的生长、增殖、凋亡、血管生成、自吞噬等过程中发挥着极其重要的生物学功能[10],MAPK1与MAPK3(丝裂原活化蛋白激酶)调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理或病理过程[11],STAT3(信号传导及转录激活因子3)具有显著的抗凋亡和促有丝分裂活性,能够上调一系列细胞存活及增殖相关基因[12]。
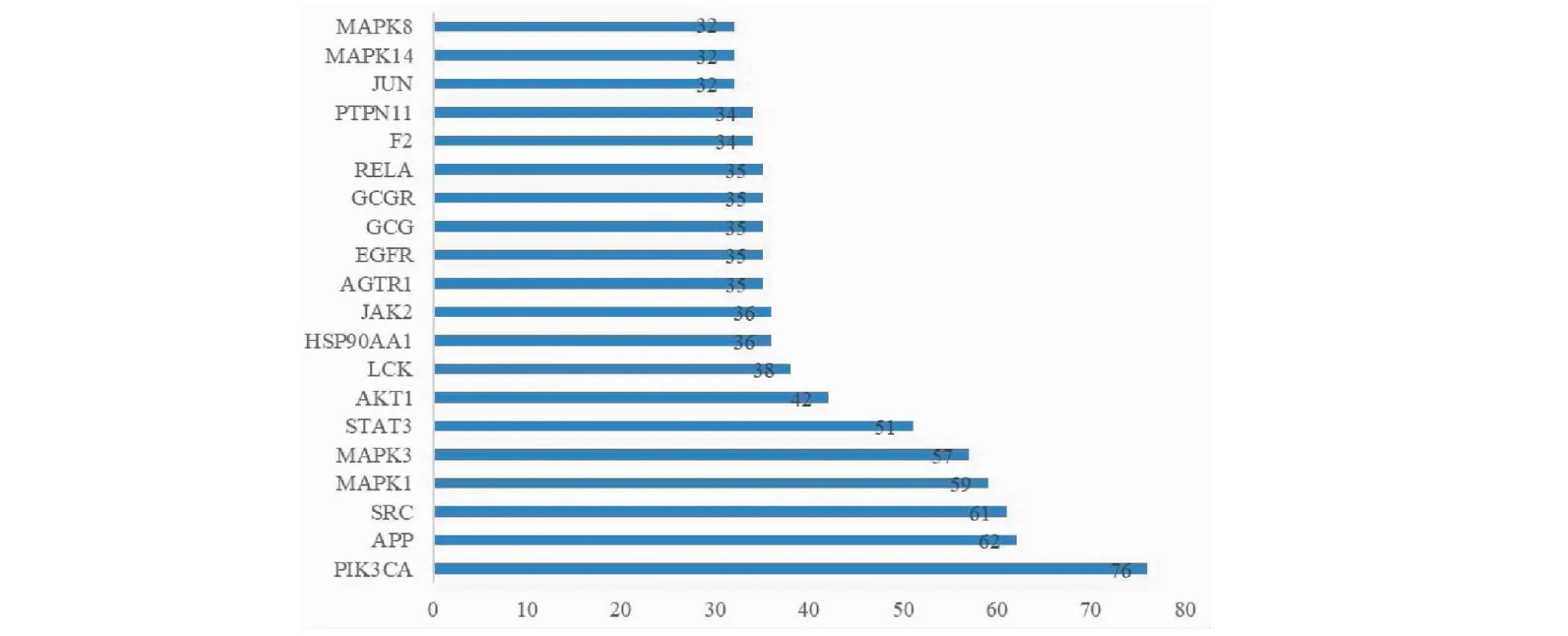
图2 PPI网络中degree值较高的靶点Fig.2 Targets with higher degree in PPI networks
2.5 构建“药物成分-靶点”网络并分析
将南五味子活性成分、关键靶点输入Cytoscape软件,构建“药物成分-靶点”网络图(见图3),在网络图中,蓝色圆形代表活性成分所作用的靶点,绿色棱形代表南五味子中所含有的活性成分。分析网络图,可知网络图中共包含节点(node)388个,节点与节点之间的作用关系,即边(edge)1 267条,展示了南五味子治疗肝损伤多成分、多靶点的作用。
2.6 GO生物学过程富集与KEGG通路富集分析
分析358关键靶点主要富集的细胞学组分、分子功能与生物学过程。主要进行靶点在生物学过程的分析,结果显示南五味子治疗肝损伤的关键靶点共在2 794个GO term上富集。其中所涉及的生物信息学功能与过程包括positive regulation of MAPK cascade、response to toxic substance、peptidyl-serine phosphorylation等生物学过程密切相关。图4展示了前20位GO分析BP的结果。
对南五味子治疗肝损伤的358个关键靶点进行KEGG富集分析,分析结果显示共富集在168条通路上,其中包括Neuroactive ligand-receptor interaction、Proteoglycans in cancer、Prostate cancer、EGFR tyrosine kinase inhibitor resistance、Hepatitis B、ErbB signaling pathway等信号通路。见图5,展示了前20位KEGG通路富集分析结果。其中参与EGFR tyrosine kinase inhibitor resistance通路的核心靶点有9个,分别为EGFR、PIK3CA、MAPK1、JAK2、AKT1、STAT3、MAPK3、JAK1、SRC(图6),在排名前五的信号通路里核心靶点存在数量最高,因此,将此信号轴作为南五味子对肝损伤治疗发挥药效的通路之一。并且PIK3CA、MAPK1、STAT3三个靶点在前10的信号通路里涉及到4个以上的信号通路,这些通路主要涉及到炎症的发生、氧化应激、癌细胞的抑制等生物学过程。

图3 南五味子成分与靶点网络Fig.3 Compounds-targets interaction network of S.sphenanthera
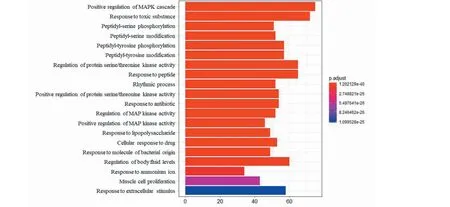
图4 关键靶点的GO富集分析Fig.4 GO enrichment analysis for key targets
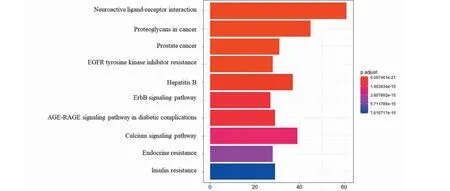
图5 关键靶点的KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of key targets
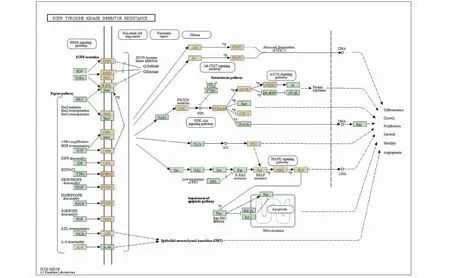
图6 EGFR酪氨酸激酶抑制剂耐药Fig.6 EGFR tyrosine kinase inhibitor resistance
2.7 分子对接结果
将南五味子31个活性成分与导致肝损伤疾病重点相关的靶蛋白PIK3CA、MAPK1、STAT3做分子对接。在DISCOVERY STUDIO中对接并计算RMSD(均方根偏差),普遍认为RMSD≤0.2 nm时能说明此方法能较好的重现结合模式,对接的结果比较可靠[13]。当对接大于105或者高于原配体的打分值时,可认为对接有较好的结合活性,结果显示出南五味子活性成分中有14个成分与PIK3CA有较好的的结合活性,有15个成分与MAPK1有较好的结合活性,有12个成分与STAT3有较好的结合活性。见表2。其中新南五味子酸C(neokadsuranic acid C)与PIK3CA和STAT3结合(图7和8),和STAT3结合五味子酯乙(interiotherin B)与MAPK1结合(图9)其对接效果较好。
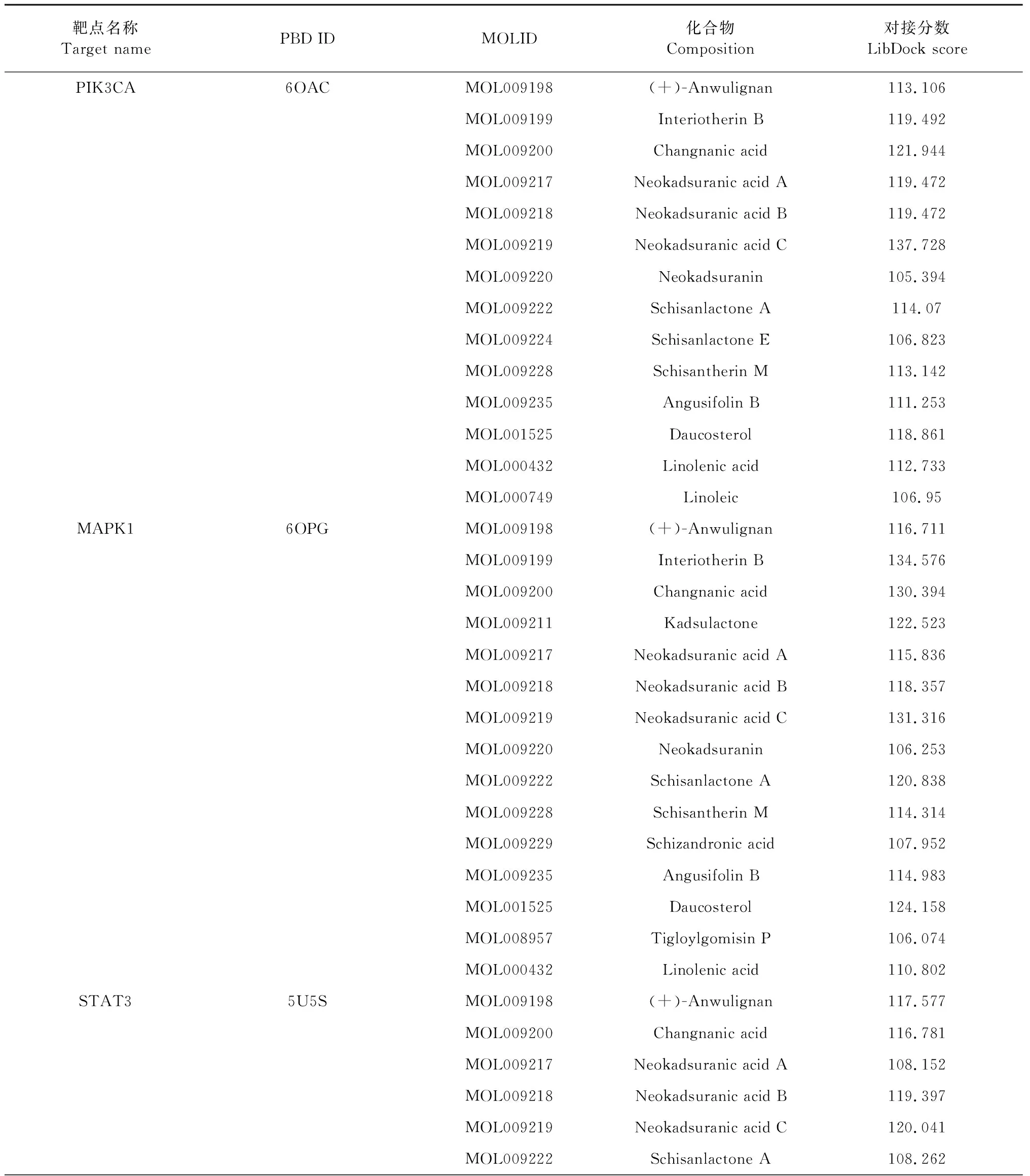
表2 分子对接结果Table 2 Molecular docking results
续表2(Continued Tab.2)
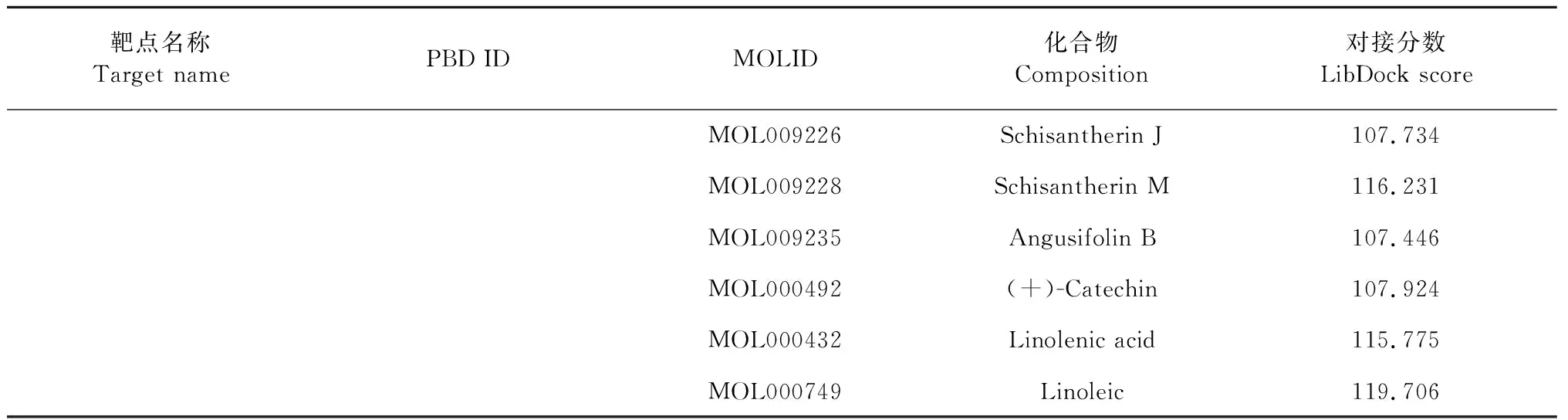
靶点名称Target namePBD IDMOLID化合物Composition对接分数LibDock scoreMOL009226Schisantherin J107.734MOL009228Schisantherin M116.231MOL009235Angusifolin B107.446MOL000492(+)-Catechin107.924MOL000432Linolenic acid115.775MOL000749Linoleic119.706

图7 PIK3CA与neokadsuranic acid C对接Fig.7 The molecular docking of PIK3CA and neokadsuranic acid C
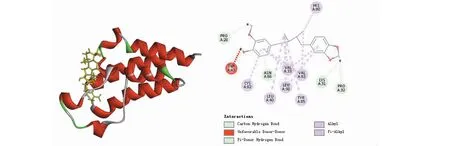
图8 STAT3与neokadsuranic acid C对接Fig.8 The molecular docking of STAT3 and neokadsuranic acid C
3 讨论
经本次实验文献挖掘,发现安五脂素((+)-anwulignan)、长南酸(changnanic acid)、胡萝卜苷(daucosterol)、亚麻酸(linolenic acid)新南五味子酸C(neokadsuranic acid C)、五味子酯乙(interiotherin B)等31种具有潜在抗肝损伤成分,其涉及到治疗肝损伤的机制包含抑制氧化应激、炎症反应、细胞纤维化、细胞凋亡等[14]。
根据KEGG通路分析表明了肝损伤的相关通路可能通过及神经信号传递通路(Neuroactive ligand-receptor interaction)、癌症蛋白多糖信号通路(Proteoglycans in cancer)、前列腺癌信号通路(Prostate cancer)、EGFR酪氨酸激酶抑制和耐药信号通路(EGFR tyrosine kinase inhibitor resistance)、乙型肝炎病毒信号通路(Hepatitis B)、ErbB信号通路(ErbB signaling pathway)等信号通路起治疗作用。其中富集到EGFR tyrosine kinase inhibitor resistance通路上的关键靶点有EGFR、PIK3CA、MAPK1、JAK2、AKT1、STAT3、MAPK3、JAK1、SRC,在排名前五的信号通路里存在数量最高,EGFR(表皮生长因子受体)属于是受体型酪氨酸激酶(RTKs)家族的成员之一[15],是一个巨大的跨膜糖蛋白,EGF可以刺激细胞分裂,与组织的修复和再生有关。EGF与EGFR结合,激活酪氨酸激酶区,使其磷酸化,促进细胞的分裂增殖及正常细胞的恶性突变,它在细胞的凋亡、增殖、分化、迁移和细胞周期循环发挥着十分重要的作用[16,17]。有研究表明,在肝损伤和修复过程中,ErbB1的表达升高[18],从早期炎症和肝细胞增殖到纤维化发生和肿瘤转化,EGFR信号通路在肝损伤和炎症中都担任着重要的角色[19],故以此通路为切入点进一步寻找南五味子治疗肝损伤的作用靶标。
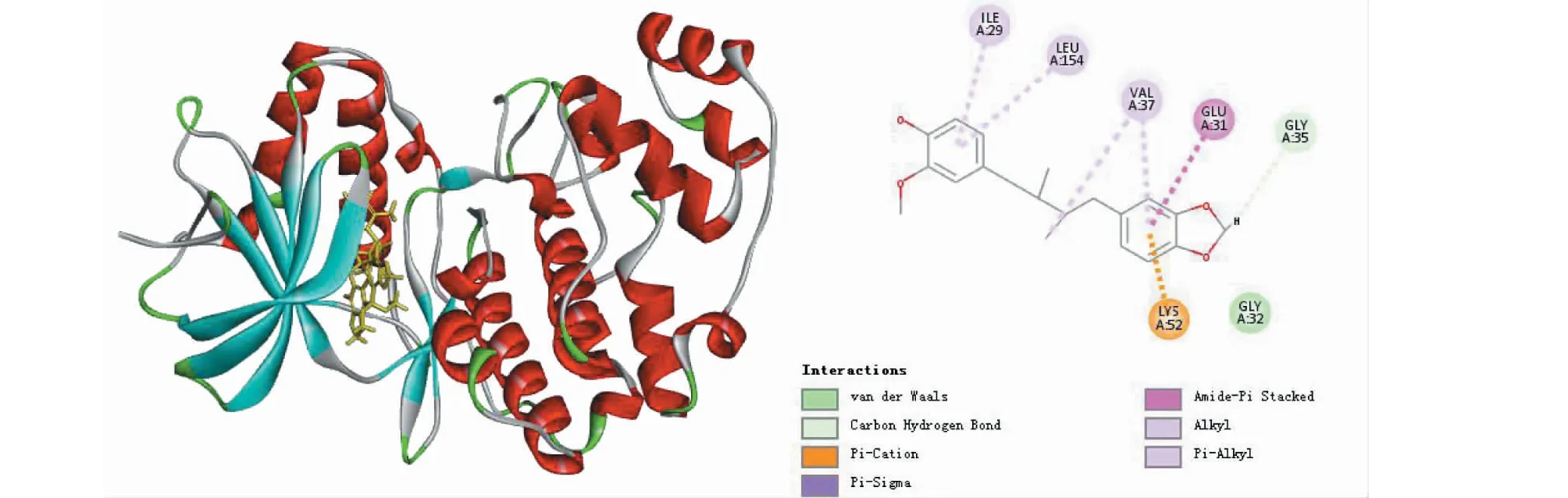
图9 MAPK1与interiotherin B对接Fig.9 The molecular docking of MAPK1 and interiotherin B
挖掘到潜在抗肝损伤成分的核心靶点为EGFR、PIK3CA、MAPK1、JAK2、AKT1、STAT3、MAPK3、JAK1、SRC等,其中PIK3CA、MAPK1、STAT3三个靶点在前10的信号通路里涉及到4个以上的信号通路,这些通路主要涉及到炎症的发生、氧化应激、癌细胞的抑制等生物学过程。基于此本研究以PIK3CA、MAPK1、STAT3为靶点,与31个潜在抗肝损伤成分进行分子对接分析,对其生物活性进行预测。
机体遭受有害刺激引起活性氧簇(ROS)生成增加或从而导致氧化-抗氧化失衡,引起细胞氧化应激状态(OS)[20]。氧化应激可激活MAPK/ERK、PI3K/Akt、JAK/STAT、Nrf2/ARE、Wnt/β-catenin 等一系列信号通路及其相关响应因子,造成细胞外基质(ECM)成分代谢及相关因子表达异常,从而介入骨节、心血管、肝、肾等组织器官ECM代谢异常疾病的发生发展[21,22]。另外MAPK、STAT激活的信号通路对于维持细胞的正常生理功能以及在炎症反应中占有重要地位,如LPS可以诱导炎症细胞产生致炎因子TNF-α、IL-1、IL-6等均与这些信号通路紧密相关[23]。表明PIK3CA、MAPK1、STAT3三个靶点与肝损伤密切相关。
通过相关网络图的构建可直观的显示出南五味子治疗肝损伤的多成分、多靶点、多途径等共同作用的特点,符合中医药治疗疾病的特点,相比于西药单基因-单靶点的作用机制,优势明显。本研究通过分子对接验证了网络药理学靶点预测的可靠性,为后续进一步验证奠定了基础,所得结果也与现有文献报道高度符合,但本研究结果只是理论上的预测,药物在体内作用机制的确认仍需要进一步通过整体动物实验的验证。

