黄花败酱化学成分研究
张 旋,侴桂新
上海中医药大学中药研究所 上海中药标准化研究中心,上海 201203
黄花败酱为败酱科败酱属植物黄花败酱PatriniascabiosaefoliaFisch.的干燥全草,亦称“黄花龙芽”,是我国传统常用中药“败酱草”的来源之一,具有清热解毒、消肿排脓、活血祛瘀的功效,治疗慢性阑尾炎疗效显著[1]。迄今为止,文献报道的黄花败酱植物主要化合物种类有:三萜及其皂苷类、环烯醚萜类、黄酮类、香豆素类、木脂素类、甾醇类、有机酸、挥发油等[2,3]。现代药理实验证明黄花败酱具有镇静、抗菌、抗炎、抗肿瘤、抗白血病等药理活性[2,3]。为进一步丰富黄花败酱的化学信息和开发黄花败酱的资源,本文利用多种色谱分离技术和波谱技术,对黄花败酱P.scabiosaefolia全草的95%乙醇提取物进行化学成分研究。
1 仪器与材料
Bruker AVANCE-III(400、600 MHz)型核磁共振波谱仪;Agilent UHD Accurate Mass Q-TOF LC-MS(HR-ESI-MS);岛津LC-20A型高效液相色谱仪(岛津,日本);制备型高效液相色谱仪Agilent 1100 & 1260(Pre-HPLC,安捷伦,美国);中压液相色谱仪(MPLC,Grace,美国);Olympus CKX41型显微镜;Thermo BB 150型二氧化碳培养箱;GeneSpeed 416型低速离心机;Bio-Tek Synergy H4全功能酶标仪;制备色谱柱(Shiseido Capcellpak C18,250×20 mm,资生堂,日本);MCI gel CHP20P(75~150 μm,三菱化学有限公司,日本);凝胶Sephadex LH-20(25~100 μm,通用电器医疗集团,美国);YMC gel ODS-AQ(50 μm,YMC 有限公司,日本);柱层析硅胶(100~200目,200~300目,青岛海洋化工厂),无特殊说明,以下文章中所提及的柱层析硅胶均为200~300目;薄层层析及制备型薄层层析HSGF254硅胶板(烟台江友硅胶开发有限公司,中国);DMSO-d6、CD3OD、CDCl3(Cambridge Isotope Laboratories,美国);乙腈、甲醇(Dikma,色谱级,美国);薄层层析用石油醚、乙酸乙酯、正丁醇、二氯甲烷、丙酮、甲醇(分析纯,国药集团上海化学试剂公司,中国);柱层析用石油醚、乙酸乙酯、二氯甲烷、甲醇(工业纯,上海润捷化学试剂有限公司,中国);McCoy′s 5A Medium培养液、胎牛血清FBS、Penicillin-Streptomycin(PS,青霉素-链霉素双抗溶液)、Pshosphate Buffered Saline(PBS,pH=7.2,HyClone,美国)、Cell Counting Kit(CKK-8试剂盒,上海翊圣生物科技有限公司)。HCT-116细胞购买自中国科学院细胞库。
实验用黄花败酱全草由济人医药集团(安徽亳州)提供,并由安徽中医药大学方成武教授鉴定为黄花败酱Patriniascabiosaefolia,凭证标本(NO.HHBJ20170327)保存于上海中医药大学中药研究所。
2 实验方法
2.1 提取与分离
黄花败酱全草47.5 kg,切成3~5 cm的小段,以95%工业乙醇70 ℃回流提取三次,每次十倍量,回流时间依次为1.5、1、1 h,合并提取液,减压回收乙醇,获得总浸膏4.43 kg。将黄花败酱总浸膏制成的混悬液依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取,减压回收溶剂得到黄花败酱各极性萃取部位。
二氯甲烷部位(344 g)经硅胶柱色谱,二氯甲烷-甲醇系统(1∶0→0∶1)不同比例梯度洗脱,经TLC检识,合并相同的流份,得到7个流份Fr1~Fr7。Fr2(8.6 g)以石油醚-乙酸乙酯为溶剂系统,经反复硅胶柱色谱得化合物4(13.9 mg)和18(30.2 mg)。Fr4(11 g)经硅胶柱色谱,石油醚-乙酸乙酯系统不同比例梯度洗脱,通过TLC检识,合并相同的流份,共得到7个流份Fr4-1~Fr4-7。Fr4-2(479 mg)经硅胶柱色谱,石油醚-乙酸乙酯系统(15∶1)等度洗脱获得3个流份Fr4-2-1~Fr4-2-3。Fr4-2-2经硅胶柱色谱,石油醚-乙酸乙酯系统等度洗脱,再经制备薄层色谱得化合物17(84 mg)。Fr4-3(611 mg)经Sephadex LH-20(二氯甲烷∶甲醇=1∶1)洗脱,然后经Sephadex LH-20(甲醇系统)洗脱,再经制备高效液相色谱(MeCN∶H2O=11∶89;16 mL/min)得化合物24(25.5 mg)。Fr4-5(697.5 mg)经Sephadex LH-20(二氯甲烷∶甲醇=1∶1)洗脱获得2个流份Fr4-5-1~Fr4-5-2。Fr4-5-1经硅胶柱色谱,石油醚-乙酸乙酯系统等度洗脱,再经过Sephadex LH-20(甲醇系统)和制备高效液相色谱(MeCN∶H2O=17∶83)得化合物5(21.9 mg)。Fr4-6(848 mg)经Sephadex LH-20(二氯甲烷∶甲醇=1∶1)洗脱获得3个流份Fr4-6-1~Fr4-6-3。Fr4-6-2经硅胶柱色谱,石油醚-乙酸乙酯系统等度洗脱获得2个流份Fr4-6-2-1~Fr4-6-2-2。Fr4-6-2-1经制备高效液相色谱(MeCN∶H2O=13∶87)得化合物21(6.9 mg)。Fr4-6-3先经硅胶柱色谱,石油醚-乙酸乙酯系统等度洗脱,再经Sephadex LH-20得化合物8(83.4 mg)。Fr5(13 g)经硅胶柱色谱,石油醚-乙酸乙酯系统不同比例梯度洗脱,经TLC检识,合并相同的流份,得到5个流份Fr5-1~Fr5-5。Fr5-1经硅胶柱色谱,石油醚-乙酸乙酯系统洗脱获得2个流份Fr5-1-1和Fr5-1-2。Fr5-1-1经反复硅胶柱色谱得化合物19(39.8 mg)。Fr5-2经Sephadex LH-20洗脱共获得2个流份Fr5-2-1~Fr5-2-2。Fr5-2-1经硅胶柱色谱,石油醚-乙酸乙酯系统洗脱获得3个流份Fr5-2-1-1~Fr5-2-1-3。Fr5-2-1-2经Sephadex LH-20(甲醇系统)洗脱获得3个流份Fr5-2-1-2-1~Fr5-2-1-2-3。Fr5-2-1-2-1和Fr5-2-1-2-2分别经制备高效液相色谱等度洗脱(MeCN∶H2O=16∶84;MeCN∶H2O=12∶88)得化合物22(22.5 mg)和化合物1(70.8 mg)。
乙酸乙酯部位312 g经MCI柱色谱,甲醇-水(0、30%、60%、90%、100%)系统不同比例梯度洗脱,经TLC检识,合并相同的流份,得到7个流份Fr1~Fr7。Fr2(58 g)经中压柱色谱(MPLC,MeOH∶H2O=0∶1→1∶0)得到2个流份Fr2-1和Fr2-2。Fr2-1(48 g)经凝胶Sephadex LH-20梯度洗脱,共得到7个流份Fr2-1-1~Fr2-1-7。Fr2-1-2(32 g)吸附于60 g硅胶(100~200目),经硅胶柱色谱,二氯甲烷-甲醇系统梯度洗脱,获得7个流份Fr2-1-2-1~Fr2-1-2-7。Fr2-1-2-3经制备高效液相色谱(MeCN∶H2O=10∶90)得化合物20(1.8 mg)。Fr2-1-2-4、Fr2-1-2-6分别先经Sephadex LH-20(40%、60%甲醇-水系统),再分别经制备高效液相色谱(MeCN-H2O梯度洗脱;MeCN∶H2O=12∶88)得化合物13(9.5 mg)、23(2 mg)、9(2 mg)、15(16.6 mg)和14(17.5 mg)、16(20.9 mg)。Fr2-1-3(1.5 g)经硅胶柱色谱,再经制备高效液相色谱(MeCN∶H2O=5∶95;MeCN∶H2O=3∶97)得化合物10(5.9 mg)和6(7.2 mg)、7(2 mg)。Fr2-1-4(3.43 g))经硅胶柱色谱(二氯甲烷-甲醇系统),再经Sephadex LH-20和制备高效液相色谱(MeCN∶H2O=15∶85)得化合物12(16.6 mg)、11(17.5 mg)。Fr2-1-5经重结晶得化合物3(6.6 mg)。Fr2-1-6经硅胶柱色谱,二氯甲烷-甲醇系统(9∶1)等度洗脱得到化合物2(27.3 mg)。
2.2 细胞毒活性筛选
采用CCK-8法,以人结肠癌细胞HCT-116细胞为研究对象,10 μM盐酸伊立替康(CPT-11)为阳性药物组,对分离得到的化合物在浓度为100 μM的条件下,进行初步的细胞毒活性筛选。
HCT-116细胞用含10% FBS、1% P/S的McCoy′s 5A Medium培养基,于37 ℃、5% CO2细胞培养箱中孵育。将处于对数生长周期的HCT-116细胞经胰蛋白酶消化、显微镜下计数后,浓度调整为1.5×105个/mL,接种于96孔板中,于37 ℃、5% CO2细胞培养箱中孵育24 h。待细胞完全贴壁后,加入空白组(培养液)、阳性药物组CPT-11(10 μM)和100 μM的化合物溶液给药组,每组设置6个复孔。孵育24 h后,吸去上清液,加入100 μL含有10% CCK-8的McCoy′s 5A Medium 培养基,置37 ℃、5% CO2细胞培养箱中孵育30~40 min,在450 nm处测定吸光度(OD)值。以上实验均重复3次。
3 实验结果
3.1 结构鉴定
化合物1无色固体,可溶于甲醇;[α]-70.4(c0.125,MeOH);IRνmax3 383,1 660,1 048 cm-1;UV(MeOH)λmax250 nm。通过高分辨质谱HR-ESI-MS:m/z181.086 3 [M+H]+(calcd for C10H13O3,181.085 6)和氢碳谱数据确定其分子式为C10H12O3,不饱和度为5。在1H NMR谱(Table1)中显示有两个醛基氢信号δH9.53(1H,s,H-7)和9.99(1H,s,H-10),结合碳谱中醛基碳信号δC190.2和195.6,推断可能有两个醛基存在;一个甲基质子信号δH2.66(3H,s,H-9),结合碳谱中碳信号δC11.5,说明该化合物有一个甲基;一个烯烃质子信号δH5.99(2H,d,J=2.5 Hz,H-8)。碳谱中共有10个碳信号,其中包括两组烯碳信号δC138.7、166.7和δC133.8、152.8。在HMBC谱(Fig.1)中,δH2.66(3H,s,H-9)处的甲基氢信号与δC166.7,δC138.7和80.0相关,说明甲基连于C-2;烯烃氢信号δH5.99(2H,d,J=2.5 Hz,H-8)与δC152.8,40.3和195.6相关,表明双键与C-6相连;醛基氢信号δH9.99(1H,s,H-10)与δC138.7(C-1)相关,说明10号位上的醛基直接连于C-1位置上。综上,结合其它波谱数据,确定化合物1的平面结构如Fig.1所示。NOESY谱中无H-3和H-5的相关信号,说明H-3和H-5在不同平面,其相对构型如Fig.1所示。经查阅文献[4],确认该化合物为8,9-didehydro-7-hydroxydolichodial,为一新的天然产物,其核磁共振波谱数据见Table 1。化合物1的核磁及其它相关详细结构鉴定数据原始图谱可从本刊官网免费下载(WWW.trcw.ac.cn)。
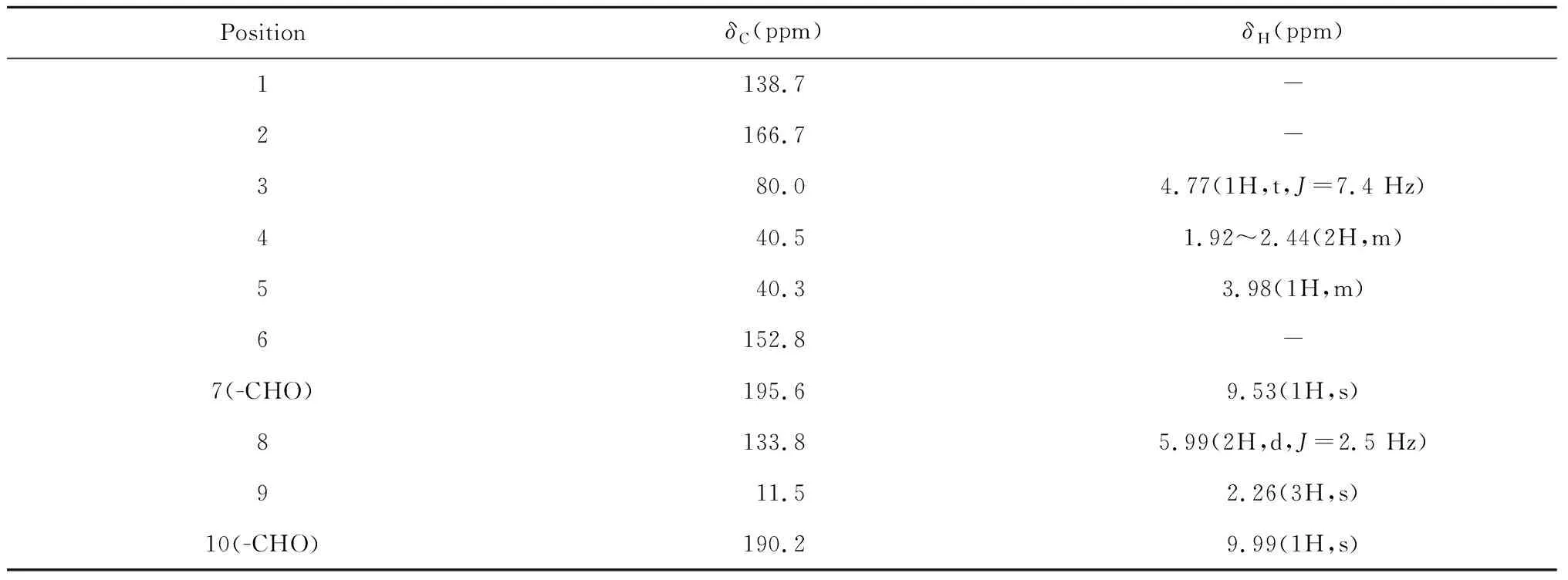
表1 化合物1的碳、氢谱数据Table 1 1H (600 MHz) and 13C NMR (150 MHz) spectral data of compound 1 in CD3OD
化合物2无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:2.01(1H,dd,J=13.5,6.9 Hz,H-6′a),2.10~2.25(3H,overlap,H-4′,6′b),3.69(3H,s,H-8′),3.74(1H,dd,J=7.5,3.1 Hz,H-2′),4.14(1H,dt,J=6.8,3.4 Hz,H-5′),5.28(1H,td,J=7.5,4.6 Hz,H-1′),6.22(1H,d,J=15.9 Hz,H-8),6.78(1H,d,J=8.2 Hz,H-5),6.95(1H,dd,J=8.2,2.0 Hz,H-6),7.04(1H,d,J=2.0 Hz,H-2), 7.52(1H,d,J=15.9 Hz,H-7);13C NMR(100 MHz,CD3OD)δ:37.7(C-4′),37.9(C-6′),52.9(C-8′),70.2(C-5′),72.0(C-1′),72.5(C-2′),75.7(C-3′),115.0(C-8),115.0(C-2),116.5(C-5),122.9(C-6),127.6(C-1),146.8(C-4),147.1 (C-7),149.6(C-3),168.2(C-9),175.4(C-7′)。以上数据与文献[5]报道基本一致,故鉴定化合物2为convoldorine。
化合物3白色针晶(甲醇);1H NMR(600 MHz,CD3OD)δ:2.02~2.11(2H,m,H-2),2.16~2.25(2H,m,H-6),3.73(1H,dd,J=8.4,3.1 Hz,H-4),4.17(1H,m,H-5),5.33(1H,td,J=9.0,4.4 Hz,H-3),6.33(1H,d,J=15.9 Hz,H-8′),6.81(2H,d,J=8.6 Hz,H-3′,5′),7.47(2H,d,J=8.6 Hz,H-2′,6′),7.63(1H,d,J=15.9 Hz,H-7′);13C NMR(150 MHz,CD3OD)δ:38.2(C-6),38.7(C-2),71.2(C-5),72.0(C-3),73.4(C-4),76.1(C-1),115.8(C-8′),116.8(C-3′,5′),127.2(C-1′),131.1(C-2′,6′),146.6(C-7′),161.2(C-4′),168.6(C-9′),177.0(C-7)。以上数据与文献[6]报道基本一致,故鉴定化合物3为3-O-p-香豆酰奎尼酸。
化合物4淡黄色针状结晶(甲醇);1H NMR(600 MHz,CDCl3)δ:3.95(3H,s,3-OCH3),6.02(1H,s,4-OH),6.59(1H,dd,J=15.8,7.7 Hz,H-8),6.96(1H,d,J=8.2 Hz,H-5),7.07(1H,d,J=1.9 Hz,H-2),7.12(1H,dd,J=8.2,1.9 Hz,H-6),7.40(1H,d,J=15.8 Hz,H-7),9.65(1H,d,J=7.7 Hz,H-9);13C NMR(150 MHz,CDCl3)δ:56.1(3-OCH3),109.5(C-2),115.0(C-5),124.2(C-6),126.5(C-8),126.8(C-1),147.0(C-3),149.0(C-4),153.2(C-7),193.7(C-9)。以上数据与文献[7]报道基本一致,故鉴定化合物4为松柏醛。
化合物5黄色粉末(甲醇);1H NMR(600 MHz,CD3OD)δ:3.89(6H,s,3,5-OCH3),6.68(1H,dd,J=15.7,7.8 Hz,H-8),6.99(2H,s,H-2,6),7.57(1H,d,J=15.7 Hz,H-7),9.58(1H,d,J=7.8 Hz,H-9);13C NMR(150 MHz,CD3OD)δ:56.8(3,5-OCH3),107.2(C-2,6),126.4(C-1),127.0(C-8),140.7(C-4),149.5(C-3,5),156.4(C-7),196.0(C-9)。以上数据与文献[8]报道基本一致,故鉴定化合物5为芥子醛。
化合物6无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:3.74(1H, dd,J=11.7,5.2 Hz,H-9a),3.88(1H,dd,J=8.9,2.7 Hz,H-9b),3.91(3H,s,3-OCH3),5.11(1H,dd,J=5.0,3.9 Hz,H-8),6.88(1H,d,J=8.1 Hz,H-5),7.58(1H,m,H-6),7.60(1H,d,J=2.0 Hz,H-2);13C NMR(100 MHz,CD3OD)δ:56.4(3-OCH3),66.2(C-9),75.4(C-8),112.4(C-2),115.9(C-5),125.0(C-6),128.0(C-1),149.2(C-3),153.7(C-4),199.5(C-7)。以上数据与文献[9]报道基本一致,故鉴定化合物6为C-藜芦酰乙二醇。
化合物7无色结晶(甲醇);1H NMR(400 MHz,CD3OD)δ:3.75(1H,dd,J=11.6,5.2 Hz,H-3a),3.88(1H,d,J=3.8 Hz,H-3b),3.91(6H,s,-OCH3×2),5.14(1H,dd,J=4.8,4.0 Hz,H-2),7.35(2H,s,H-2′,6′);13C NMR(100 MHz,CD3OD)δ:56.9(-OCH3×2),66.2(C-3),75.5(C-2),107.7(C-2′,6′),126.6(C-1′),143.0(C-4′),149.1(C-3′,5′),199.6(C-1)。以上数据与文献[10]报道基本一致,故鉴定化合物7为2,3-dihydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)-1-propanone。
化合物8白色针晶(甲醇);1H NMR(400 MHz,CD3OD)δ:3.91(3H,s,-OCH3),6.20(1H,d,J=9.4 Hz,H-3),6.76(1H,s,H-8),7.10(1H,s,H-5),7.85(1H,d,J=9.4 Hz,H-4);13C NMR(100 MHz,CD3OD)δ:56.7(-OCH3),103.9(C-8),109.8(C-5),112.5(C-10),112.6(C-3),146.1(C-4),147.0(C-6),151.4(C-9),152.9(C-7),164.0(C-2)。以上数据与文献[8]报道基本一致,故鉴定化合物8为莨菪亭(6-甲氧基-7-羟基香豆素)。
化合物9白色粉末(甲醇);1H NMR(400 MHz,CD3OD)δ:3.40(1H,dd,J=12.2,6.0 Hz,H-4′),3.47~3.60(3H,overlap,H-2′,3′,5′),3.70(1H,dd,J=12.1,5.7 Hz,H-6′),3.91(1H,dd,J=12.1,2.2 Hz,H-6′),3.91(3H,s,-OCH3),5.07(1H,d,J=7.3 Hz,H-1′),6.31(1H,d,J=9.5 Hz,H-3),7.18(1H,s,H-8),7.21(1H,s,H-5),7.90(1H,d,J=9.5 Hz,H-4);13C NMR(100 MHz,CD3OD)δ:57.0(-OCH3),62.3(C-6′),71.1(C-4′),74.6(C-2′),77.8(C-3′),78.3(C-5′),102.0(C-1′),105.1(C-8),110.7(C-5),114.5(C-3,10),114.6(C-10),145.6(C-4),148.2(C-7),150.6(C-9),151.7(C-6),163.5(C-2)。以上数据与文献[11]报道基本一致,故鉴定化合物9为异莨菪苷。
化合物10白色固体(甲醇);1H NMR(600 MHz,CD3OD)δ:3.37~3.55(4H,m,H-2′,3′,4′,5′),3.72(1H,dd,J=12.0,5.9 Hz,H-6′a),3.94(1H,dd,J=12.0,2.1 Hz,H-6′b),4.84(1H,d,J=7.7 Hz,H-1′),6.21(1H,d,J=9.4 Hz,H-3),6.80(1H,s,H-8),7.43(1H,s,H-5),7.84(1H,d,J=9.5 Hz,H-4);13C NMR(150 MHz,CD3OD)δ:62.5(C-6′),71.3(C-4′),74.8(C-2′),77.5(C-5′),78.5(C-3′),104.2(C-1′),104.5(C-8),112.6(C-10),112.9(C-3),116.5(C-5),144.5(C-6),146.0(C-4),152.6(C-9),153.6(C-7),163.7(C-2)。以上数据与文献[12]报道基本一致,故鉴定化合物10为七叶苷。
化合物11黄色粉末(甲醇);1H NMR(400 MHz,DMSO-d6)δ:1.06(3H,d,J=6.2 Hz,Rha-CH3),1.12(3H,d,J=5.1 Hz,Rha-CH3),4.41(1H,s,H-1′′′),5.36(1H,d,J=7.7 Hz,H-1′′),5.55(1H,s,H-1′′′′),6.44(1H,d,J=2.1 Hz,H-6),6.78(1H,d,J=2.1 Hz,H-8),6.83(1H,d,J=8.5 Hz,H-5′),7.57(1H,d,J=2.2 Hz,H-2′),7.69(1H,dd,J=8.5,2.2 Hz,H-6′),12.59(1H,s,C5-OH);13C NMR(100 MHz,DMSO-d6)δ:18.3(C-6′′′,6′′′′),65.4(C-6′′),68.4(C-5′′′),68.7(C-4′′),70.2(C-5′′′′),70.5(C-2′′′′),70.7(C-2′′′),70.8(C-3′′′),71.0(C-3′′′′),71.5(C-2′′),72.0(C-4′′′′),72.3(C-4′′′),73.4(C-3′′),74.0(C-5′′),94.8(C-8),98.8(C-1′′′′),99.8(C-6),100.3(C-1′′′),102.2(C-1′′),105.9(C-10),115.6(C-2′),116.5(C-5′),121.3(C-1′),122.5(C-6′),134.2(C-3),145.3(C-3′),149.1(C-4′),156.3(C-9),157.3(C-2),161.3(C-5),162.0(C-7),178.0(C-4)。以上数据与文献[13]报道基本一致,故鉴定化合物11为clovin。
化合物12黄色粉末(甲醇);1H NMR(600 MHz,DMSO-d6)δ:1.05(3H,d,J=6.2Hz,5′′′-CH3),1.12(3H,d,J=6.2 Hz,5′′′′-CH3),4.40(1H,s,H-1′′′),5.36(1H,d,J=7.7 Hz,H-1′′),5.55(1H,d,J=1.3 Hz,H-1′′′′),6.45(1H,d,J=2.1 Hz,H-6),6.81(1H,d,J=2.1 Hz,H-8),6.87(2H,d,J=8.9 Hz,H-3′,5′),8.10(2H,d,J=8.9 Hz,H-2′,6′),12.57(1H,s,C5-OH);13C NMR(150 MHz,DMSO-d6)δ:17.8(C-6′′′),17.8(C-6′′′′),65.2(C-6′′),67.9(C-5′′′),68.2(C-4′′),69.7(C-5′′′′),70.0(C-2′′′′),70.2(C-3′′′′),70.3(C-2′′′),70.5(C-3′′′),71.0(C-2′′),71.5(C-4′′′′),71.8(C-4′′′),72.9(C-3′′),73.5(C-5′′),94.5(C-8),98.4(C-1′′′′),99.3(C-6),99.9(C-1′′′),101.8(C-1′′),105.5(C-10),115.0(C-3′,5′),120.6(C-1′),131.0(C-2′,6′),133.5(C-3),155.9(C-2),157.0(C-9),160.0(C-4′),160.8(C-5),161.5(C-7),177.6(C-4)。以上数据与文献[14]报道基本一致,故鉴定化合物12为robinin。
化合物13无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:3.21~3.38(4H,m,H-2′,3′,4′,5′),3.69(1H,dd,J=11.9,5.5 Hz,H-6′a),3.90(1H,dd,J=11.9,1.9 Hz,H-6′b),4.35(1H,d,J=7.7 Hz,H-1′),4.67(1H,d,J=11.8 Hz,H-7a),4.94(1H,overlap,H-7b),7.27(1H,m,H-4),7.33(2H,t,J=7.3 Hz,H-3,5),7.42(2H,d,J=7.1 Hz,H-2,6);13C NMR(100 MHz,CD3OD)δ:62.8(C-6′),71.6(C-4′),71.7(C-7),75.1(C-2′),78.0(C-3′),78.0(C-5′),103.2(C-1′),128.6(C-4),129.2(C-2,6),129.2(C-3,5),139.0(C-1)。以上数据与文献[15]报道基本一致,故鉴定化合物13为苄基葡萄糖苷。
化合物14无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:3.21~3.43(4H,m,H-2′,3′,4′,5′),3.59(2H,s,H-5′′),3.63(1H,dd,J=11.2,6.2 Hz,H-6′a),3.78(1H,d,J=9.6 Hz,H-4′′),3.94(1H,d,J=2.5 Hz,H-2′′),3.97~4.04(2H,overlap,H-4′′,6′),4.33(1H,d,J=7.7 Hz,H-1′),4.66(1H,d,J=11.8 Hz,H-7a),4.90(1H,overlap,H-7b),5.05(1H,d,J=2.5 Hz,H-1′′),7.27(1H,m,H-4),7.34(2H,m,H-3,5),7.43(2H,d,J=7.0 Hz,H-2,6);13C NMR(100 MHz,CD3OD)δ:65.5(C-5′′),68.6(C-6′),71.7(C-7),71.8(C-4′),74.9(C-2′),75.1(C-4′′),77.0(C-5′),78.0(C-3′,2′′),80.5(C-3′′),103.1(C-1′),111.0(C-1′′),128.7(C-4),129.2(C-3,5),129.3(C-2,6),138.9(C-1)。以上数据与文献[16]报道基本一致,故鉴定化合物14为淫羊藿次苷F2。
化合物15无色粘稠固(甲醇);1H NMR(400 MHz,CD3OD)δ:2.94(2H,m,H-7),3.18(1H,dd,J=9.0,7.9 Hz,H-5′),3.24~3.29(2H,m,H-2′,4′),3.33~3.37(1H,m,H-3′),3.66(1H,dd,J=11.8,5.3 Hz,H-6′a),3.75(1H,m,H-8a),3.86(1H,dd,J=11.9,1.7 Hz,H-6′b),4.09(1H,m,H-8b),4.30(1H,d,J=7.8 Hz,H-1′),7.17(1H,m,H-4),7.25(4H,overlap,H-2,3,5,6);13C NMR(100 MHz,CD3OD)δ:37.2(C-7),62.7(C-6′),71.6(C-4′),71.7(C-8),75.1(C-2′),77.9(C-3′),78.1(C-5′),104.3(C-1′),127.2(C-4),129.3(C-2,6),130.0(C-3,5),140.0(C-1)。以上数据与文献[17]报道基本一致,故鉴定化合物15为2-苯乙基-1-O-β-D-葡萄糖苷。
化合物16无色粘稠固体(甲醇);1H NMR(600 MHz,CD3OD)δ:2.94(2H,m,H-7),3.17(1H,dd,J=9.1,7.9 Hz,H-2′),3.27(1H,m,H-4′),3.34(1H,m,H-3′),3.40(1H,ddd,J=9.5,6.1,1.9 Hz,H-5′),3.56(2H,s,H-5′′),3.60(1H,dd,J=11.2,6.2 Hz,H-6′),3.74~3.79(2H,m,H-8,4′′),3.90(1H,d,J=2.4 Hz,H-2′′),3.96(1H,d,J=9.7 Hz,H-4′′),3.98(1H,dd,J=11.2,1.9 Hz,H-6′),4.05(1H,ddd,J=9.7,7.9, 6.9 Hz,H-8),4.29(1H,d,J=7.8 Hz,H-1′),5.00(1H,d,J=2.5 Hz,H-1′′),7.17(1H,m,H-4),7.26(4H,d,J=4.4 Hz,H-2,3,5,6);13C NMR(150 MHz,CD3OD)δ:37.2(C-7),65.5(C-5′′),68.6(C-6′),71.7(C-8),71.8(C-4′),74.9(C-2′),75.0(C-4′′),76.9(C-5′),77.9(C-3′),78.0(C-2′′),80.5(C-3′′),104.4(C-1′),110.9(C-1′′),127.1(C-4),129.3(C-3,5),130.0(C-2,6),140.0(C-1)。以上数据与文献[17]报道基本一致,故鉴定化合物16为淫羊藿次苷D1 。
化合物17橙红色针晶(丙酮);1H NMR(400 MHz,DMSO-d6)δ:2.41(3H,d,J=1.9 Hz,6-CH3),6.57(1H,dd,J=3.8,2.4 Hz,H-2),7.10(1H,dd,J=4.9,2.3 Hz,H-4),7.16(1H,d,J=4.5 Hz,H-7),7.48(1H,d,J=5.6Hz,H-5),12.06(2H,overlap,1-OH,8-OH);13C NMR(100 MHz,DMSO-d6)δ:21.5(6-CH3),107.9(C-2),108.8(C-4),108.9(C-9a),113.4(C-8a),120.4(C-5),124.1(C-7),132.8(C-10a),135.0(C-4a),148.1(C-6),161.4(C-8),164.4(C-1),165.8(C-3),181.4(C-10),189.5(C-9)。以上数据与文献[18]报道基本一致,故鉴定化合物17为大黄素。
化合物18白色粉末(CH2Cl2);1H NMR(600 MHz,CDCl3)δ:0.68(3H,s,H-18),0.80~0.86(9H,ovelap,H-26,27,29),0.92(3H,d,J=6.5 Hz,H-21),1.01(3H,s,H-19),3.52(1H,m,H-3),5.35(1H,m,H-6);13C NMR(150 MHz,CDCl3)δ:12.0(C-18),12.1(C-29),18.9(C-21),19.1(C-27),19.5(C-19),19.9(C-26),21.2(C-11),23.2(C-28),24.4(C-15),26.2(C-23),28.3(C-16),29.2(C-25),31.8(C-2),32.0(C-8),32.0(C-7),34.0(C-22),36.2(C-20),36.6(C-10),37.4(C-1),39.9(C-12),42.4(C-13),42.4(C-4),45.9(C-24),50.2(C-9),56.2(C-17),56.9(C-14),71.9(C-3),121.8(C-6),140.9(C-5)。以上数据与文献[19]报道基本一致,故鉴定化合物18为β-谷甾醇。
化合物19白色粉末(CH2Cl2);1H NMR(400 MHz,DMSO-d6)δ:0.67(3H,s,25-CH3),0.74(3H,s,24-CH3),0.81(3H,d,J=6.4 Hz,30-CH3),0.86(3H,s,26-CH3),0.89(3H,s,27-CH3),0.91(3H,s,29-CH3),1.04(3H,s,23-CH3),2.10(1H,d,J=10.8 Hz,H-18),2.99(1H,m,H-3),4.30(1H,d,J=4.7 Hz,3-OH),5.12(1H,s,H-12),11.95(1H,s,-COOH);13C NMR(100 MHz,DMSO-d6)δ:15.2(C-24),16.1(C-25),16.9(C-29),17.0(C-26),18.0(C-6),21.0(C-30),22.8(C-11),23.2(C-27).23.8(C-16),27.0(C-2),27.5(C-15),28.2(C-23),30.1(C-21),32.7(C-7),36.3(C-10),36.5(C-22),38.2(C-1),38.3(C-20),38.4(C-19),38.5(C-4),41.6(C-8,14),46.8(C-9),47.0(C-17),52.3(C-18),54.7(C-5),76.8(C-3),124.5(C-12),138.2(C-13),178.3(C-28)。以上数据与文献[20]报道基本一致,故鉴定化合物19为熊果酸。
化合物20无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:1.29(3H,s,H-6),1.34(6H,d,J=2.3 Hz,3′-CH3×2),2.08(1H,dd,J=13.0,8.8 Hz,H-1),2.35(1H,dd,J=12.9,5.1 Hz,H-1),4.63(1H,dd,J=8.6,5.0 Hz,H-2),5.99(1H,s,H-4),6.43(1H,d,J=16.1 Hz,H-1′),6.67(1H,d,J=16.1 Hz,H-2′);13C NMR(100 MHz,CD3OD)δ:24.6(Me-6),29.5(Me-3′),29.6(Me-3′),46.5(C-1),66.9(C-2),71.5(C-3′),74.1(C-6),123.0(C-4),124.5(C-1′),148.0(C-2′),161.2(C-5),203.0(C-3)。以上数据与文献[21]报道基本一致,故鉴定化合物20为2α,6α-dihydroxy-5-[(E)-3′-hydroxy-3′-methyl-1′-butenyl]-6-methyl-4-cyclohexen-3-one。
化合物21无色晶体(甲醇);1H NMR(600 MHz,CD3OD)δ:1.28(3H,s,H-12),1.47(3H,s,H-11),1.53(1H,dd,J=14.4,3.7 Hz,H-6a),1.74(1H,overlap,H-8a),1.76(3H,s,H-10),1.99(1H,m,H-6b),2.42(1H,m,H-8b),4.21(1H,m,H-7),5.75(1H,s,H-3);13C NMR(150 MHz,CD3OD)δ:26.9(C-11),27.4(C-10),31.0(C-12),37.1(C-5),46.4(C-8),47.9(C-6),67.2(C-7),88.9(C-9),113.3(C-3),174.4(C-2),185.6(C-4)。以上数据与文献[22]报道基本一致,故鉴定化合物21为loliolide。
化合物22无色粘稠固体(甲醇);1H NMR(400 MHz,CD3OD)δ:1.29(1H,overlap,H-6a),1.29(3H,s,H-11),1.32(3H,s,H-12),1.42(1H,t,J=11.6 Hz,H-8a),1.59(3H,s,H-10),2.01(1H,ddd,J=13.1,4.3,2.2 Hz,H-6b),2.47(1H,ddd,J=11.7,4.0,2.2 Hz,H-8b),4.11(1H,m,H-7),5.78(1H,s,H-3);13C NMR(100 MHz,CD3OD)δ:25.3(C-11),25.7(C-10),30.3(C-12),36.1(C-5),48.8(C-8),50.7(C-6),65.2(C-7),88.5(C-9),113.7(C-3),173.9(C-2),183.8(C-4)。以上数据与文献[22]报道基本一致,故鉴定化合物22为isololiolide。
化合物23白色粉末(甲醇);1H NMR(400 MHz,CD3OD)δ:3.33~3.47(4H,m,H-2′,3′,4′,5′),3.66(1H,m,H-6′),3.70(3H,s,4-OCH3),3.81(6H,s,3,5-OCH3),3.90(1H,m,H-6′),4.81(1H,d,J=7.4 Hz,H-1′),6.49(2H,s,H-2,6);13C NMR(100 MHz,CD3OD)δ:56.5(3,5-OCH3),61.2(4-OCH3),62.7(C-6′),71.6(C-4′),74.9(C-2′),78.0(C-3′),78.4(C-5′),96.0(C-2,6),103.1(C-1′),134.3(C-4),154.7(C-3,5),156.0(C-1)。以上数据与文献[23]报道基本一致,故鉴定化合物23为3,4,5-三甲氧基苯酚-l-O-β-D-葡萄糖苷。
化合物24黄白色结晶(甲醇);1H NMR(400 MHz,CD3OD)δ:6.91(2H,d,J=8.6 Hz,H-3,5),7.77(2H,d,J=8.7 Hz,H-2,6),9.76(1H,s,-CHO);13C NMR(100 MHz,CD3OD)δ:116.8(C-3,5),130.2(C-1),133.4(C-2,6),165.2(C-4),192.8(-CHO)。以上数据与文献[18]报道基本一致,故鉴定化合物24为对羟基苯甲醛。
3.2 细胞毒活性筛选
对黄花败酱中分离得到的24个化合物在100 μM浓度下对HCT-116细胞毒活性进行筛选,考察了化合物1~24对HCT-116细胞活力的影响。与空白对照组对比,化合物1~24对HCT-116细胞活力均未显示出明显的抑制活性,实验结果详见图2。
4 结论
本文对黄花败酱二氯甲烷和乙酸乙酯部位进行了化学成分研究,从中分离鉴定了24个化合物,包括6个简单苯丙素类化合物(2~7)、3个香豆素类化合物(8~10)、2个黄酮苷类化合物(11和12)、2个苯甲醇苷类化合物(13和14)、2个苯乙醇苷类化合物(15、16)、1个醌类化合物(17)、1个甾体类化合物(18)、1个三萜类化合物(19)、6个其它类化合物(1和20~24)。其中化合物1为新天然产物,化合物2、3、5~7、9~17、20、22~24为首次从败酱属中分离得到。迄今为止,黄花败酱化学成分的研究成果多集中在三萜皂苷类成分[2,3],本文对于黄花败酱化学成分的研究,提供了黄花败酱和败酱属植物更为丰富的化学信息。据文献[24,25]报道,黄花败酱提取物对结直肠癌具有一定的治疗作用,但有关黄花败酱抗结肠癌活性的研究对象多为黄花败酱的醇或水提取物,对其药效物质基础研究甚少。本文对分离得到的24个化合物的细胞毒活性进行了研究,与空白对照组对比,化合物1~24对人结肠癌细胞HCT-116细胞活力均未显示出明显的抑制活性。对于黄花败酱抗结直肠癌药理作用的活性物质还有待进行进一步的研究,以期为黄花败酱的药用植物资源的开发利用提供实验数据和奠定一定的理论基础。
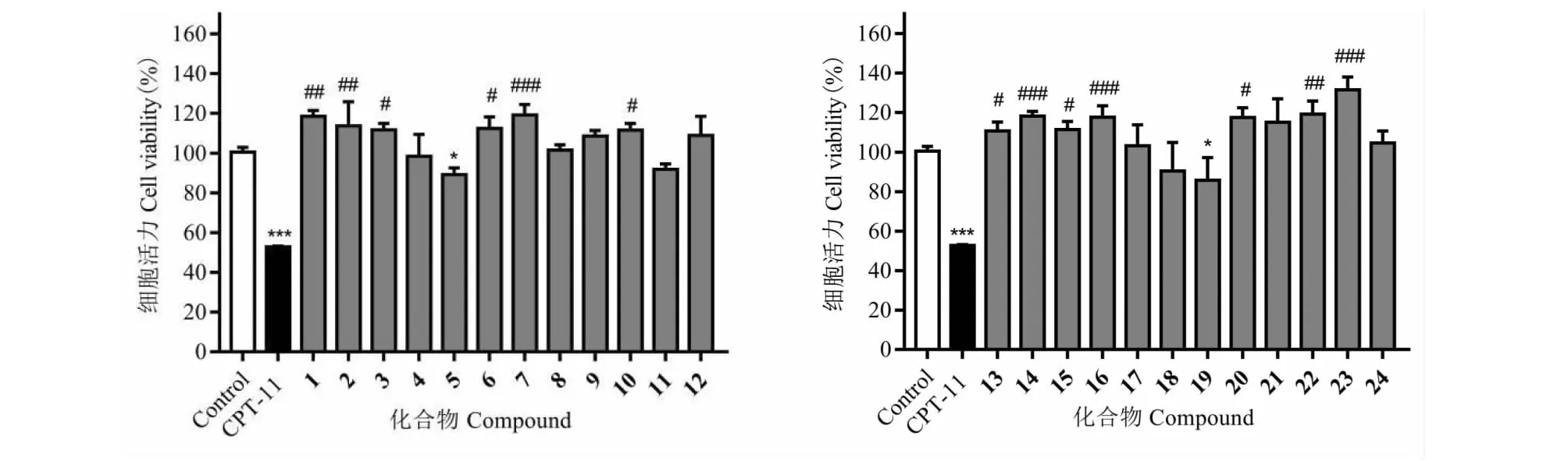
图2 化合物1~24对HCT-116细胞活力的影响Fig.2 Cell viability of HCT-116 cells owing to the compounds 1-24 注:抑制作用*,与空白对照组比较,*P≤0.05,***P≤0.001;促进作用#,与空白对照组比较,#P≤0.05,##P≤0.01,###P≤0.001。Note:*Inhibition,compared with control,*P≤0.05,***P≤0.001;#Promotion,compared with control,#P≤0.05,##P≤0.01,###P≤0.001.

