槲皮素对脑出血大鼠神经细胞凋亡与Bcl-2、Bax蛋白表达的作用研究
涂鄂文 陈琼 宁敏 王照

〔摘要〕 目的 通過观察大鼠脑出血后神经细胞凋亡与Bcl-2、Bax蛋白表达的动态变化及槲皮素的干预作用,探讨槲皮素可能的神经保护作用及机制。方法 以雄性健康SD大鼠通过自体血注入法制备大鼠脑出血模型,并随机分为假手术组、脑出血模型组、槲皮素低剂量组、槲皮素高剂量组,共4组,每组30只;槲皮素低剂量组和槲皮素高剂量组分别给予槲皮素10、50 mg/(kg·d)腹腔内注射,假手术组和脑出血模型组给予同等体积生理盐水腹腔内注射,每日1次,连续7 d;各组大鼠分别在术后第6小时、1天、2天、3天、7天通过前肢放置试验评分法评估神经功能缺损,采用TUNEL法检测血肿周围神经细胞凋亡,采用Western blot法检测血肿周围Bcl-2和Bax蛋白的表达情况。结果 与模型组比较,槲皮素低剂量组在脑出血后第3天、7天及槲皮素高剂量组在第2天、3天、7天的前肢放置试验评分和Bcl-2蛋白表达均明显增加(P<0.01);与模型组比较,槲皮素低剂量组在第3天、7天及槲皮素高剂量组在第1天、2天、3天、7天的神经细胞凋亡率和Bax蛋白表达均明显降低(P<0.01)。结论 槲皮素能减轻脑出血后神经功能损伤,其机制可能与上调Bcl-2蛋白表达,下调Bax蛋白表达,从而减少神经细胞凋亡有关。
〔关键词〕 脑出血;槲皮素;细胞凋亡;Bcl-2蛋白;Bax蛋白
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.05.009
〔Abstract〕 Objective To investigate the possible neuroprotective mechanism of quercetin by observing the intervention effect of quercetin and the dynamic change of expressions of Bcl-2 and Bax and neural cell apoptosis in rats with intracerebral hemorrhage. Methods The models of intracerebral hemorrhage were prepared by autologous blood injection in male healthy SD rats and randomly divided into 4 groups, including a sham operation group, an intracerebral hemorrhage model group, a quercetin low-dose group, and a quercetin high-dose group, with 30 rats in each group. The quercetin low-dose group and the quercetin high-dose group were given quercetin 10 mg/(kg·d) and 50 mg/(kg·d) intraperitoneal injection, respectively. The sham operation group and the intracerebral hemorrhage model group were given the same volume of normal saline once a day for 7 consecutive days. Forelimb placing test score was designed to assess the nerve functional at 6 h, 1 d, 2 d, 3 d and 7 d respectively. The apoptosis index of peripheral tissues was analyzed by TUNEL staining, and the expressions of Bcl-2 and Bax were detected by the method of Western blot. Results Compared with the model group, the quercetin low-dose group and the quercetin high-dose group, respectively in 3 d, 7 d and 2 d, 3 d, 7 d after intracerebral hemorrhage had significantly increased the forelimbs placement test scores and the Bcl-2 protein expressions (P<0.01); compared with the model group, the quercetin low-dose group and the quercetin high-dose group respectively in 3 d, 7 d and 1 d, 2 d, 3 d, 7 d, had significantly decreased apoptosis rate of nerve cells and the Bax proteins expressions (P<0.01). Conclusion Quercetin can relieve the neurologic impairment after cerebral hemorrhage, and its mechanism may be related to the up-regulation of Bcl-2 protein expressions and down-regulation of Bax protein expressions, thus reducing the apoptosis of nerve cells.
〔Keywords〕 intracerebral hemorrhage; quercetin; apoptosis; Bcl-2 protein; Bax protein
脑出血(intracerebral hemorrhage, ICH)指脑实质内自发性、非创伤性血管破裂,导致血液在脑实质内聚集,是常见的难治性脑血管疾病之一。目前针对ICH的治疗方法有限,且大多患者在接受治疗后仍然遗留有不同程度的神经功能损伤。神经细胞的凋亡、血管源性脑水肿以及血脑屏障破坏是ICH后3种明显的病理变化,其中神经细胞凋亡被认为是主要继发性脑损伤的病理变化之一,能够促进神经功能损伤进行性发展[1]。通过降低神经细胞凋亡从而减轻ICH后继发性神经功能损伤的治疗策略受到了越来越多研究者的关注。槲皮素是一种天然黄酮类化合物,在自然界各种植物的花、叶之中有着极为广泛分布。有研究表明槲皮素能通过抗炎[2]、抗氧化[3]、抗血栓[4]等作用减轻脑卒中后继发性脑损伤。本研究通过观察大鼠ICH后不同时间点神经细胞凋亡与Bcl-2、Bax蛋白表达情况以及给予不同剂量槲皮素干预后的变化,探讨槲皮素可能的神经保护作用及机制。
1 材料与方法
1.1 实验动物
采用8~12周龄、体质量250~300 g健康雄性成年清洁级SD大鼠(由湖南斯莱克景达实验动物有限公司提供,生产许可证号:SCXK(湘)2016-0002)建立脑出血模型,实验动物给予标准颗粒饲料和自来水分笼饲养,昼夜自然节律,将环境温度控制在(25±2)℃、相对湿度控制在60%±10%。
1.2 主要药物与试剂
Bcl-2多克隆抗体(货号:A00040-2)、Bax多克隆抗体(货号:A00183)、TUNEL试剂盒(货号:MK1022)、BCA蛋白浓度测定试剂盒(货号:AR0146)、β-actin内参抗体(货号:BA2305),以上均由武汉博士德生物工程有限公司提供;槲皮素(批号:wkq16063005,质量分数≥98%),由四川省维克奇生物科技有限公司提供。
1.3 主要仪器
Stoelting TL-2鼠脑定位仪、石蜡切片机(美国AO公司);显微外科手术器材、牙科钻(上海手术器械厂);TG 16-WS型台式高速离心机(长沙湘仪仪器有限公司);水平电泳槽、DYY-5型稳压温流电泳仪、恒温水浴摇床、多用脱色摇床(北京六一仪器厂提供);光学显微镜(日本OLYMPUS公司);图像采集系统(德国Leica显微成像系统);Image-Pro Plus 6.0图像分析系统(美国MediaCybernetics公司)。
1.4 造模與分组
参照RosenBerg等[5]的脑出血大鼠造模方法制备模型,大鼠经10%水合氯醛(400 mg/kg)腹腔注射麻醉后,俯卧位固定于Stoelting TL-2鼠脑定位仪上,使其前、后囟位于同一水平线上,沿头皮正中线上切一长约10 mm的纵切口,充分暴露前囟,然后定位于前囟前0.2 mm,正中线向右旁开3 mm处钻一小孔,直径为0.5 mm,进针约5.5 mm。斩断鼠尾取血100 μL,用微量进样器以10 μL/min的速度缓慢注入,注血结束后留针15~20 min,缓慢退针,用骨蜡封闭颅骨,缝合皮肤。假手术组(30只)于相同部位注入等量无菌0.9%氯化钠注射液。所有操作均在无菌条件下完成,术毕用60 w的白炽灯在距离大鼠50 cm高度持续照射直到大鼠清醒。大鼠清醒后进行前肢放置试验评分,评分低于80及出现对侧上肢向胸前屈曲和行走时对侧倾倒或向对侧转圈行为,说明造模成功。将造模成功的大鼠随机分为脑出血模型组、槲皮素低剂量组、槲皮素高剂量组,每组30只。根据实验取材的不同时间点,将上述4组组内大鼠各又随机分成 6 h、1 d、2 d、3 d、7 d 5个亚组,每个亚组6只。
于造模成功1 h后槲皮素低、高剂量组分别给予槲皮素10 mg/kg、50 mg/kg腹腔内注射,假手术组及脑出血组则用等量生理盐水代替处理,每天1次。
1.5 指标检测
1.5.1 神经功能缺损评估 参照Schallert等[6]的前肢放置试验评分法评估神经功能缺损:在实验台前抓住大鼠躯体,让其前肢自由悬挂在实验台上,用小刷子刺激大鼠手术侧的触须,未受损者可将对侧前肢迅速放到桌面,脑损伤时此动作有不同程度的损害。每只大鼠受测10次,对侧前肢正确放置于桌面次数的百分率即为该大鼠的评分。
1.5.2 神经细胞凋亡检测 前肢放置试验评分完成后,采用10%水合氯醛(400 mg/kg)腹腔内注射对大鼠进行麻醉,仰卧位固定,用生理盐水和多聚甲醛进行心脏灌流,断头取脑。以血肿穿刺针点为中心分别向前、后各移1.0 mm将脑组织冠状切开,取脑组织2块,1块放入-80 ℃冰箱保存备用,作Western blot检测,另1块常规石蜡包埋,切片,作TUNEL检测。
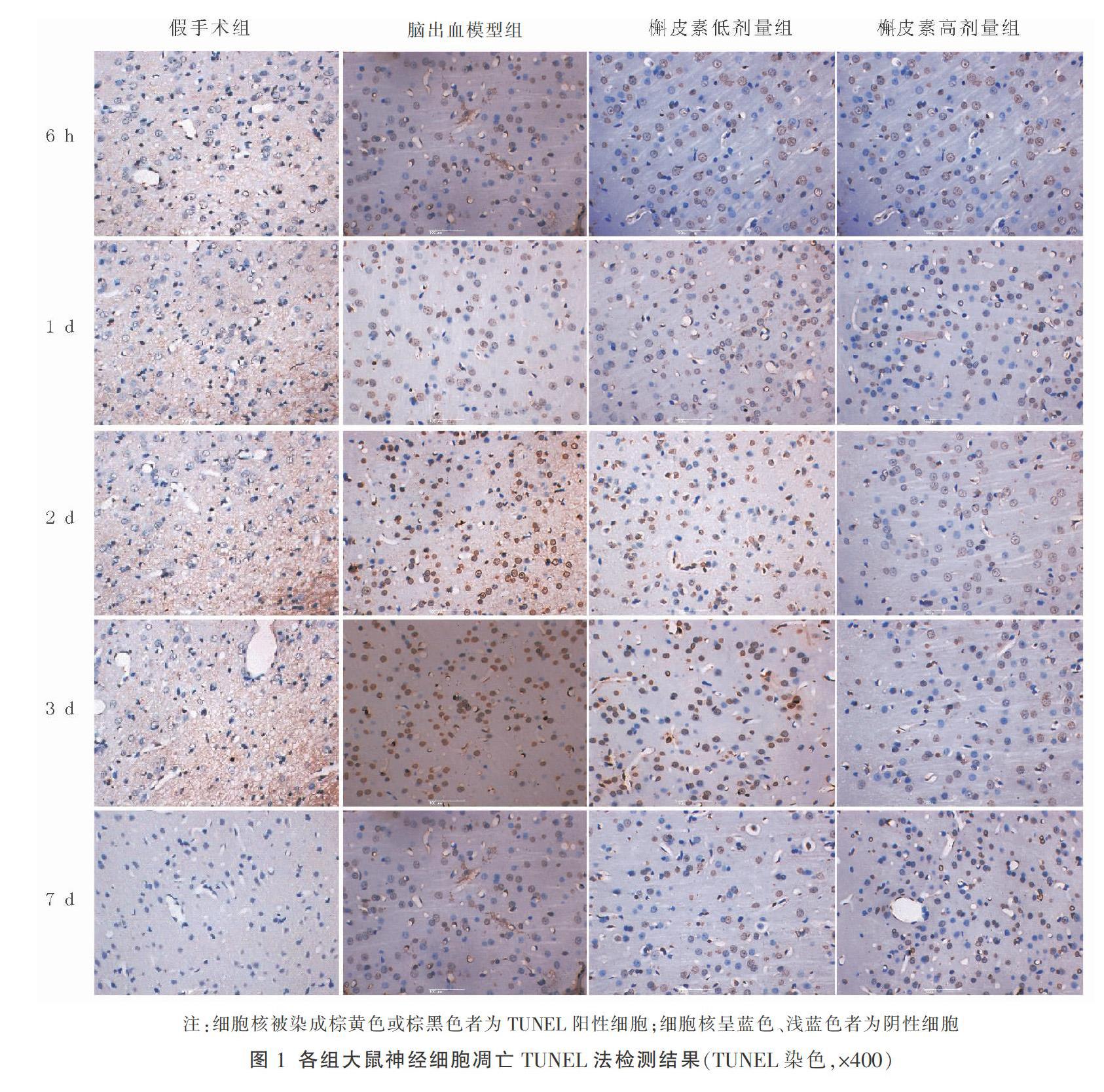
采用TUNEL法检测神经细胞凋亡:取上述脑组织切片,经脱蜡、脱水后,采用 TUNEL 法检测细胞凋亡,具体操作按试剂盒说明书进行。经过高倍镜(×400计数)显微镜观察。每只大鼠同一部位的脑组织切片取3张,然后每张脑组织切片再取2个不重叠的视野查看阳性细胞数,细胞核中有棕黄色颗粒者为阳性细胞,即凋亡细胞。凋亡细胞率=(凋亡细胞数/计数细胞总数)×100%。
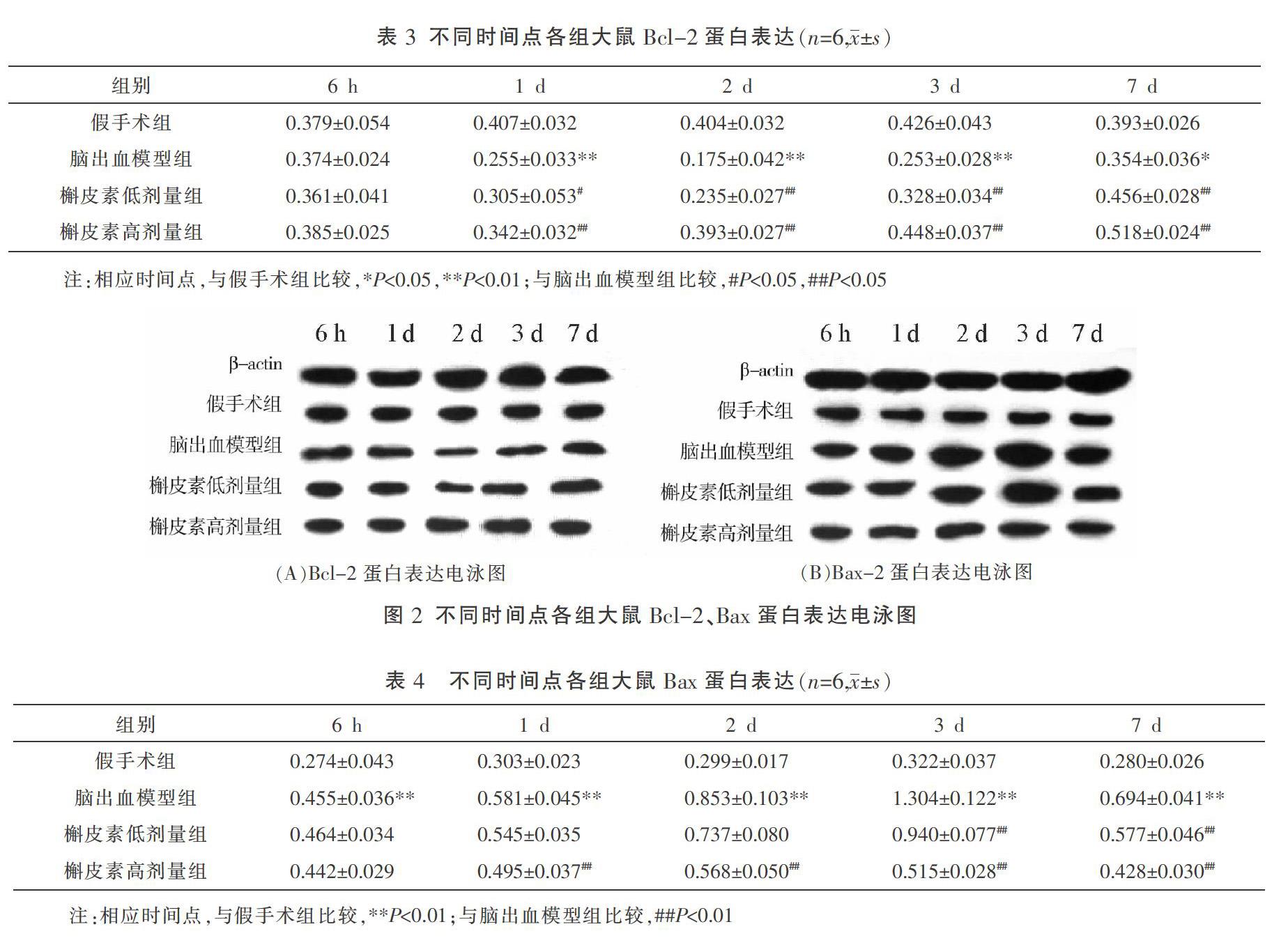
1.5.3 采用Western blot法检测Bcl-2、Bax蛋白表达 将-80 ℃保存的脑组织置于预冷的PBS中漂洗除尽组织表面血迹,称质量后放入机械匀浆器中,加入5倍体积量的裂解液,裂解完全,4 ℃离心收集上清液,采用BCA蛋白定量法测定裂解蛋白浓度。采用SDS-PAGE凝胶电泳,将电泳后的蛋白转移至经甲醇活化的PVDF膜上,加入封闭缓冲液室温振荡1 h,依次孵育一抗、二抗,化学发光法曝光显色。胶片用扫描仪将图像输入电脑,ImagePro-plus 6.0图像分析软件,β-actin蛋白作为内参照,计算Bcl-2蛋白和Bax蛋白吸光度值/内参照蛋白吸光度值的比值。
1.6 统计学方法
实验数据用SPSS 22.0统计软件分析,数据均以“x±s”表示,多组计量资料均数方差齐时应用ONE-WAY-ANOVA中LSD检验进行方差分析,方差不齐时应用非参数秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 槲皮素对脑出血大鼠神经功能损伤的影响
脑出血模型组在手术后6 h即出现严重的神经功能损伤,第3天评分最低,第3天至第7天损伤减轻,其在各时间点的评分均明显低于假手术组(P<0.01);槲皮素低、高剂量组的评分分别在术后第3天、7天和第2天、3天、7天均明显高于脑出血模型组(P<0.01)。结果见表1。
2.2 槲皮素对脑出血大鼠神经细胞凋亡的影响
脑出血模型组在手术后第6小时检测到大量凋亡神经细胞,第3天凋亡率达到高峰,第3天和第7天下降,各检测时间点的凋亡率均明显高于假手术组(P<0.01);槲皮素低、高剂量组的凋亡率分别在第2天、3天、7天和第1天、2天、3天、7天均明显低于脑出血模型组(P<0.05或P<0.01)。结果见表2和图1。
2.3 Western blot法检测槲皮素对脑出血大鼠Bcl-2、Bax蛋白表达的影响
脑出血模型组手术后第6小时至第2天Bcl-2蛋白的表达持续减少,第2天达到低峰,第2天至第7天表达增加,第1天、2天、3天、7天较假手术组表达明显偏低(P<0.01);在手术后第1天、2天、3天、7天4个时间点槲皮素低、高剂量组的表达均明显高于脑出血模型组(P<0.05或P<0.01)。结果见表3和图2(A)。
脑出血模型组在手术后第6小时即检测到大量Bax蛋白表达,第3天达到高峰,第3天至第7天表达减少,各检测时间点的表达均明显高于假手术组(P<0.01);槲皮素低、高剂量组的表达分别在第3天、7天和第1天、2天、3天、7天明显低于脑出血模型组(P<0.01)。结果见表4和图2(B)。
3 讨论
细胞凋亡亦称程序性细胞死亡,与细胞的正常发育有关,使得损坏细胞或者机能紊乱细胞的自我毁损能够在一种可控的方式下进行,是机体在生长、发育和受到外来刺激时,清除衰老和受损伤细胞以保持机体内环境平衡的一种自我调节机制[7]。近10余来年,有一系列针对ICH动物模型及人脑组织标本的研究均证实了ICH后血肿周围组织中存在大量凋亡的神经细胞[8-9]。神经细胞凋亡是血肿周围神经细胞死亡的主要方式,也是继发性神经功能损害的主要表现形式,能诱发神经功能损伤的进行性发展。揭示脑出血后神经细胞凋亡的时相变化规律,是实施药物治疗的基础和依据。本研究发现,大鼠脑出血后第6小时即检测出较多凋亡的神经细胞,并于第1天、2天呈进行性加重,第3天细胞凋亡率达高峰,第3天至第7天缓慢降低,研究结果与CHEN等[10]研究的结果较一致。在测定ICH大鼠前肢放置试验评分和血肿周围神经细胞凋亡率的基础上采用双变量Pearson相关系数分析法对二者进行相关性分析发现,二者呈负相关关系(r=0.939,P<0.05),即ICH后神经功能缺损程度与神经细胞的凋亡率呈正相关关系。研究结果进一步证实,神经细胞凋亡参与了ICH后继发性脑损伤过程,降低神经细胞凋亡可作为ICH临床治疗的一种治疗策略。从降低ICH后神经细胞凋亡的治疗角度,结合ICH后神经细胞凋亡的变化规律分析,ICH后越早进行药物干预所取得治疗效果越理想。
ICH后继发性脑损伤导致神经细胞凋亡的机制非常复杂,其中,分别由线粒体和死亡受体介导的“内源性”及“外源性”凋亡途径,是目前被普遍接受的细胞凋亡的两条途径[11]。线粒体介导的内源性凋亡途径是哺乳动物细胞凋亡的主要途径,也是目前研究凋亡的热点;在该途径中,Bcl-2家族蛋白中促凋亡和抗凋亡蛋白相互作用,调控着线粒体结构及功能的稳定性,在细胞凋亡的进程中起着至关重要的作用[12]。当细胞受到损伤因素刺激后,Bax蛋白转移至线粒体的外膜上,通过形成Bax/Bax同源二聚体在线粒体平面脂双层中能形成孔道及参与线粒体通透性转变孔道(permeability transition pore, PTP)的开放,引起Cyt C、凋亡诱导因子和核酸内切酶G等被释放到细胞质中,诱发细胞凋亡[13-14]。Bcl-2蛋白可与Bax蛋白结合形成稳定的Bcl-2/Bax异源二聚体,从而维持Bax等促凋亡蛋白在细胞内的定位与分布,维持线粒体膜稳定,防止促凋亡相关蛋白、Cyt C等泄漏至细胞质,阻断细胞发生凋亡[15]。Bax蛋白、Bcl-2蛋白对细胞凋亡的调控不仅与其自身表达量有关,也与两者之间的比值变化密切相关,Bcl-2/Bax蛋白比值增加,细胞趋向于存活;Bcl-2/Bax蛋白比值降低,细胞趋向于凋亡。本研究发现,大鼠脑出血后第6小时至第2天Bcl-2蛋白的表达持续减少,第2天达到低峰;同时在出血后第6小时即检测到大量Bax蛋白表达,第3天达到高峰;第6小时至第2天血肿周围Bcl-2/Bax蛋白的比值降低,第3小时至第7天比值升高,结果与Lu等[16]和Chen等[17]研究結果较一致。进一步的采用双变量Pearson相关系数分析法对神经细胞凋亡率与Bcl-2/Bax蛋白比值之间进行相关性分析发现,二者呈负相关关系(r=0.880,P<0.05)。研究提示,Bcl-2、Bax蛋白表达改变可能是脑出血后导致神经细胞凋亡的机制之一;干预Bcl-2、Bax蛋白表达,有望降低脑出血后神经细胞凋亡,减轻继发性神经功能损伤。
研究表明,槲皮素可通过降低脂质过氧化产物丙二醛含量和提高超氧化物歧化酶活性,减少氧化诱导的细胞凋亡[18];可通过增加抗凋亡Bcl-2蛋白表达、降低促凋亡Bax蛋白表达及Caspase-3活性,减少经线粒体途径介导的细胞凋亡[19]。本研究以槲皮素干预后对ICH大鼠血肿周围神经细胞凋亡与Bcl-2、Bax蛋白表达的影响为切入点展开研究。结果显示,与脑出血模型组相比,不同剂量槲皮素干预后Bcl-2蛋白表达增加,Bax蛋白表达下降,Bcl-2/Bax蛋白比值增加,神经细胞凋亡率下降,神经功能缺损评分降低,且在较多的检测时间点上高剂量组各指标均明显优于低剂量组,表现出一定的量效关系。综上所述,槲皮素对脑出血大鼠干预后可通过提高Bcl-2蛋白表达、降低Bax蛋白表达,使Bcl-2/Bax蛋白比值增加,从而降低神经细胞凋亡,减轻神经功能损伤,对脑出血表现出一定的治疗效果和应用前景。
參考文献
[1] LI L, KE K, TAN X, et al. Up-regulation of NFATc4 involves in neuronal apoptosis following intracerebral hemorrhage[J]. Cellular and Molecular Neurobiology, 2013, 33(7):893-905.
[2] ZHANG Y, YI B, MA J, et al. Quercetin promotes neuronal and behavioral recovery by suppressing inflammatory response and apoptosis in a rat model of intracerebral hemorrhage[J]. Neurochemical Research, 2015, 40(1):195-203.
[3] BAHAR E, KIM J Y, YOON H. Quercetin attenuates manganese-induced neuroinflammation by alleviating oxidative stress through regulation of apoptosis, iNOS/NF-κB and HO-1/Nrf2 pathways[J]. International Journal of Molecular Sciences, 2017, 18(9):1-19.
[4] HUBBARD G P, WOLFFRAM S, LOVEGROVE J A, et al. Ingestion ofquercetin inhibits platelet aggregation and essential componentsof the collagen-stimulated platelet activation pathway in humans[J]. Journal of Thrombosis Haemostasis: JTH, 2004, 2(12): 2138-2145.
[5] ROSENBERG G A, MUN-BRYCE S, WESLEY M, et al. Collagenase induced intracerebral hemorrhage in rats[J]. Stroke, 1990, 21(5):801-807.
[6] SCHALLERT T, FLEMING S M, LEASURE J L, et al. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury[J]. Neuropharmacology, 2000, 39(1):777-787.
[7] HENGARTNER M O. The biochemistry of apoptosis[J]. Nature, 2000, 407(6805):770-776.
[8] LIU Z C, MENG L Q, SONG J H, et al. Dynamic protein expression of NF-κB following rat intracerebral hemorrhage and its association with apoptosis[J]. Experimental and Therapeutic Medicine, 2018, 16(5): 3903-3908.
[9] WANG Z, ZHOU F, DOU Y, et al. Melatonin alleviates intracerebral hemorrhage-Induced secondary brain Injury in rats via suppressing apoptosis, inflammation, oxidative stress, DNA damage, and mitochondria injury[J]. Translational Stroke Research, 2018, 9(1): 74-91.
[10] CHEN J C. The effects of acupuncture and traditional Chinese medicines on apoptosis of brain tissue in a rat intracerebral hemorrhage model[J]. Physiology & Behavior, 2015,1(151):421-425.
[11] SAVITSKAYA M A, ONISHCHENKO G E. Mechanisms of Apoptosis[J]. Biochemistry(Moscow), 2015, 80(11):1393-1405.
[12] VOLKMANN N, MARASSI F M, NEWMEYER D D, et al. The rheostat in the membrane: BCL-2 family proteins and apoptosis[J]. Cell Death and Differentiation, 2014, 21(2):206-215.
[13] KUMARI A, KAKKAR P, et al. Lupeol prevents acetaminopheninduced in vivo hepatotoxicity by altering the Bax/Bcl-2and oxidative stress-mediated mitochondrial signaling cascade[J]. Life Sciences, 2012, 90(15/16):561-570.
[14] WANG X. The expanding role of mitochondria in apoptosis[J]. Genes & Development, 2001, 15(22):922-933.
[15] CHENG E H, WEI M C, WEILER S, et a1. BCL-2, BCL-X(L) sequester BH3 domain-only molecules preventing BAx-and BAK-mediated mitochondrial apoptosis[J]. Molecular Cell, 2001, 8(3):705-711.
[16] LU H, SHEN J, SONG X, et al. Protective effect of pyrroloquinoline quinone (PQQ) in rat model of intracerebral hemorrhage[J]. Cellular and Molecular Neurobiology, 2015,35(7):921-930.
[17] CHEN J C. The effects of acupuncture and traditional Chinese medicines on apoptosis of brain tissue in a rat intracerebral hemorrhage model[J]. Physiology & Behavior, 2015,1(151):421-425.
[18] ZHI G C, QIAO L Y, GUANG R X, et al. Effects of quercetin on proliferation and H2O2-Induced apoptosis of intestinal porcine enterocyte cells[J]. Molecules, 2018, 23(8):1-25.
[19] BAHAR E, KIM J Y, YOON H. Quercetin attenuates manganese-induced neuroinflammation by alleviating oxidative stress through regulation of apoptosis, iNOS/NF-κB and HO-1/Nrf2 pathways[J]. International Journal of Molecular Sciences, 2017, 18(9):1-19.
(本文編辑 苏 维)

