miR-483/CREB1轴介导桃叶珊瑚苷抑制髓核细胞胞外基质降解的研究
杨少锋 朱立国 李兆勇 李硕夫 郭彦涛 聂颖 张晨阳

〔摘要〕 目的 研究miR-483/CREB1軸在桃叶珊瑚苷(aucubin, AU)抑制人退行性髓核(nucleus pulposus, NP)细胞胞外基质(extracellular matrix, ECM)降解中的功能作用。方法 AU处理人退行性NP细胞后,检测细胞活性、ECM相关蛋白及cAMP反应元件结合蛋白1(cAMP responsive element binding protein 1, CREB1)的表达。实时荧光定量PCR(quantitative real-time PCR, qPCR)和Western blot检测miR-483表达变化对CREB1丰度的影响;双荧光素酶报告实验(luciferase, LUC)检测miR-483和CREB1-3'-UTR的靶向结合;CREB1过表达载体和(或)miR-483 mimics共转染后,AU处理,检测CREB1及ECM相关蛋白的表达。结果 AU可显著增强NP细胞活性(P=0.000 4),抑制ECM降解酶基质金属蛋白酶-3(matrix metalloproteinase-3, MMP-3)、血小板反应蛋白解整合素金属肽酶-5(a disintegrin and metalloproteinase domain with thrombospondin motif-5, ADAMTS-5)与CREB1的表达,促进胶原蛋白Ⅱ型胶原α1(collagen type II alpha 1 chain, COL2A1)和miR-483的表达(P<0.001)。miR-483过表达可抑制CREB1的表达(P<0.000 1),LUC实验表明miR-483可与CREB1-3'-UTR靶向结合。功能实验结果表明CREB1可削弱AU对NP细胞ECM的降解的抑制作用,而miR-483可部分逆转CREB1对AU的抑制作用。结论 AU诱导NP细胞表达miR-483,进而抑制CREB1的表达,增强NP细胞的活性,抑制ECM的降解。
〔关键词〕 桃叶珊瑚苷;髓核细胞;胞外基质;cAMP反应元件结合蛋白;微小RNA
〔中图分类号〕R285.5;R681.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.05.008
〔Abstract〕 Objective To study the functional role of miR-483/CREB1 axis in the inhibition of extracellular matrix (ECM) degradation in human degenerative nucleus pulposus (NP) cells by aucubin (AU). Methods After treatment of human degenerative NP cells with AU, cell viability, ECM-related protein and cAMP responsive element binding protein 1 (CREB1) expression were measured. Quantitative real-time PCR (QPCR) and western blot were used to detect the effect of miR-483 expression on CREB1 abundance; dual luciferase reporter assay (LUC) was used to detect the targeted binding relationship between miR-483 and CREB1-3-TUR; The CREB1 overexpression vector and/or miR-483 mimics were co-transfected into NP cells, and the expression of CREB1 and ECM-related proteins was detected after AU treatment. Results AU significantly enhanced the activity of NP cells (P=0.000 4), inhibited the expression of EMP degrading enzyme matrix metalloproteinase-3 (MMP-3) (P=0.000 3), a disintegrin and metalloproteinase domain with thrombospondin motif-5 (ADAMTS-5) and CREB1 (P<0.000 1), and promoted the expression of collagen type II alpha 1 chain (COL2A1) (P<0.000 1) and miR-483 (P=0.000 6). Overexpression of miR-483 inhibited the expression of CREB1 (P<0.000 1). LUC experiments indicated that miR-483 can bind to the CREB1-3'-UTR. Functional experiment showed that CREB1 can attenuate the inhibitory effect of AU on the degradation of ECM in NP cells, while miR-483 partially reverses the inhibitory effect of CREB1 on AU. Conclusion AU induces the expression of miR-483 in NP cells, thereby inhibiting the expression of CREB1, ultimately enhancing the activity of NP cells and inhibiting the degradation of ECM.
〔Keywords〕 aucubin; nucleus pulposus cells; extracellular matrix; cAMP responsive element binding protein 1; miRNA
椎间盘退行性病变(intervertebral disc degeneration,IDD)是椎间盘突出、下腰痛、脊柱稳定性下降等脊柱病变的病理基础,由此导致患者因为严重腰痛而劳动能力下降甚至完全丧失[1]。当前有关IDD的发病机制研究显示,椎间盘中髓核(nucleus pulposus, NP)细胞凋亡以及胞外基质(extracellular matrix, ECM)的过度降解是导致IDD发生的主要原因[2]。
中药杜仲(Eucommia Ulmoides Oliv.)可增强骨密度、调节骨代谢[3],相关研究也证明其可用于治疗IDD、骨质疏松症和其他骨科疾病[4]。杜仲主要活性成分为桃叶珊瑚苷(aucubin, AU)。AU常用于治疗骨关节炎[5],并具有保护肝脏、抗炎、促进血管生成、抗氧化、促进神经干细胞分化等多种功能[6-7],但AU在IDD中的功能和作用机制还未见相关报道。
随着近年来对非编码RNA研究的日益深入,miRNA介导的转录后调控也被发现参与IDD发病过程[8]。miRNA是一种长度约22~25個核苷酸的内源性非编码单链RNA,可通过与靶基因mRNA的3-UTR区互补配对形成RNA诱导沉默复合体而抑制靶基因转录或诱使靶mRNA降解,从而调控靶基因表达[9]。本课题组研究发现,以杜仲为主药的补肾活血方可通过影响NP细胞中miR-483的表达促进NP细胞增殖和ECM重塑[10]。结合位点预测工具targetscan(www.targetscan.org/vert_72/)预测发现转录调控因子——cAMP反应元件结合蛋白1(cAMP responsive element binding protein 1, CREB1)可能是miR-483的结合靶点,因此,本项目拟进一步研究AU对NP细胞ECM重塑的影响及miR-483/CREB1轴在其中的功能作用。
1 材料与方法
1.1 实验材料
实验采用的退行性NP细胞分离自湖南中医药大学第一附属医院收治的IDD患者椎间盘组织[7]。细胞使用含有10%胎牛血清(GIBCO, USA)、链霉素和青霉素(Solarbio, 北京)的DMEM培养基(GIBCO, USA)培养。
miR-483 mimics/inhibitor、实时荧光定量PCR(quantitative real-time PCR, qPCR)引物及试剂均购自上海吉玛制药技术有限公司;基质金属蛋白酶-3(matrixmetalloproteinase-3, MMP-3)抗体(货号:ab52915)、血小板反应蛋白解整合素金属肽酶-5(a disintegrin and metalloproteinase domain with thrombospondinmotif-5, ADAMTS-5)抗体(货号:ab41037)、CREB1抗体(货号:ab32096)、Ⅱ型胶原α1(collagen type II alpha 1 chain, COL2A1)抗体(货号:ab34712)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(货号:ab8245)、HRP标记的羊抗兔(货号:ab205718)或羊抗小鼠(货号:ab205719)二抗均购自美国Abcam公司;98%AU标准品由江莱生物提供;MTT检测试剂盒购自生工生物工程(上海)股份有限公司;双荧光素酶报告实验(dual luciferase reporter gene assay, LUC)试剂盒、细胞培养和Western blot相关试剂购自上海碧云天生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养及转染 将DMEM培养基培养的NP细胞置于37 ℃、5%CO2的细胞培养箱中培养。转染时,取对数生长期的NP细胞接种至6孔细胞培养板,继续培养至60%~70%的细胞密度,遵照Lipofectamine 2000的使用说明书,转染miR-483 mimics。
1.2.2 MTT实验 使用磷酸缓冲盐溶液(phosphate buffer saline, PBS)溶解AU标准品以制备1 mmol/L的母液,再用PBS稀释AU母液制备不同浓度的工作液。收集对数期细胞,向96孔细胞培养板中加入细胞悬液,并保证每孔的细胞数约为1×104个。细胞单层铺满孔底后加入不同浓度的AU工作液,对照组则使用等体积的PBS,孵育24~72 h,倒置显微镜下观察,之后,每孔加入20 μL MTT溶液,培养4 h,并使用PBS漂洗。二甲基亚砜溶解后测定490 nm处的吸光值。
1.2.3 Western blot实验 分别使用AU(终浓度为16 μmol/L)和等体积的PBS(作为对照组)处理NP细胞,其后提取两组细胞中的总蛋白,BCA法测定MMP-3、ADAMTS-5、CREB1、COL2A1等蛋白的浓度,其后进行SDS-PAGE、转膜、封闭、洗膜,加入相应的蛋白一抗,4 ℃孵育12 h后洗膜,继而加入二抗,ECL显色,不同组别之间使用GAPDH作为内源性对照。
1.2.4 qPCR实验 使用TRIZOL试剂提取处于对数生长期的NP细胞中的总RNA,然后使用U6-R与miR-483-RT引物(见表1)分别进行反转录以获得qPCR检测模板。再按照程序进行qPCR反应,最后使用2-ΔΔCT的方法计算miR-483的表达水平。
1.2.5 荧光素酶报告质粒的构建 通过PCR扩增含有miR-483与CREB1结合位点上下游800 bp序列的CREB1基因片段到Renilla psiCHECK-2载体下游,并命名为wtCREB1荧光素酶报告质粒。其后在此基础上设计相应的引物对结合位点进行突变(见表1),得到mutCREB1荧光素酶报告质粒。
1.2.6 LUC实验 取对数生长期的NP细胞接种于24孔细胞培养板,培养12 h后,转染wt/mut CREB1荧光素酶报告质粒,同时分别转染miR-483 mimics及mimics NC,再培养48 h后,使用LUC检测试剂盒测定各组细胞中的荧光素酶相对活性。
1.3 数据统计分析
本实验所有数据均由统计软件SPSS 20.0分析处理,最终数据为3次平行重复实验的x±s,格拉布斯准则去除逸出值后,两两比较,先进行方差齐性Levene检验,若方差齐,采用LSD-t检验,不齐则采用t检验;多组间比较采用单因素方差分析,若方差齐,使用单因素方差分析进行总均值比较,而后采用SNK法进行两两比较,若方差不齐,改用Welch检验进行总体均值比较,而后采用Dunnett T3检验进行两两比较,P<0.05则认为差异具有统计学意义。
2 结果
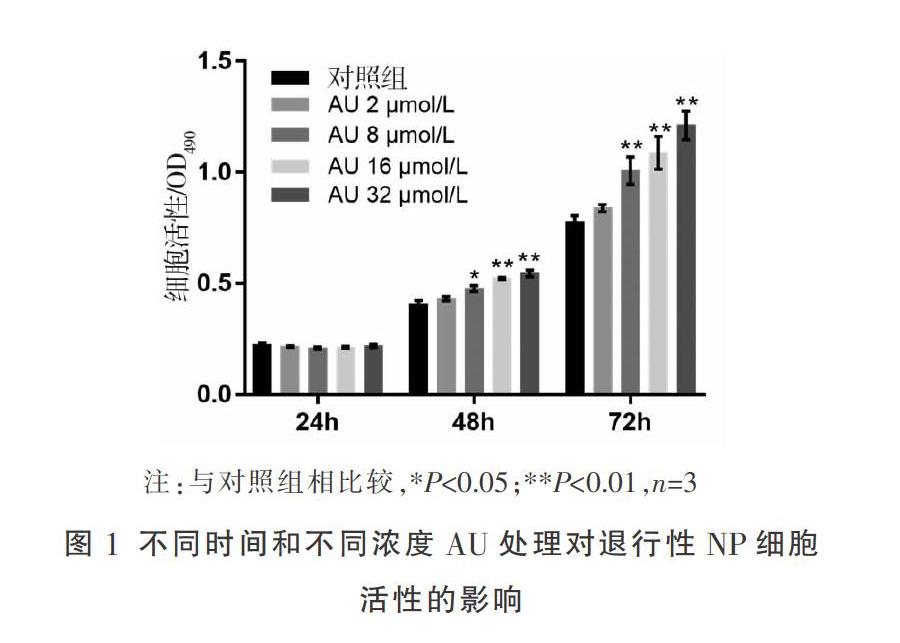
2.1 AU最佳處理时间和浓度的选择
分别使用0、2、8、16、32 μmol/L的AU处理退行性NP细胞24、48、72 h,其后MTT实验检测细胞活性。结果发现NP细胞的活性随着处理时间的延长和AU浓度的增高而增强,表明AU可提高NP细胞活性。此外,对照组和不同浓度的AU处理组在48 h时,OD490值分别为0.406±0.017、0.432±0.010、0.477±0.014、0.523±0.005、0.546±0.015。统计分析结果显示,48 h时16 μmol/L处理组与对照组之间存在极显著差异(P=0.000 4,见图1),因此选择16 μmol/L、处理48 h为后续实验中AU干预条件。
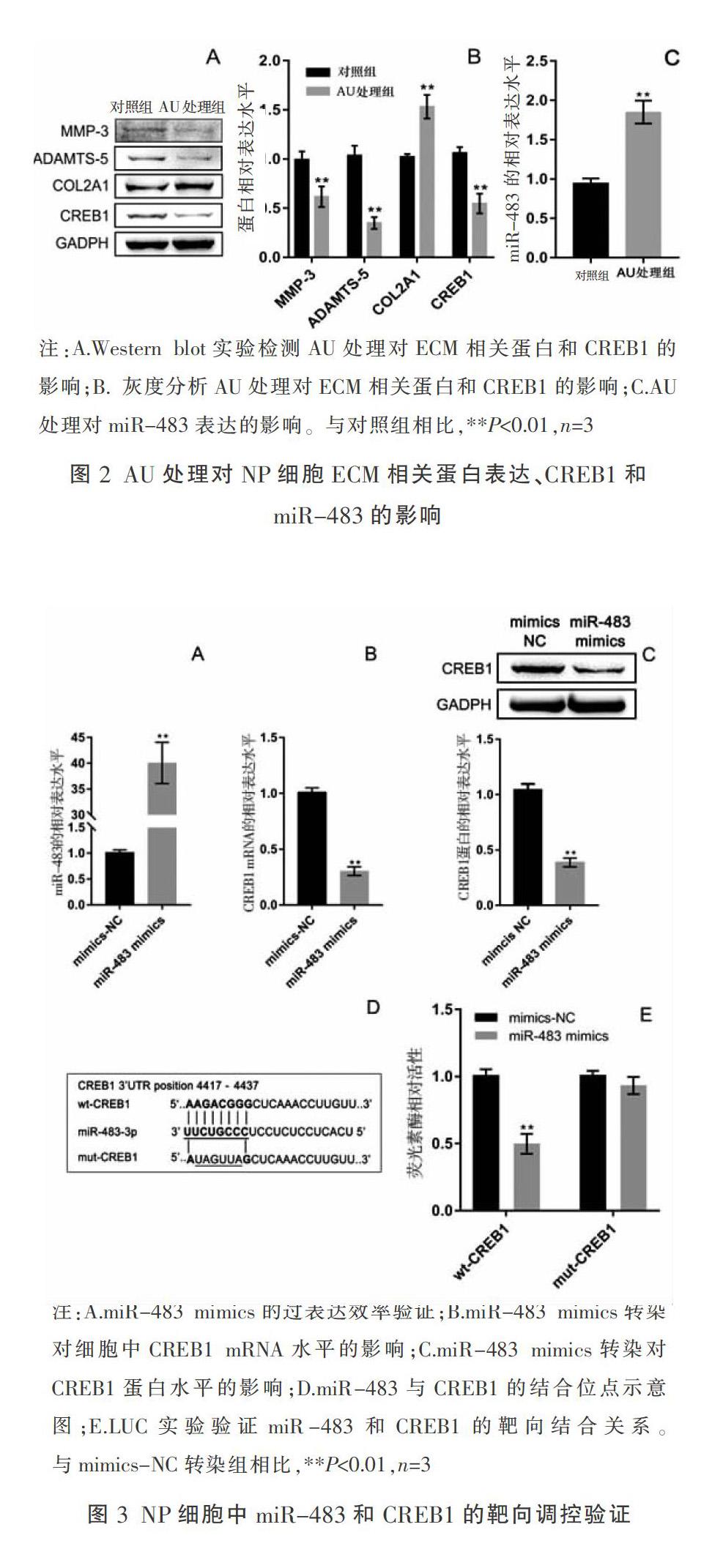
2.2 AU处理对NP细胞ECM降解的影响
通过Western blot实验检测了ECM降解酶MMP-3、ADAMTS-5和胶原蛋白COL2A1的表达变化情况,结果使用AU处理之后,MMP-3的相对表达水平从0.994±0.084下降为0.617±0.104(P=0.0003),ADAMTS-5的相对表达水平从1.037±0.099下降为0.349±0.061(P<0.000 1),COL2A1的相对表达水平从1.023±0.028增加为1.532±0.120(P<0.000 1,如图2A、图2B)。以上结果表明AU处理可抑制NP细胞的ECM降解过程。
2.3 AU处理对miR-483和CREB1表达的影响
其后检测AU处理对NP细胞中miR-483和CREB1的丰度影响,结果显示,AU处理后miR-483的表达水平发生显著上调(P=0.000 6,如图2C),而CREB1蛋白的表达水平发生显著下调(P<0.000 1,如图2A和2B)。以上结果表明miR-483和CREB1可能在AU功能行使过程中发挥着某些作用。
2.4 NP细胞中miR-483和CREB1的靶向调控关系验证
qPCR结果显示,转染该mimics后,miR-483的表达上调近40倍(如图3A);其后通过qPCR和Western blot分别检测转染miR-483 mimics后NP细胞中CREB1的mRNA和蛋白水平,结果显示,CREB1的mRNA和蛋白水平均发生极显著下调(如图3B和3C),表明细胞中miR-483的表达变化可影响CREB1的转录和翻译。
其后通过权威在线工具targetscan预测miR-483与CREB1 mRNA之间的结合位点(如图3D所示),并构建含有结合位点上下游800 bp的CREB1基因片段的野生型荧光报告重组载体(wt-CREB1),并在此基础上合成和构建结合位点发生突变的突变型荧光报告重组载体(mut-CREB1)。将重组载体与miR-483 mimics共转染进NP细胞后,发现miR-483 mimics可显著抑制转染wt-CREB1细胞的相对荧光素酶活性(P<0.000 1),而对转染有mut-CREB1细胞的相对荧光素酶活性无影响(见图3E)。
2.5 miR-483/CREB1轴在AU抑制NP细胞ECM降解中的作用验证
构建CREB1过表达载体并转染入NP细胞中进行过表达效率验证,发现该载体可显著增强细胞中CREB1mRNA丰度(如图4A)。使用CREB1过表达载体和mimics NC共转染NP细胞,其后使用AU处理,Western blot检测发现CREB1蛋白的表达显著增强,并且细胞中ECM降解酶MMP-3、ADAMTS-5的表达上调,而胶原蛋白COL2A1的表达发生下调;使用CREB1过表达载体和miR-483 mimics NC共转染NP细胞,AU处理后,细胞中CREB1和ECM降解酶MMP-3、ADAMTS-5的表达发生降低,而COL2A1的表达则出现上调。表明CREB1可削弱AU对NP细胞ECM的降解的抑制作用,而miR-483可部分逆转CREB1对AU的抑制作用。
3 讨论
由IDD导致的各类疾病已发展为严重影响人们生活质量、威胁人类身体健康的世纪难题。其发病机制和治疗方法一直是研究的焦点领域,虽然当前基因治疗、干细胞移植、生物工程治疗等均取得了一定的进展,但多数仍止步于动物实验,其临床有效性和安全性还需进一步评估[11]。近年来,广大中医学者在前人对IDD病因的相关论述基础上,结合大量临床实践发现中医药可作用于IDD发生发展的多个环节或靶点,延缓IDD进程[12]。
IDD在中医学中归属于“痹症”“腰痛”范畴,中医药治疗多从肾虚、气虚、督脉阻滞等着手[13],而中药杜仲性温,具强筋壮骨、滋养肝肾的作用,因此本项目进一步对杜仲在IDD治疗中的功能进行研究,结果发现杜仲的活性成分AU可显著增强退行性NP细胞的活性,并且增强的幅度与AU的浓度和处理时间相关。Western blot实验显示AU处理后NP细胞中ECM降解酶MMP-3、ADAMTS-5的表達降低,而COL2A1的表达则出现上调,表明AU可抑制NP细胞的ECM降解。大量研究表明,表达失调的miRNA如miR-143[14]、miR-222[15]等可直接调控其靶基因的表达,影响椎间盘组织中细胞的增殖、凋亡和ECM降解过程,参与IDD发生和演进过程。中药如补肾壮督方(全方由海马、鹿角胶、黄芪、熟地黄、细辛组成)可上调大鼠退变椎间盘组织和血浆中的miR-125a水平,延缓IDD发展[16];本课题组前期也报道了补肾活血方可影响NP细胞中miR-483的表达,促进NP细胞增殖和ECM重塑[10]。
对AU抑制ECM降解的分子机制研究发现,AU处理可显著增强NP细胞中miR-483的表达、抑制CREB1的表达。QPCR和LUC实验表明,miR-483可靶向抑制细胞中CREB1表达,提示miR-483/CREB1轴在AU功能发挥过程中可能具有重要作用。最后通过验证实验表明,CREB1过表达可显著增强细胞中ECM降解酶、抑制胶原蛋白的表达,而miR-483可逆转CREB1对AU功效的抑制作用。CREB1是一种被广泛研究的转录因子,可作为转录激活因子与启动子上的cAMP反应元件相结合,促进多种基因转录,参与细胞代谢、细胞周期、DNA修复和生存[17]。并且CREB1可调控IL-2、IL-6、IL-10和TNF-α的表达参与炎症进程[18],而NP细胞可通过分泌炎性因子诱导MMPs和ADAMTSs等ECM降解酶表达、加速IDD疾病进程[19]。
综上所述,本研究发现,中药杜仲的主要活性成分AU可作用于miR-483/C,REB1轴,抑制NP细胞ECM降解,延缓IDD的发展进程。通过明确和完善AU治疗IDD的具体分子机制,可为传统中医药防治IDD提供实验依据,并提供新的技术方法和研究思路。
参考文献
[1] GERHARDT A, EICH W, TREEDE R D, et al. Conditioned pain modulation in patients with nonspecific chronic back pain with chronic local pain, chronic widespread pain, and fibromyalgia[J]. Pain, 2017, 158(3): 430-439.
[2] SILAGI E S, SHAPIRO I M, RISBUD M V. Glycosaminoglycan synthesis in the nucleus pulposus: Dysregulation and the pathogenesis of disc degeneration[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2018:71-72:368-379.
[3] 朱福群,唐芳瑞,刘荣华.杜仲强筋健骨的药理作用及临床应用研究进展[J].江西中医药大学学报,2015,27(4):92-96.
[4] WANG C Y, TANG L, HE J W, et al. Ethnobotany, phytochemistry and pharmacological properties of Eucommia ulmoides: A review[J]. The American Journal of Chinese Medicine, 2019, 47(2):259-300.
[5] LU H, JIANG J, XIE G, et al. Effects of an aqueous extract of eucommia on articular cartilage in a rat model of osteoarthritis of the knee[J]. Experimental and Therapeutic Medicien, 2013, 6(3):684-688.
[6] XIAO Y, CHANG W, WU Q Q, et al. Aucubin protects against TGF?茁1-Induced cardiac fibroblasts activation by mediating the AMPK?琢/mTOR signaling pathway[J]. Planta Medica, 2018, 84(2):91-99.
[7] KIM Y M, SIM U C, SHIN Y, et al. Aucubin promotes neurite outgrowth in neural stem cells and axonal regeneration in sciatic nerves[J]. Experimental Neurobiology, 2014, 23(3): 238-245.
[8] ZHOU X, CHEN L, GRAD S, et al. The roles and perspectives of microRNAs as biomarkers for intervertebral disc degeneration[J]. Journal of Tissue Engineering and Regenerative Medicine, 2017;11(12):3481-3487.
[9] RUPAIMOOLE R, SLACK F J. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nature Reviews Drug Discovery, 2017,16(3):203-222.
[10] YANG S, LI L, ZHU L, et al. Bu-Shen-Huo-Xue-Fang (BSHXF) modulates nucleus pulposus cell proliferation and extracellular matrix (ECM) remodeling in intervertebral disc degeneration through miR-483 regulation of Wnt pathway[J]. Journal of Cellular Biochemistry, 2019,120(12):19318-19329.
[11] SHARIFI S, BULSTRA S K, GRIJPMA D W, et al. Treatment of the degenerated intervertebral disc; closure, repair and regeneration of the annulus fibrosus[J]. Journal of Tissue Engineering and Regenerative Medicine, 2015,9(10):1120-1132.
[12] ZHANG B, XU H, WANG J, et al. A narrative review of non-operative treatment, especially traditional Chinese medicine ther-apy, for lumbar intervertebral disc herniation[J]. Biosci Trends, 2017,11(4):406-417.
[13] 楊 宇,夏建龙,陈 刚,等.中药治疗脊髓型颈椎病的研究进展[J]. 中国中医急症,2016,25(4):685-687.
[14] YANG Q, GUO X P, CHENG Y L, et al. MicroRNA-143-5p targeting eEF2 gene mediates intervertebral disc degeneration through the AMPK signaling pathway[J]. Arthritis Research & Therapy, 2019,21(1):97.
[15] LIU J, YU J, JIANG W, et al. Targeting of CDKN1B by miR-222-3p may contribute to the development of intervertebral disc degeneration[J]. FEBS Open Biology, 2019,9(4):728-735.
[16] 张 震.血浆miRNA与腰椎间盘退变的相关性及补肾壮督方的干预研究[D].广州:广州中医药大学,2017.
[17] WANG Y W, CHEN X, MA R, et al. Understanding the CREB1-
miRNA feedback loop in human malignancies[J]. Tumour Biology, 2016,37(7):8487-8502.
[18] WEN A Y, SAKAMOTO K M, MILLER L S. The role of the transcription factor CREB in immune function[J]. Journal of Immunology, 2010,185(11):6413-6419.
[19] ZHANG W L, CHEN Y F, MENG H Z, et al. Role of miR-155 in the regulation of MMP-16 expression in intervertebral disc degeneration[J]. Journal of Orthopaedic Ressarch, 2017, 35(6):1323-1334.
(本文编辑 杨 瑛)

