水稻根的形态解剖结构分析
摘 要:水稻的根系是水稻重要的营养器官,水稻根系除了有固定植株、吸收水分养分、向根基分泌氧气等主要功能外,还有合成氨基酸和细胞分裂素等作用[1]。水稻根的切片能微观观察水稻的内部形态解剖结构,及时发现水稻的性状差异,是研究水稻非常重要的手段之一。即使在分子生物学研究技术高度发达的今天,植物制片技术仍然是不可或缺的[2]。本文以石蜡制片技术为契机,介绍水稻幼根、老根、侧根的形态解剖结构,以其对水稻根的进一步研究提供参考。
关键词:水稻;幼根;老根侧根;石蜡制片
1.材料与方法
水稻种子在一定的水分、适宜的温度和充足的氧气条件下,吸涨吸水开始萌动,胚根突破种皮从种孔向外生长形成种子根(种子根只有一条,在幼苗期具有吸收作用,以后枯死),随即在茎基部根原基处长出不定根。不定根又分化出各级侧根,形成了水稻庞大的须根系。根据研究目的,选取新鲜的有代表性的根尖或根段。
1.1取样、固定。用单面刀片切取长度分别为8mm的白色根尖、白色幼根、黄色老根、黄色侧根4种。为了保持水稻根原有的形态,应将切取的根立即投入盛有F.A.A固定液(甲醛5ml:乙酸6ml:50%乙醇87ml[3])的样品瓶中。为防止材料漂浮而没有完全沉没在固定液中,材料必须抽气,抽气时间一般为30分钟。抽气完成后,加适量的固定液使材料完全浸没24小时后再转入70%的酒精中备用。
1.2材料处理包埋。含水的材料与石蜡不能直接粘合,必须通过脱水、透蜡、浸蜡过程才能将材料包埋在石蜡中。常用酒精等脱水剂逐步取代材料中水分。材料中含水,而水跟透明剂(氯仿、二甲苯)、包埋剂(石蜡)都不相溶,所以必须经过酒精脱水以除去材料中的水分才能包埋。脱水透明过程及包埋步骤如下表所示[4]。
1.3切片、粘片。将包有材料的蜡块经分割修整,固定在Leica CM2235石蜡切片机上切成蜡带,仍后将合格的蜡带粘贴在载玻片上烘干。切片厚度:12μm。
1.4 脱蜡、染色。载玻片上的蜡带,用有机溶剂二甲苯去除石蜡。为了更清楚地显示出细胞或组织差别,要对载玻片上的材料进行染色处理。水稻根尖纵切采用爱氏苏木精整染法,幼根老根与侧根切片,采用番红固绿双重染色法[5]。
1.5 封藏、观察。选择合格的切片用中性树胶封藏并烘干后,可长期保存。用在Olympus BX61正置显微鏡,Olympus PD74 CCD观察并显微摄影[6]。
2.结果与分析
2.1水稻幼根结构
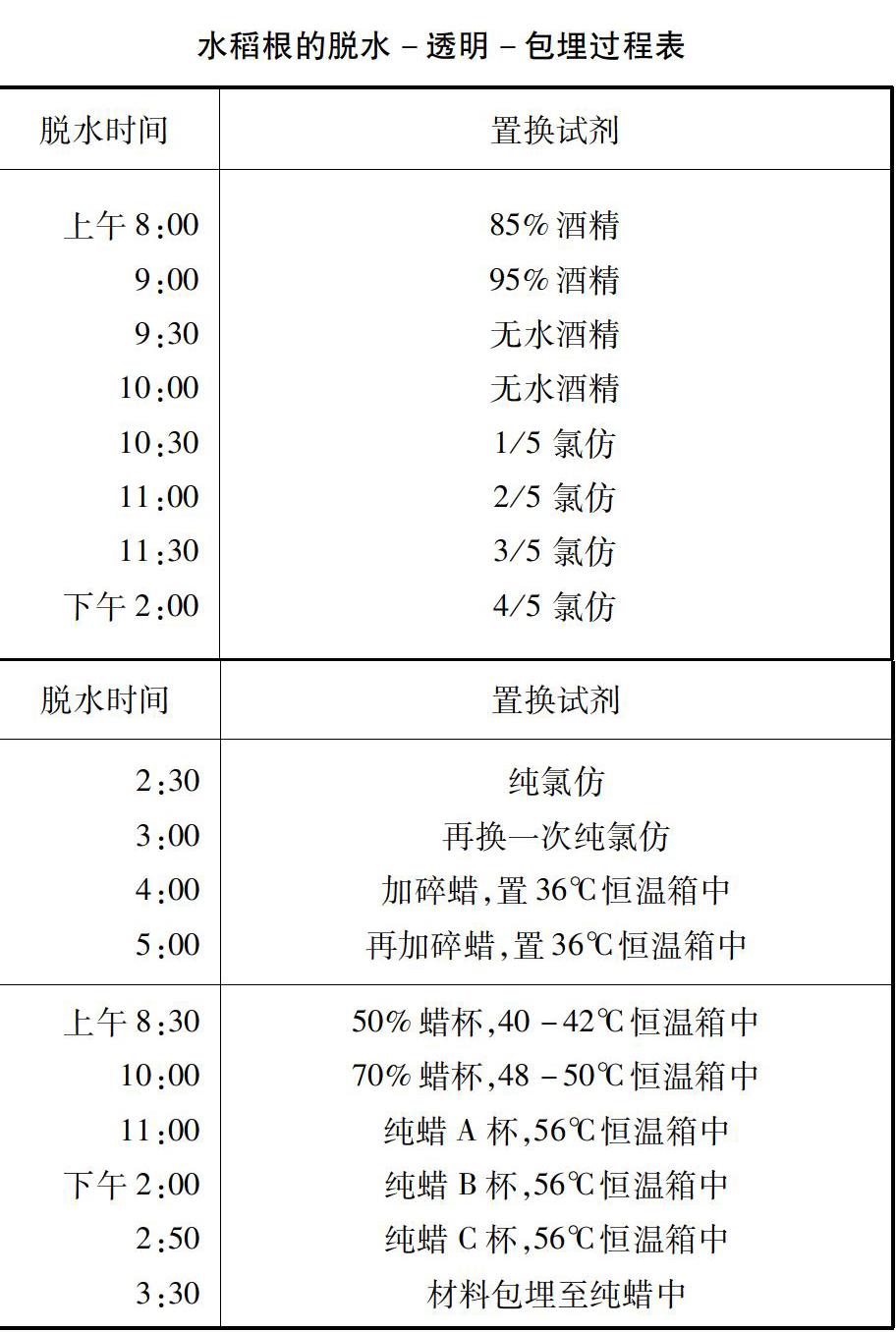
水稻是单子叶植物,它的根没有次生结构,只有幼根与老根,水稻幼根一般呈白色。从水稻幼根横切片可以看到水稻幼根的结构分为表皮、皮层、中柱三部分[7]。如图1所示。
(1)表皮。表皮是根的最外一层薄壁细胞,无气孔分布,大部分表皮细胞向外突出形成根毛,故根表皮属吸收组织。
(2)皮层。皮层在表皮以内,中柱以外,皮层在根中占较大比例。皮层又可分为外皮层、皮层薄壁组织和内皮层。外皮层细胞常排列紧密,细胞壁增厚可行保护作用。皮层薄壁细胞一般较大,排列疏松,含大液泡,是皮层的主要部分。内皮层只有一层细胞,细胞壁大部分五面加厚,横切片看呈马蹄形加厚,内皮层未加厚的细胞称为通道细胞。
(3)中柱。中柱由中柱鞘、木质部、韧皮部以及位于木质部和韧皮部之间的薄壁细胞构成。中柱鞘是中柱最外的一层或数层薄壁细胞。中柱鞘以内,先分化成熟的是口径较小的原生木质部导管;后分化成熟的是口径较大的后生木质部导管[8]。
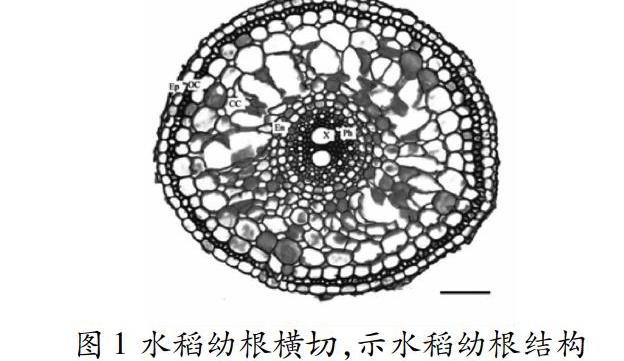
2.2水稻老根结构
水稻老根一般呈黄褐色。水稻是单子叶植物,它的老根并没有木栓次生结构。水稻老根较幼根没有明显的增粗,其基本结构也与幼根相似。不同的是,水稻老根外皮层细胞壁增厚,泌氧能力下降,三价铁沉淀在根上,成为黄褐色铁膜。这层铁膜有保护的作用,可防止有毒物质侵入根的内部。老根的皮层薄壁细胞为了适应水生生长而形成了通气结构并相连成大气腔,中柱内的薄壁细胞壁几乎全部木化增厚,如图2所示。
2.3水稻侧根结构
水稻侧根一般都起源于根中柱鞘。中柱鞘细胞经过平周分裂,形成了向外排列的几层细胞,称为侧根原基,由此分化成为侧根的根尖。随着侧根伸长区的生长和输导组织的分化,侧根根冠和生长点穿过根的皮层而生长为侧根。水稻能产生多级侧根。各级侧根的维管束级级相连,其基本结构也相同,如图3所示。
3讨论与总结
水稻根生长的好坏,直接影响到水稻的产量。除对根进行形态解剖观察外,生产上还可以根据根的外部颜色进行判别。水稻
根的颜色有白色、黄褐色、黑色、灰色等,不同的颜色表示根系的不同活力。白根的活力最强,黄褐色根活力下降,而黑根已基本失去活力,灰黑色根是已腐烂的根。通过栽培管理,保持根系活力,减少黑根的发生,是获得水稻高产的重要保障。所谓“白根有劲、黄根保命、黑根生病、灰根要命。[9]”
当前对水稻根系的研究仍在不断深入,不仅运用在水稻高产高效栽培上,在育种上通过根系育种来改良水稻品种成为未来研究的趋势之一,比如水稻抗旱、抗倒、耐盐、抗逆等研究,都与根系性状有较大关系。因此一张好的水稻根石蜡制片,能及时确认水稻根的内部形态,获得满意的科研成果[10]。
[参考文献]
[1]刘新红.水稻的多用途利用及产业发展建议.湖南农业科学.2018:5.
[2]冯燕妮.植物显微技术课程教学改革与实践[J].生物学杂志,2008(12):76-78.
[3]封克.不同水分条件下水稻根解剖结构的比较分析.植物营养与肥料学报2006,12(3):346-351.
[4]李和平.植物显微技术[M].北京:科学出版社,2009:9-39.
[5]王灶安.植物显微技术.北京:农业出版社,1990.
[6]冯燕妮,龙鸿.数字化生物实体图采集技巧[J].Asia-Pacific Journal of Life Science 2020; 1(2): 5-8.
[7]强胜.植物学[M].北京:高等教育出版社,2003.
[8]姚家玲.烟草植物学[M].北京:科学出版社,2017,42-53.
[9]李益峰.水稻根的生长.种子生产与经营专业教学资源库,7-10.
[10]冯燕妮,李和平.植物显微图解[M].北京:科学出版社,2013,167.
(作者单位:华中农业大学生命科学技术学院,湖北 武汉430070)

