血管性帕金森综合征和帕金森病颈动脉彩色超声及经颅多普勒检查临床分析
谈世东 强朝晖
芜湖市第二人民医院,安徽 芜湖 241000
血管性帕金森综合征(vascular Parkinsonism,VP)是一种同时具有帕金森病(Parkinson’s disease,PD)和脑血管病特点的临床综合征。由脑血管疾病或危险因素引发的一种帕金森综合征,起病缓慢,帕金森病的静止性震颤少见,对帕金森病药物治疗不敏感,称为脑血管病体征。VP患者容易被误诊,诊断主要依据患者影像学表现及临床症状。发病多为老年人,常合并原发性高血压、糖尿病、高脂血症等脑卒中危险因素,急性起病者大多有明确的脑卒中史。
近年来VP患者人数不断增加,过去VP的诊断主要依靠病史、危险因素、临床表现等。VP患者震颤多为程度较轻的姿势性和动作性震颤,少数同时伴轻度静止性震颤,而PD患者主要为静止性震颤,少数伴轻度姿势、动作性震颤,两者早期很难鉴别。本文就血管性帕金森和帕金森病在超声辅助诊断提出新的依据。收集2015年以来的28例VD和32例PD进行颈部及颅内彩超检查,对其结果进行分析,探讨颈动脉彩色超声(color Doppler flow imaging,CDFI)及经颅多普勒超声(transcranial Doppler,TCD)对两种疾病的诊断价值。
1 对象与方法
1.1临床资料选择2018-09—2019-04芜湖市第二人民医院门诊及住院就诊的VP患者28例,PD患者32例,VP符合诊断标准[1],PD符合中华医学会神经病学分会运动障碍及帕金森病学会组的诊断标准[2]。VP患者28例(VP组),男16例,女12例;年龄47~78(65.32±6.25)岁;病程3个月~12 a。PD组32例(PD组),男16例,女16例;年龄46~80(59±7.11)岁;病程1~12 a。2组年龄、性别构成差异无统计学意义(P>0.05)。排除标准:(1)有脑外伤史或中枢神经系统感染史;有长期服用抗精神病药物或(和)多巴胺药物病史;有明确的神经毒素接触史;(2)伴其他的神经系统阳性症状、体征,如位置性震颤、痴呆、直立性低血压、共济失调、垂直注视麻痹等;(3)CT或MRI扫描显示颅内脑积水或肿瘤;(4)合并严重内科糖尿病、肝肾衰竭、心脏病及其他肿瘤。
1.2方法
1.2.1 资料收集:设计表格收集患者全部临床资料并进行整理,包括既往史、发病年龄、性别、临床特征,主要记录头颅影像学表现及对药物治疗的反应。
1.2.2 检测方法:采用DWL双通道彩色多普勒血流诊断仪完成TCD检查,探头为2 MHz,检测颈内动脉、大脑中动脉、大脑前动脉、大脑后动脉、椎动脉及基底动脉,同时获取动脉的血流速度、血流方向等参数。CDFI采用美国通用E9彩色多普勒超声诊断仪,探头频率7.5 Hz,分别检查两侧颈总动脉、颈动脉窦部和颅内动脉,测定颈总动脉内中膜厚度、相关异常病变及相关参数。同时完成头颅CT或MRI检查,部分患者行MRA或DSA检查。

2 结果
2.12组病史比较VP组患者以慢性起病26例(92.85%),亚急性起病2例(7.15%)。所有PD患者均慢性起病。VP组有脑血管病史及脑血管病危险因素比率均明显高于PD组。见表1。
2.2颈动脉CDFI检查结果PD组单根血管病变6例,2根血管病变16例,3根及以上血管病变10例。VP组单根血管病变10例,2根血管病变12例,3根及以上血管病变6例。2组颈动脉彩色超声多谱勒结果比较,VP组颈动脉狭窄程度分级较PD组有明显差异(P<0.05)。见表2。
2.3TCD检查结果2组异常形式均以大脑中动脉血流减慢为主,PD组32例,血管异常率20.13%;VP组28例,血管异常率率25.71%,VP组各血管的异常率显著高于PD组(P<0.05)。见表3。
2.4影像学表现PD患者脑萎缩6例,基底节区腔隙性脑梗死1例,脑干腔隙性脑梗死1例,正常4例。VP组脑梗死18例,21例伴皮质下动脉硬化性脑病,18例伴脑萎缩。见表4、图1。
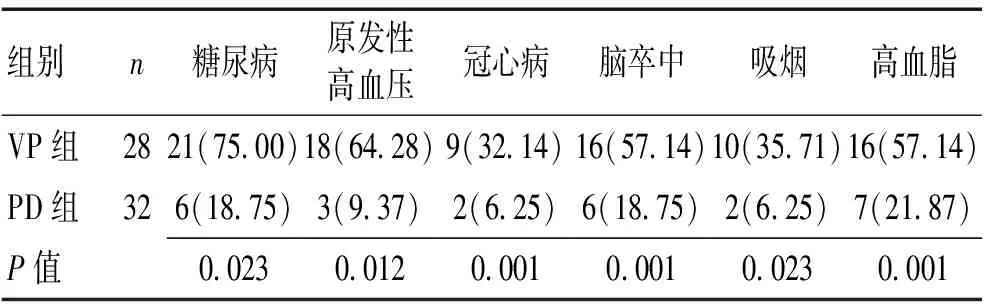
表1 2组既往史及病史比较 [n(%)]Table 1 Comparison of past and medical history betweentwo groups of patients [n(%)]
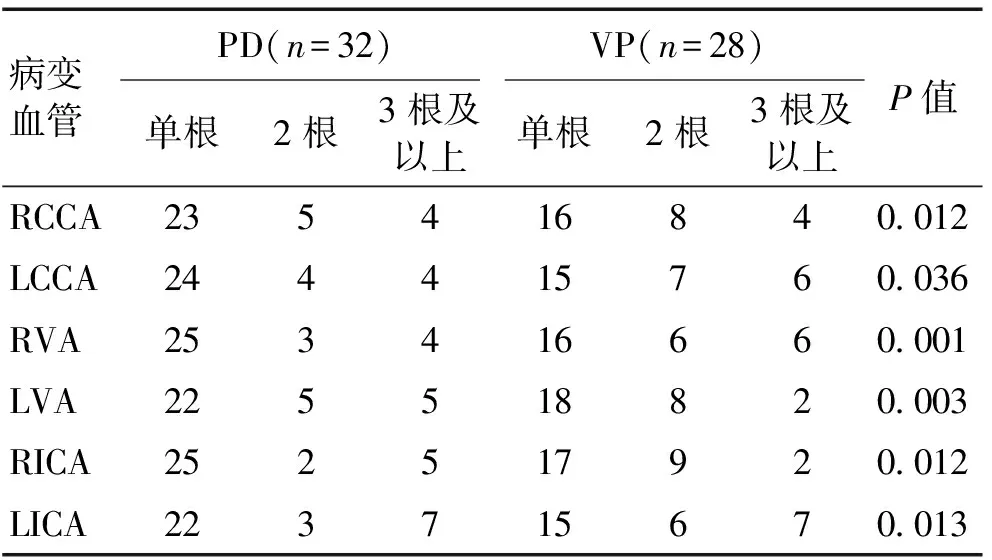
表2 CDFI检测VP与PD颈部动脉血管狭窄程度比较Table 2 Comparison of the results of CDFI detection ofvascular stenosis between VP and PD

表3 TCD检测VP与PD颈部动脉血管狭窄程度比较Table 3 Comparison of results of TCD detection of vascularstenosis in VP and PD carotid arteries
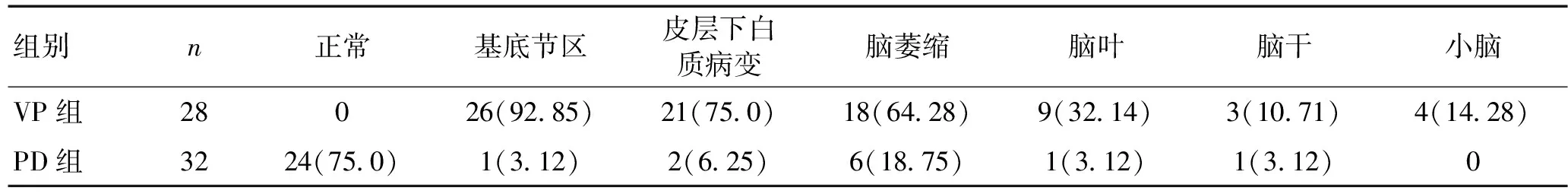
表4 VP 组及PD 组颅脑影像学表现 [n(%)]Table 4 Craniocerebral imaging performance of VP group and PD group [n(%)]
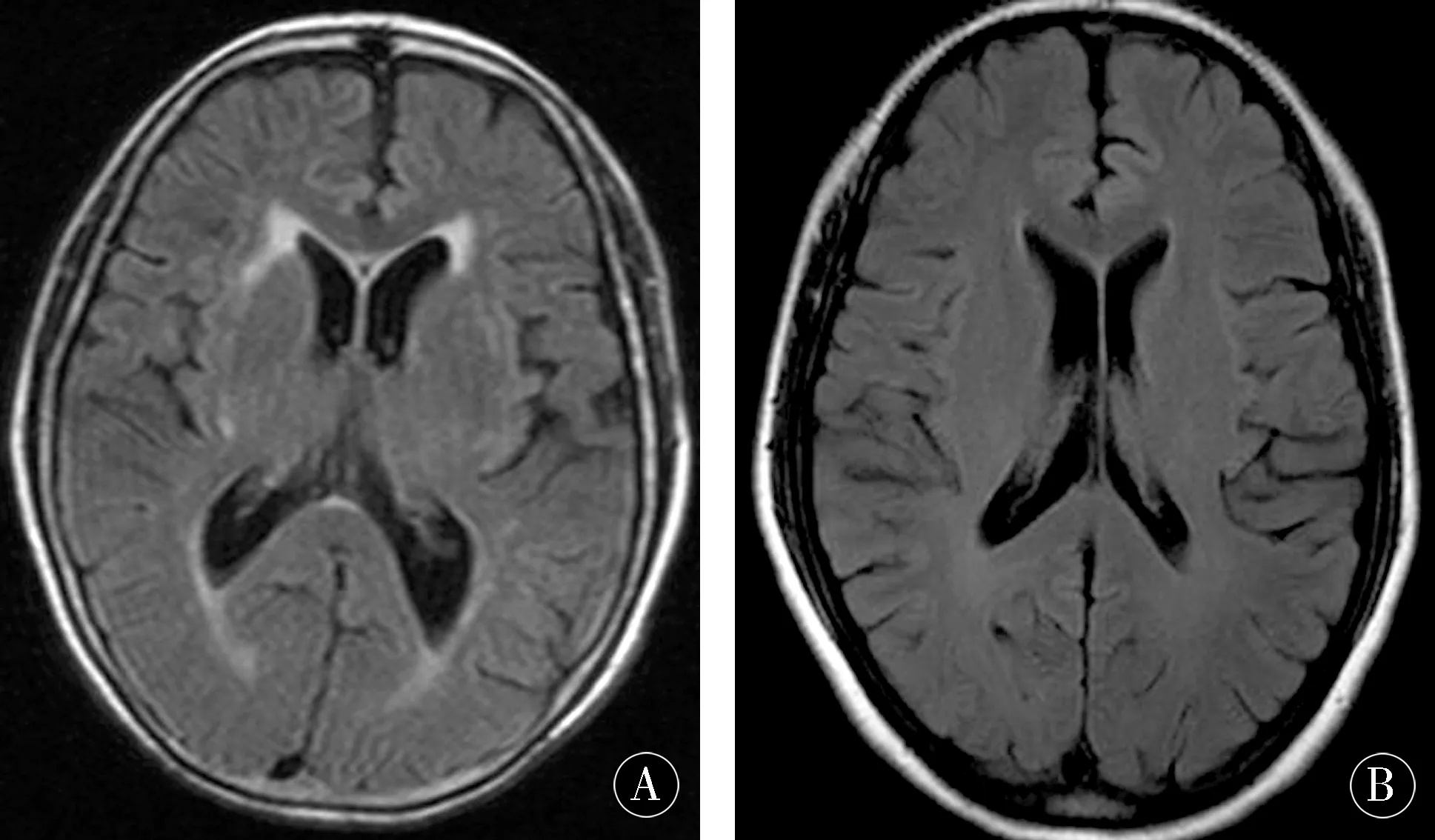
图1 头颅MRI FLAIR像显示VP患者缺血性损害累及侧脑室旁、基底节区和皮质下脑白质,脑干及小脑很少累及,PD患者缺血性损害不明显Figure 1 MRI FLAIR image of the skull shows that ischemic damage in VP patients involves paraventricular,basal ganglia,and subcortical white matter.Brainstem and cerebellum are rarely involved,and PD patients have less ischemic damage
3 讨论
随着脑血管患者越来越多,VP患者发病率也越来越高。VP组患者的肌张力增高,很少表现为齿轮样,常为铅管样和折刀样肌张力增高共存,表现为被动运动时患者肢体阻力始终存在,但仍有阻力突破感。患者急性起病,下肢症状为主,左旋多巴治疗无效,影像学表现为累及皮质下脑白质、基底节区或脑干的腔隙性脑梗死。VP病因是缺血性脑血管病,如治疗高血压、糖尿病、动脉硬化。降低血液黏度,降低血小板聚集,改善脑循环和使用脑细胞激活剂及防治脑梗死等药物可能有益,这点和PD患者治疗明显不同,但两者有时候很难鉴别,尤其是早期。
VP患者临床起病缓慢,常伴脑血管病史,脑血管病危险因素明显多于PD患者,而且VP患者痴呆发生率较PD患者较重,与长期脑血管损害相关。VP患者影像学表现多为腔隙性梗死及脑白质脱髓鞘改变,以基底节区及侧脑室旁损害为主,故易引起痴呆。DUNET等[3]认为,VP患者有较高的认知能力下降,原因在于基底神经节病变,基底节核与核、核与大脑皮质血管功能连通性受到破坏。影像学方面,本研究VP患者皮层下白质病变及脑萎缩明显多于PD组(P<0.05),说明临床上VP患者脑白质均有缺血性改变,分布于基底节区或侧脑室旁,脑萎缩较重。MA等[4]通过分析VP和PD患者脑血管病危险因素、脑血管病史情况、颅脑CT或MRI病灶特点,也认为VP组有脑血管病危险因素,脑血管病史比例明显高于PD组。VP患者MRI检查绝大多数伴多发性腔隙性脑梗死,其中以基底节区、侧室旁和半卵圆中心最多见,少数脑干、脑叶也可见腔隙性梗死灶,3T SWI可以用作识别PD和VP的工具[5]。FERREIRA等[6]认为,VP是独立于PD的神经系统疾病,在临床表现及头颅MRI表现方面同PD存在一定差异,VP患者表现出独特的步态,足部间隙减少,这可能与多巴胺能/非多巴胺能皮质和皮层下非多巴胺能网络中的血管病变有关。PD组仅表现为轻度脑萎缩,与一般老年性脑萎缩无差异。脑萎缩与认知功能损害有相关性,基底节及侧脑室旁缺血性改变较多,可继发性损害多巴胺能神经通路,使一部分患者临床出现类似于PD的表现,如震颤、动作迟缓、姿势异常等症状。CHAHINE等[7]研究发现,血管性痴呆与帕金森病痴呆患者都存在不同程度的认知功能障碍和抑郁状况,二者有明显区别,PD患者中痴呆症很常见,而且很严重,血管性危险因素与早期PD的认知能力下降有关。
本研究表明,VP患者相对于PD在病程、基础病、临床表现、影像学方面有明显不同。VP各血管的异常率显著高于PD,VP组血流速度显著增快提示血管狭窄,因VP者脑动脉硬化、斑块形成、血管狭窄的程度较重。STOJKOVIC等[8]认为,PD和VP患者均有脑部血管动力学改变,而且VP组异常率高于PD组,其中左侧血流速度显著慢于右侧,与本研究一致。本研究中CDFI检测发现,VP患者脑血管狭窄程度较重。VP具体鉴别方法包括TCD或CDFI可显示颅内或颈部血管狭窄的程度,可能有助于血管性帕金森症的诊断[9]。
经颅超声成像技术不仅可以显示黑质的结构是否有异常,也可以检测颅内动脉血管有无病变。BERG等[10]通过随访研究发现,PD患者的黑质(SN)区有回声增强,回声增强区的性质与SN区的铁含量增高有关,这一点与VP患者有明显不同。TSAI等[11]通过TCD分析PD和VP患者在黑质回声异常、颅内大动脉血液动力学的不同,常以颈动脉内膜厚度、斑块、血管狭窄程度分级作为评价颈动脉硬化程度的指标,得出PD组黑质有回声增强,而且明显高于VP组和对照组。VP组66.7%的患者显示有明显的脑血管斑块形成或狭窄,因此TCD结合颈部CDFI助于鉴别PD和VP,二者不同的脑血流动力学改变可用来鉴别诊断VP和PD。VENEGAS[12]认为PD和VP鉴别诊断除了临床资料,血管彩超检查是必要的。
近年来TCD已经成为一种广泛应用在诊断工具,与PD患者相比,VP患者一般没有黑质回声,VP患者TCD检查可显示狭窄的血管。因此,TCD结合和CDFI有助于血管性帕金森症的诊断。PD患者颈部动脉粥样硬化较轻,而VP患者的颈部动脉粥样硬化程度较重,与基础病、高龄有关。本研究中PD组与VP的动脉硬化斑块致血管狭窄程度分级有显著性差异。TCD作为一种非侵入性的技术,已成为PD的诊断及与帕金森综合征鉴别诊断的重要工具。CABA等[13]研究发现,VP的诊断基于一系列临床标准和神经影像学发现。经颅多普勒超声脉搏指数的增加已被描述为VP患者的常见发现。VP患者的经颅多普勒超声脉搏指数明显高于PD患者。因此,我们支持使用经颅多普勒超声检查对有运动功能障碍老年患者进行初步评估。经颅彩色多普勒超声不仅能够探测黑质的高回声,同时能够检测到血管的狭窄程度,是早期诊断PD及VP的关键。ISABEL等[14]研究认为,TCD测量中脑区域异常回声对鉴别PD和进行性核上性麻痹有同样的价值,目前也可以用嗅觉试验辅助鉴别VP和PD。而超声检查是一项实时检查项目,BERG等[15]研究认为,无经验者则要进行8周的培训才能达到脑血管超声工作经验者的熟练程度。ANDRIUS等[16]研究表明,对于黑质区域的自动细化分析显示,这个区域能够被相当准确地测量,但结果的准确性与成像质量有关。
VP临床表现形式不一,在诊断标准上尚无共识,很难将VP与PD区分开。VP通常是由皮层下白质病变引起的,在黑质-纹状体-丘脑-皮质途径的任何层面出现的病变可导致VP的发生,因此会引起除步态障碍以外的各种症状。使用SPECT进行的多巴胺转运蛋白成像研究显示出基底节区异常信号,提示VP的影像学病灶较多,F-FP-CIT PET/CT证实的VP在中脑和运动皮层之间以不同水平值可视化血管异常病变[17]。SALSONE等[18]认为白质病变在VP发病机制中起到一定的作用,进行弥散张量成像评估微结构白质病变的变化,评估特定纤维束受累与临床表现之间的关系,与PD患者和对照组相比,VP中微结构白质病变、内外囊和电晕辐射显著降低,相比之下,PD指标正常。此外,血清炎性因子也可以参与鉴别诊断VP和PD,ZOU等[19]认为三叶因子3、胆碱酯酶和同型半胱氨酸是晚期PD痴呆症和VP痴呆的潜在预测因子。
VP是可能由脑血管疾病引起的帕金森综合征临床特征的病症,传统上将其描述为步态不稳定且无震颤,通常与锥体束征受损有关。目前VP的治疗仍然具有挑战性,对左旋多巴反应不佳,左旋多巴是目前治疗PD最有效的药物[20]。但有证据表明,少数VP患者可从左旋多巴治疗中获益,左旋多巴治疗可显著改善VP患者症状及生活质量[21]。研究表明,服用罗替戈汀在75岁及以上的VP患者中具有安全性和有效性,对患者运动、生活能力、时空定向、生活质量均有所改善,通过透皮给药连续多巴胺能刺激。罗替戈汀透皮贴剂也是治疗老年性痴呆并伴认知功能障碍新的方法。低剂量的罗替戈汀贴剂可以改善患者认知及生活功能,从而改善VP老年患者的生活质量,老年VP患者用罗替戈汀治疗也是有效的[22]。VP定义为存在帕金森综合征,目前诊断VP所使用的标准不统一,也尚不明确该病有效的治疗或干预措施[23]。尽管VP患者对左旋多巴的疗效普遍较低,但也有新的方法用于治疗VP患者。MAKSIMOVICH等[24]认为脑内经导管激光生物调节疗法治疗Binswanger病和VP是有效的,脑内导管激光治疗VP可以恢复大脑侧支和毛细血管的血液供应,改善脑血管侧支微循环,恢复细胞和组织的新陈代谢,刺激神经发生,并引起大脑细胞的再生。
通过CDFI及TCD检查,了解患者颅内外及颈部血管的情况,对异常及时加以他汀类药物改善血管内皮功能及稳定血管斑块,通过判断血管狭窄程度鉴别诊断VP和PD。与MRA、CTA、DSA相比,CDFI及TCD检查具有廉价、可移动无创、直观、重复性好等优点,其灵敏度较高,包括血流动力学方面、血管的形态、解剖变异、管壁厚度、颈动脉斑块、血管狭窄的程度等,因此,TCD和CDFI联合检测,更有利于VP和PD患者。

