高效降解氨氮的芽孢杆菌筛选及发酵条件优化
张冠根,陈鹏程,郑璞*,吴丹,乔慧,张文宜,蒋速飞
1(江南大学 生物工程学院,江苏 无锡,214122) 2(中国水产科学院淡水渔业研究中心,江苏 无锡,214081)

目前对枯草芽孢杆菌高密度发酵的研究较多,产芽孢量也较高,可达到7×1010CFU/mL[6]。但有关解淀粉芽孢杆菌产芽孢发酵报道较少,REN等[7]通过优化培养基的碳源、氮源、无机盐,产芽孢数可达到 8.05×109CFU/mL,为目前所报道的最高产芽孢量。
本文利用以(NH4)2SO4为唯一氮源的选择性培养基,采用96孔板高通量筛选方法,在淤泥中筛选出1株可快速去除氨氮的解淀粉芽孢杆菌菌株。考察了它的脱氮性质,并优化发酵产芽孢的条件。
1 实验材料和方法
1.1 实验材料
实验样品:江南大学池塘内土壤(N31°28′47″,E120°15′59″)。
孔板培养基(g/L):葡萄糖3.75,(NH4)2SO40.25,K2HPO41.0,KH2PO40.3,MgSO4·7H2O 0.05,FeSO4·7H2O 0.01,MnSO4·4H2O 0.01,NaCl 5,pH 7。
氨氮培养基(g/L):葡萄糖3.75, (NH4)2SO40.5,K2HPO41.0,KH2PO40.3,MgSO4·7H2O 0.05,FeSO4·7H2O 0.01,MnSO4·4H2O 0.01,NaCl 5,pH 7。
亚硝酸氮培养基(g/L):葡萄糖3.75,NaNO20.49,K2HPO41.0,KH2PO40.3,MgSO4·7H2O 0.05,FeSO4·7H2O 0.01,MnSO4·4H2O 0.01,NaCl 5,pH 7。
优化发酵培养基(g/L):葡萄糖12.0,蛋白胨15,酵母粉15,KH2PO40.8,MnCl20.1,NaCl 1,CaCl20.1,pH 7。
培养基1(g/L):酵母粉2,大豆蛋白粉4,酵母浸膏2,糖蜜2,玉米蛋白粉1,KH2PO40.05,MgCO30.05,CaCO30.3,NaCl 0.03,pH 7.0。
培养基2(g/L):葡萄糖17.51,酵母粉 9.88,CaCl22.11,pH 7。
培养基3(g/L):玉米粉3,糖蜜10,豆粕粉10,鱼粉10,K2HPO42,Na2HPO42,MgSO40.5,MnSO40.5,pH 7.0。
培养基4(g/L):乳糖10,蛋白胨7.45,NaCl 5,MgSO4·7H2O 2.46,CaCl21.22,K2SO40.087,pH 7。
培养基5(g/L):麸皮15,豆粕15,NaCl 5,CaCO30.2,MnSO4·H2O 0.2,MgSO4·7H2O 0.2,pH 7。
培养基6(g/L):葡萄糖36.0,大豆蛋白胨15,酵母粉18,玉米浆12,KH2PO40.8,MnCl20.1,NaCl 1,CaCl20.1,pH 7。
1.2 实验内容及方法
1.2.1 菌株筛选
将采集的土壤按30 g/L的质量浓度接种于(NH4)2SO4为唯一氮源的富集培养基[8]中,37 ℃、110 r/min进行富集驯化培养2 d。培养结束后,将菌液稀释至10-1~10-9,取合适浓度的稀释液0.1 mL在富集培养基平板上进行涂布,37 ℃培养箱中培养3 d后用牙签将获得的单菌落接种于装有1 mL孔板培养基的96深孔板中,30 ℃,110 r/min摇床培养48 h。培养完成后将96深孔板于3 000 r/min 下离心15 min,对上清液中剩余氨氮浓度进行测定,对培养基中剩余氨氮浓度较低的菌株做进一步筛选。
将初筛所得菌株接种于氨氮培养基,110 r/min,30 ℃培养24 h后作为种子液以3%的接种量分别接种于氨氮培养基,30 ℃,110 r/min进行培养,每5 h取发酵液,10 000 r/min离心2 min,测定上清液中的氨氮含量,计算氨氮的去除率,保存氨氮降解率最高的菌株。
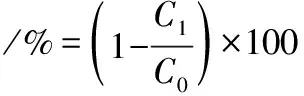
(1)
式中:C0,初始氨氮浓度;C1,剩余氨氮浓度。
1.2.2 菌株鉴定
形态学鉴定:观察LB平板上的菌落形态及表面特征,进行革兰氏染色以及芽孢染色。
生理生化鉴定:参照文献[9]。
分子鉴定:在LB培养基中,30 ℃、110 r/min培养过夜,细菌DNA试剂盒提取优选菌株的基因组DNA。按照文献[10]所述方法通过16S rDNA基因分析鉴定分离的菌株,将PCR产物测序结果在NCBI网站上进行比对,利用MEGA7.0软件构建进化树。
1.2.3 菌株的脱氮性质研究
1.2.3.1 氨氮以及亚硝酸盐的去除途径
将菌株分别接种于氨氮培养基、亚硝酸氮培养基,30 ℃,110 r/min培养24 h后作为种子液以3%的接种量分别接种于相应培养基,30 ℃,110 r/min培养,每隔 4 h取样,检测培养液中氨氮、亚硝态氮、硝酸盐浓度以及菌浓OD600。
1.2.3.2 氨氮耐受性研究
将菌株接种于氨氮培养基,30 ℃,110 r/min培养24 h后作为种子液以3%的接种量接种于氨氮浓度分别设置为100、200、500、800、1 000 mg/L 氨氮培养基,30 ℃,110 r/min培养24 h后测定氨氮降解率以及菌体浓度OD600。
1.2.3.3 有机氮存在下菌株对氨氮的降解情况
将菌株接种于氨氮培养基,30 ℃,110 r/min培养24 h后作为种子液以3%的接种量接种于胰蛋白胨质量浓度分别设置为0、0.8、1.6、3.2、6.4 g/L的氨氮培养基,30 ℃,110 r/min培养24 h后测定氨氮降解率。
1.2.4 菌株的高密度产芽孢发酵
1.2.4.1 初始发酵培养基筛选
将斜面保存的菌株用接种环接入LB培养基,30 ℃,110 r/min培养12 h后,以5%的接种量分别接入培养基1~6[11-16],37 ℃,110 r/min培养36 h后取样测定菌体浓度(OD600)以及芽孢数。
1.2.4.2 摇瓶发酵培养基优化
将初始发酵培养基中的氮源改为蛋白胨15 g/L,酵母膏15 g/L,同时碳源改为分别添加3、6、12、24 g/L的葡萄糖,将初始发酵培养基中的碳氮比(质量比)分别设置为0.33、0.67、1.32、2.64。B4斜面上挑取1环菌接入初始发酵培养基,30 ℃,110 r/min培养12 h后,以5%的接种量分别接入不同碳氮比(质量比)的发酵培养基中,37 ℃,110 r/min培养36 h后取样测定菌体浓度以及芽孢数。
1.2.4.3 3 L发酵罐葡萄糖补料发酵
于斜面上挑取1环菌接入优化发酵培养基,110 r/min,30 ℃培养12 h,按5%的接种量接入装有优化培养基的发酵罐。发酵参数:温度37 ℃,转速400 r/min,通气量1.0 vvm,装液量1.5 L。用4 mol/L NaOH维持发酵液pH 6.5~7.0。初始葡萄糖耗尽后,开始进行葡萄糖的补料,补料速度分别设置为10以及20 g/(L·h),菌体浓度达到最高后停止补料,补料结束后不再调节pH,发酵过程中每2 h取样测定菌体浓度(OD600)以及记录pH和溶氧变化,24 h后取样测定芽孢数。
1.2.5 所制备菌剂对模拟养殖水体中氨氮的降解
为模拟不同氨氮浓度养殖水体,取自来水分别加入不同量的NH4Cl,使氨氮质量浓度分别为1、10、20、50 mg/L,另外对应加入葡萄糖使水中m(碳)∶m(氮)=10∶1。取所制备的B4菌剂,分别投入装有30 mL配制好的不同氨氮质量浓度为1、10、20、50 mg/L水体的250 mL摇瓶中,使菌株B4终浓度均为105CFU/mL,30 ℃,110 r/min摇瓶培养48 h,每12 h取样测定氨氮质量浓度。
1.2.6 检测方法
氨氮浓度的测定采用靛酚蓝比色法[17];亚硝态氮的浓度测定采用N-乙二胺分光光度法[18];硝酸氮测定采用紫外分光光度法(HJ/T 346—2007);芽孢计数方法为:将发酵液置于80 ℃水浴10 min以杀死不能形成芽孢的活菌后,采用平板涂布法(GB 20287—2006)进行芽孢计数。
1.2.7 数据分析
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株的高通量初筛
氨与苯酚和次氯酸钠在酸性条件下,经亚硝基铁氰化钠催化生成蓝色的靛酚,利用这一原理建立了96孔板高通量筛选的方法。样品经富集、分离、纯化得到428颗单菌落,经过48 h培养,其中6株菌可将孔板培养基中的50 mg/L的氨氮完全去除,分别命名为B1、B2、B3、B4、B5、B6。
2.1.2 菌株的摇瓶复筛
对初筛所获得的菌株每隔5 h进行氨氮残余量的测定(表1)。6株菌中B4在15 h时就几乎完成了氨氮的去除,氨氮去除速度为5.93 mg/(L·h),高于一些假交替单胞菌Pseudoalteromonassp.2906[<1 mg/(L·h)][19]以及好氧反硝化菌Rhodococcussp. CPZ24[2.5 mg/(L·h)][20],最终氨氮去除率为92.32%,展示出了较高效的氨氮去除能力,因此选择B4菌株作进一步实验。

表1 六株菌的氨氮去除率Table 1 Ammonia degradation rate of six strains
注: 同列数据肩标不同小写字母表示差异显著(P<0.05)
2.1.3 菌株的鉴定
菌落在LB平板生长初期为乳白色,后变为黄色,不透明,表面暗且较粗糙,边缘不规则呈树枝状像四周伸展,菌落中心黏液呈圈状,革兰氏染色阳性,有芽孢。硝酸盐反应、淀粉水解、V-P反应、丙二酸利用、柠檬酸盐利用、接触酶反应、D-果糖产酸、明胶液化、厌氧生长均为阳性;卵磷脂酶反应、吲哚实验、苯丙氨酸脱氢酶实验均为阴性。将B4的16S rDNA测序结果在NCBI网站进行比对,利用MEGA7.0软件以Neighbor-joining法构建系统进化树[21],并结合其生理生化实验,鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。

图1 基于菌株B4的16srDNA构建的系统进化树Fig.1 Phylogenetic tree based on 16S rDNA of strain B4
2.2 菌株的脱氮特性研究
2.2.1 菌株对氨氮与亚硝酸盐的去除特性
菌株B4对氨氮的降解过程中,氨氮浓度伴随菌体浓度的增加逐渐减少,表明菌株的生长与氨氮去除同步(图2-a)。20 h以后,菌液浓度呈下降趋势,氨氮浓度不再下降,并且整个生长过程中并无亚硝酸盐或硝酸盐产生,说明菌株并不进行硝化作用而是通过铵盐同化以合成细胞物质。
亚硝酸氮与氨氮去除过程略有差别(图2-b),在亚硝酸氮为氮源的培养基中,菌株B4的生长延滞期更长,相同的是,亚硝酸氮浓度也是在菌株的指数生长期内快速降低,经过20 h培养,培养基中50 mg/L的亚硝酸氮被完全去除。同时在B4生长过程中未检测到氨氮的存在,这说明B4通过硝酸盐同化作用吸收亚硝酸氮。

a-菌株的生长与氨氮去除关系;b-菌株生长与亚硝酸盐去除关系图2 B4对氨氮和亚硝酸盐的去除特性Fig.2 Degradation and growth of ammonia and nitrite by strain B4
2.2.2 氨氮耐受性研究
相比于氨氮质量浓度为100 mg/L,氨氮质量浓度增加至200、500、800、1 000 mg/L时,氨氮去除率有所下降,分别为49.91%、21.90%、20.06%、27.41%(图3),不过氨氮浓度增加后,B4可正常生长,菌体浓度有所提高,并且24 h内去除了更多的氨氮,有更快的氨氮降解速度。不同氨氮浓度下的菌体生长以及氨氮去除速率表明B4可适应高浓度氨氮的环境,具有处理高浓度氨氮工业废水的潜在应用价值。
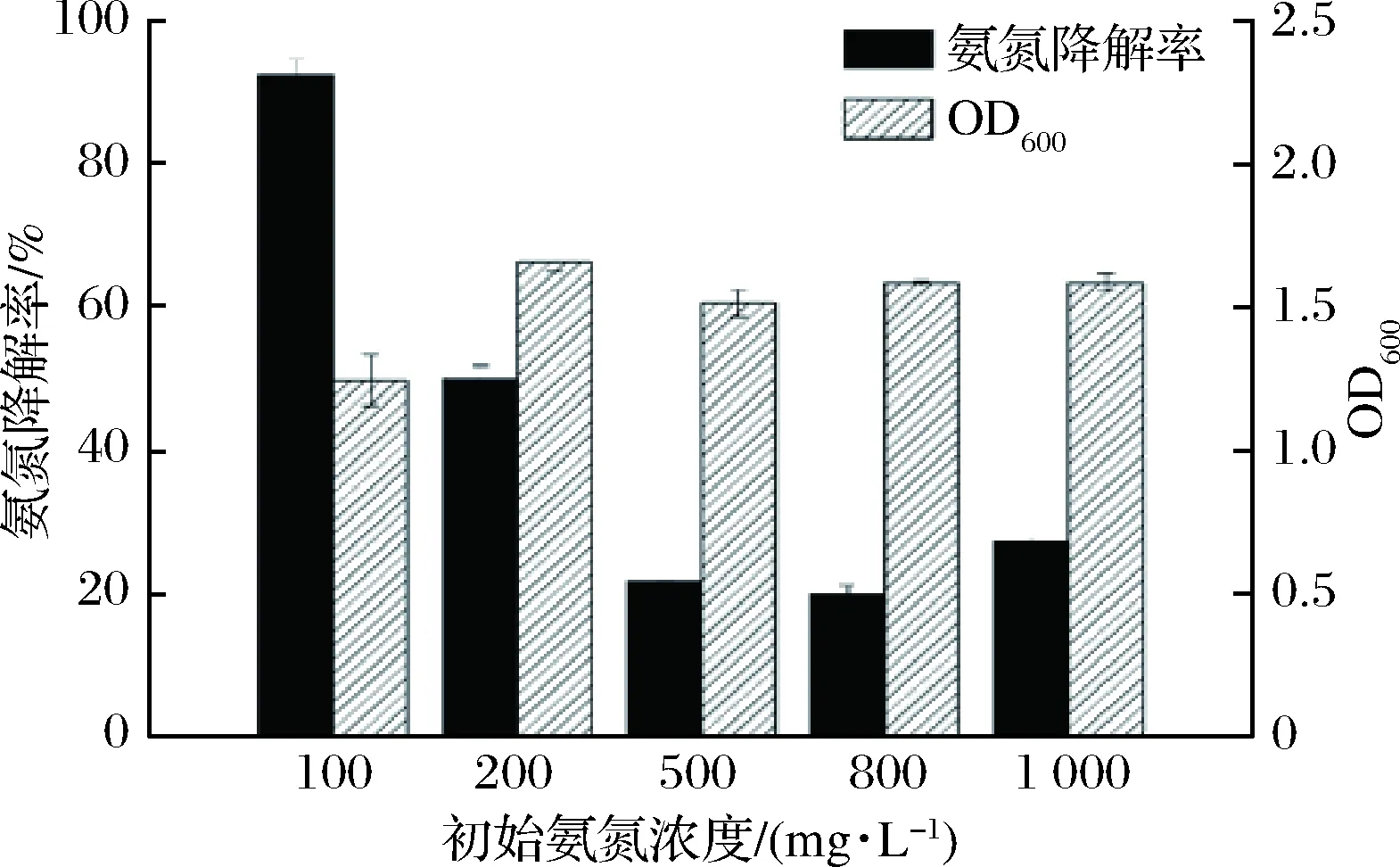
图3 B4对不同浓度氨氮耐受性Fig.3 B4 tolerance to different concentrations of ammonia
2.2.3 有机氮存在下菌体对氨氮的降解情况
实际养殖体水体存在多种含氮有机物。本实验以胰蛋白胨作为含氮有机物代表,研究了菌体在复杂有机氮环境中的除氨氮能力。由图4可知,胰蛋白胨质量浓度在3.2~6.4 mg/L时,培养基中的氨氮没有被去除,而且浓度高于初始值,这可能是高浓度的有机氮抑制了细菌对无机氮的吸收,同时细菌的氨化作用产生了更多的氨氮;在胰蛋白胨质量浓度≤3.2 mg/L时,胰蛋白胨含量的增加对氨氮去除率有一定的影响,不过仍保持着较高的氨氮去除率。由此可知,在一定浓度的有机氮存在下,菌株B4仍能对水体中的氨氮进行有效地去除,这有利于其在水产养殖中的应用。
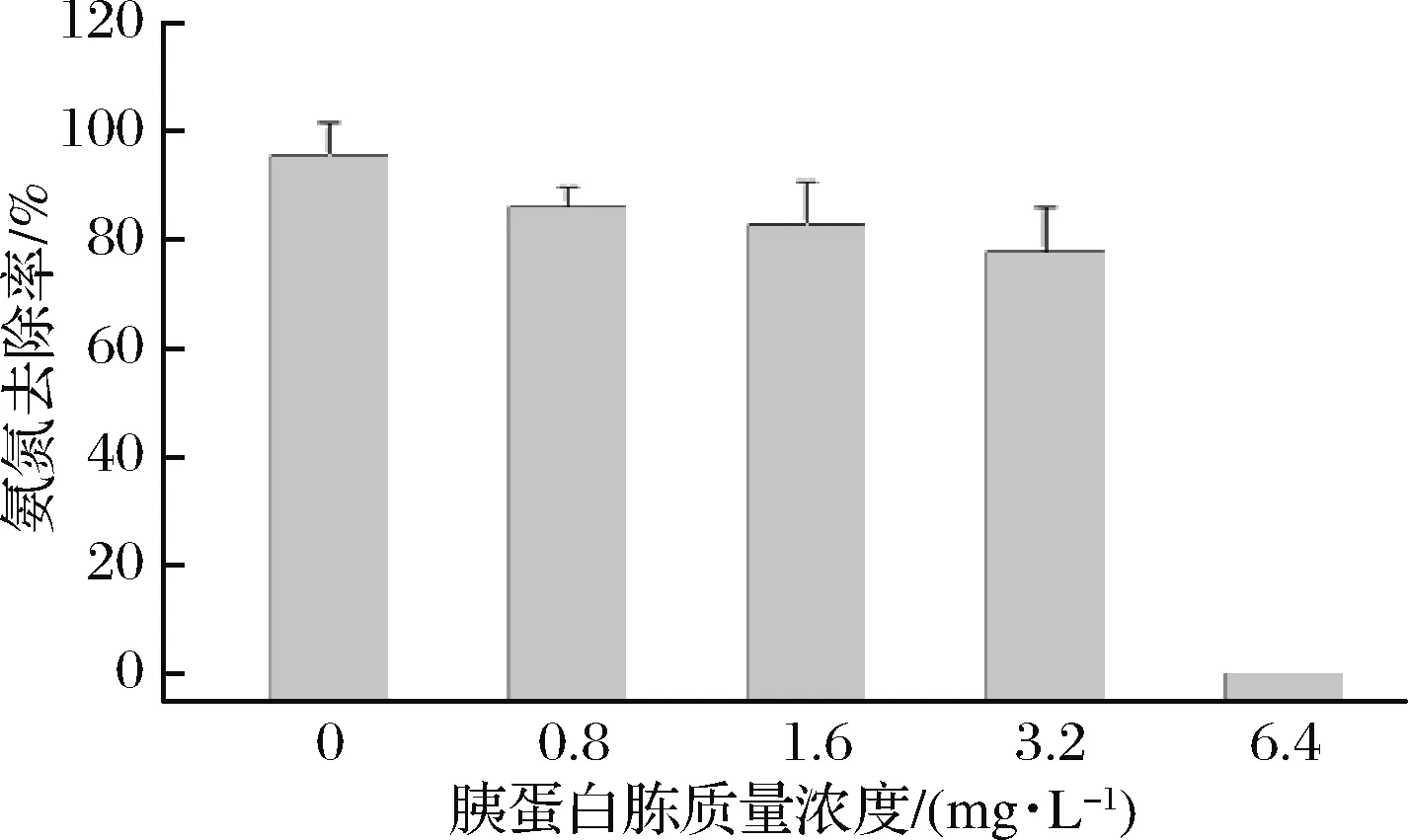
图4 不同胰蛋白胨质量浓度下氨氮的去除情况Fig.4 Removal of ammonia at different tryptoneconcentrations
2.3 菌株的高密度产芽孢发酵条件
2.3.1 发酵培养基的确定
考虑到芽孢杆菌产芽孢的共性,为提高优化效率,以培养基1~6进行初始发酵培养基的筛选。结果如图5所示。菌株在培养基6中,24 h发酵芽孢数最高为1.23×109CFU/mL,因此选定培养基6为初始发酵培养基。但是,培养基6发酵过程中,B4发酵后期出现大量菌体自溶现象,需要进行进一步优化。

图5 培养基1~6号发酵芽孢数Fig.5 Number of spores in 1-6 fermentation medium
发酵培养基的碳氮比不当,可能引起细菌生长过快造成的菌体发酵后期自溶现象,导致一部分菌体无法形成芽孢,并且过高含量的碳氮源增加发酵成本,因此本实验选择了较低的碳氮比(质量比)进行发酵优化,结果见图6所示。当培养基中碳氮比为0.33和0.67时,发酵后期时因营养不足,菌体出现大量自溶,最终无芽孢产生。当培养基中碳氮比为1.32和2.64时,菌体发酵后期无自溶现象产生,分别用36 h的菌液进行芽孢平计数,碳氮比为2.64时,芽孢数为1.54×109CFU/mL,芽孢率为70%;碳氮比为1.32时,芽孢数为2.3×109CFU/mL,芽孢率为95.7%,芽孢数是初始发酵培养基碳氮比未优化之前的1.8倍,因此将发酵培养基的碳氮比定为1.32。

图6 不同碳氮比对芽孢产生的影响Fig.6 Effect of different C/N on spore production
2.3.2 3 L发酵罐葡萄糖补料发酵
根据实验前期摇瓶发酵数据,发酵过程中碳源含量极大影响了菌株B4最终的发酵芽孢数,太低或太高都会影响细菌前期生长速度,从而出现发酵后期菌体自溶而无法形成芽孢的现象,因此本实验进行了罐上的葡萄糖补料控制。发酵过程中,未进行补料时,发酵芽孢数最低为2.2×109CFU/mL(图7-a),以20 g/(L·h)葡萄糖进行补料时,菌体在补料过程中浓度快速增加,待菌体浓度达到顶点后停止补料,这时菌体大量自溶,菌体浓度大幅降低,最终发酵芽孢数为5.62×109CFU/mL(图7-c);以10 g/(L·h)葡萄糖进行补料时,菌体保持较平缓的增长状态,菌体浓度达到顶点后停止补料,菌体仅出现了发酵后期正常的少量自溶现象,最终发酵芽孢数为1.12×1010CFU/mL(图7-b),是未补料时芽孢数的5倍左右,为最高发酵芽孢数。
2.4 B4菌剂对模拟养殖水体中氨氮的降解
将上述产芽孢发酵液,与玉米芯粉混合干燥后制得菌剂,其中芽孢含量为2×1010CFU/g。我国的水产养殖实例表明,水体污染程度不同,其中所含无机氮的浓度也有差别[22],因此模拟不同浓度氨氮水体进行试验,结果如图8所示。
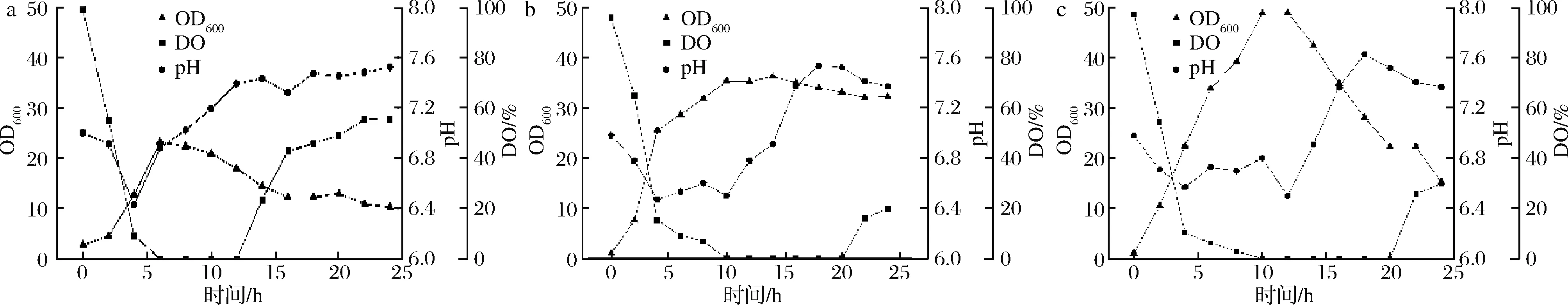
a-不补料;b-10 g/(L·h)葡萄糖补料;c-20 g/(L·h)葡萄糖补料图7 葡萄糖补料发酵过程Fig.7 Glucose fed fermentation process

图8 B4菌剂对模拟养殖水体中氨氮的降解Fig.8 Degradation of ammonia in simulated aquaculturewater by B4 microbiological agent
在1、10、20 mg/L的低质量浓度氨氮的水体中,12 h菌剂的氨氮去除率可达100%,在50 mg/L高质量浓度氨氮的水体中,12 h的菌剂的氨氮去除率为94%,平均去除率为3.92 mg/(L·h),48 h后,氨氮质量浓度略有回升,可能是因为菌体生长后期自溶释放了一部分氨氮。菌剂对模拟养殖水体中氨氮的快速去除表明它在实际应用中具有良好潜力。
3 结论
以去除氨氮的能力为主要指标,筛选出1株可用于快速去除养殖水体中氨氮的解淀粉芽孢杆菌(B.amyloliquefaciens)B4,该菌株对100 mg/L氨氮以及50 mg/L亚硝酸盐氮的去除率分别为92.32%和100%,通过优化发酵条件,发酵产芽孢数达到1.12×1010CFU/mL,制得的菌剂用于1~50 mg/L不同氨氮质量浓度的模拟养殖水体,12 h氨氮去除率达 94%以上。综上所述,表明该菌株在水产养殖业具有利用潜力。

