双歧杆菌生物膜形成规律及其表面性质相关性研究
朱如意,杭锋,张灏,,李元昆,赵建新,陈卫,陆文伟,*
1(江南大学 食品学院,江苏 无锡,214122) 2(江南大学(扬州)食品生物技术研究所,江苏 扬州,225004) 3(新加坡国立大学 杨璐龄医学院微生物学系,新加坡,119077)
双歧杆菌是人体和动物肠道内的固有菌群,在维护肠道微生态稳定和调节宿主生理功能方面具有重要的作用[1],被制成菌粉广泛应用于食品、保健品和药品等领域。双歧杆菌因其特殊的生理特性,在菌粉干燥制备过程中极易死亡。目前主要通过干燥保护剂配方的优化[2]、干燥工艺条件的改良[3]和微胶囊化技术[4]来提高其存活率,但这些方法治标不治本,提高双歧杆菌自身抗逆性可能是提高生存率的有效选择。生物膜的形成是微生物适应环境的重要机制,可显著提高细菌的抗逆性。研究发现,高密度生物膜样鼠李糖乳杆菌微胶囊比浮游状态抗冷冻干燥和耐热性分别提高了40和12~8 000倍[5]。双歧杆菌具有生物膜形成能力[6],且形成生物膜的双歧杆菌比浮游细菌具有更好的抗逆性[7]。
生物膜的形成主要分为粘附阶段、生长阶段、成熟阶段和扩散阶段[8]。初始粘附阶段是生物膜形成的关键步骤,它代表着从浮游生物到生物膜模式的转折[9]。初始粘附受多种因素影响,细菌和载体表面的性质如亲疏水性[10]、电荷性[11]等,环境因素[12]如温度、pH都会影响细菌的粘附。根据扩展的Derjaguin-Landau-Verwey-Overbeek理论,影响微生物粘附的主要非共价相互作用是范德华力、静电力、路易斯酸碱和布朗运动力。细菌细胞的疏水性代表细胞间的吸引力,而亲水性则反映细菌细胞间的斥力[13]。因此,在理论上,随着细菌表面疏水性的增加,附着在材料表面的细菌数量也随之增加。细菌表面的疏水性和路易斯酸碱特性在细菌与非生物表面的粘附中起着重要作用,因此可用于解释细菌与材料表面的附着[14]。但也有研究认为,菌株表面的物理和化学特征不能完全解释细菌的粘附性[15],且这些性质如何影响细菌与材料表面之间的粘附尚不清楚[16]。
本文研究了双歧杆菌的生物膜形成能力、生物膜结构和活性的差异性,并且探究了双歧杆菌的表面疏水性和路易斯酸碱特性与生物膜形成能力之间的相关性,为了解双歧杆菌的生物膜形成提供了理论基础。
1 材料与方法
1.1 菌株与试剂
所有双歧杆菌和变形链球菌(Streptococcusmutans)ATCC 25175均由江南大学食品微生物培养中心提供。
牛肉膏、胰蛋白胨、葡萄糖、酵母粉、MgSO4·7H2O、K2HPO4、无水乙酸钠、MnSO4·H2O、柠檬酸氢二铵、L-半胱氨酸盐酸盐、吐温-80、NaCl、KCl、KH2PO4、Na2HPO4、二甲苯、氯仿、乙酸乙酯,购自国药集团。FilmTracer LIVE/DEAD生物膜检测试剂盒购自Invitrogen公司。
1.2 仪器与设备
ZHJH-C1109C超净工作台,上海智诚分析仪器制造有限公司;DG250厌氧工作站,Whitley公司;Multiscan GO全波长酶标仪,Thermo公司;ST40R冷冻离心机,Eppendorf公司;SU8100冷场发射扫描电子显微镜,日本株式会社日立高新技术公司;LSM710激光共聚焦显微镜,德国蔡司公司。
1.3 实验方法
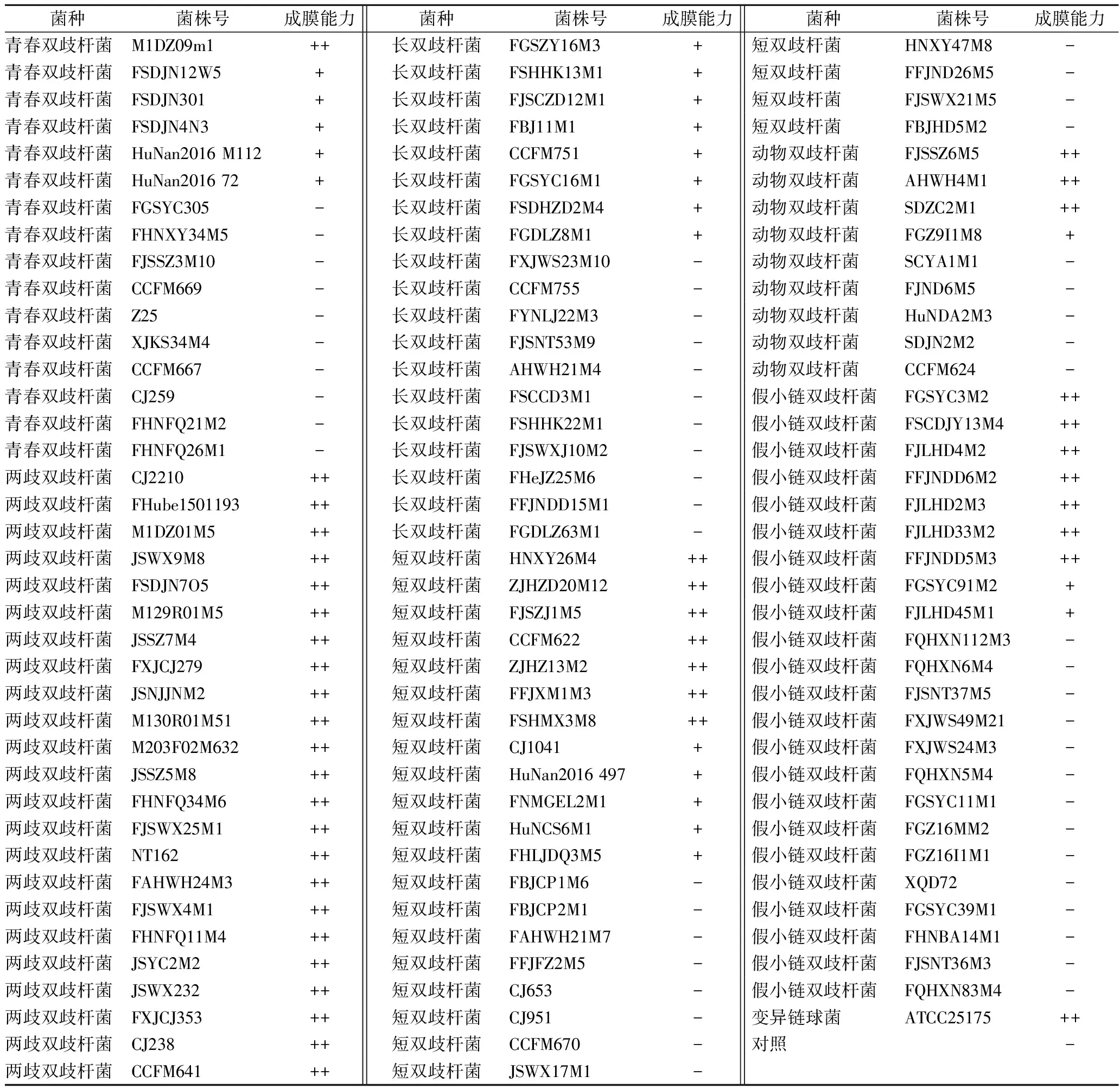
1.3.1 双歧杆菌生物膜形成能力测定
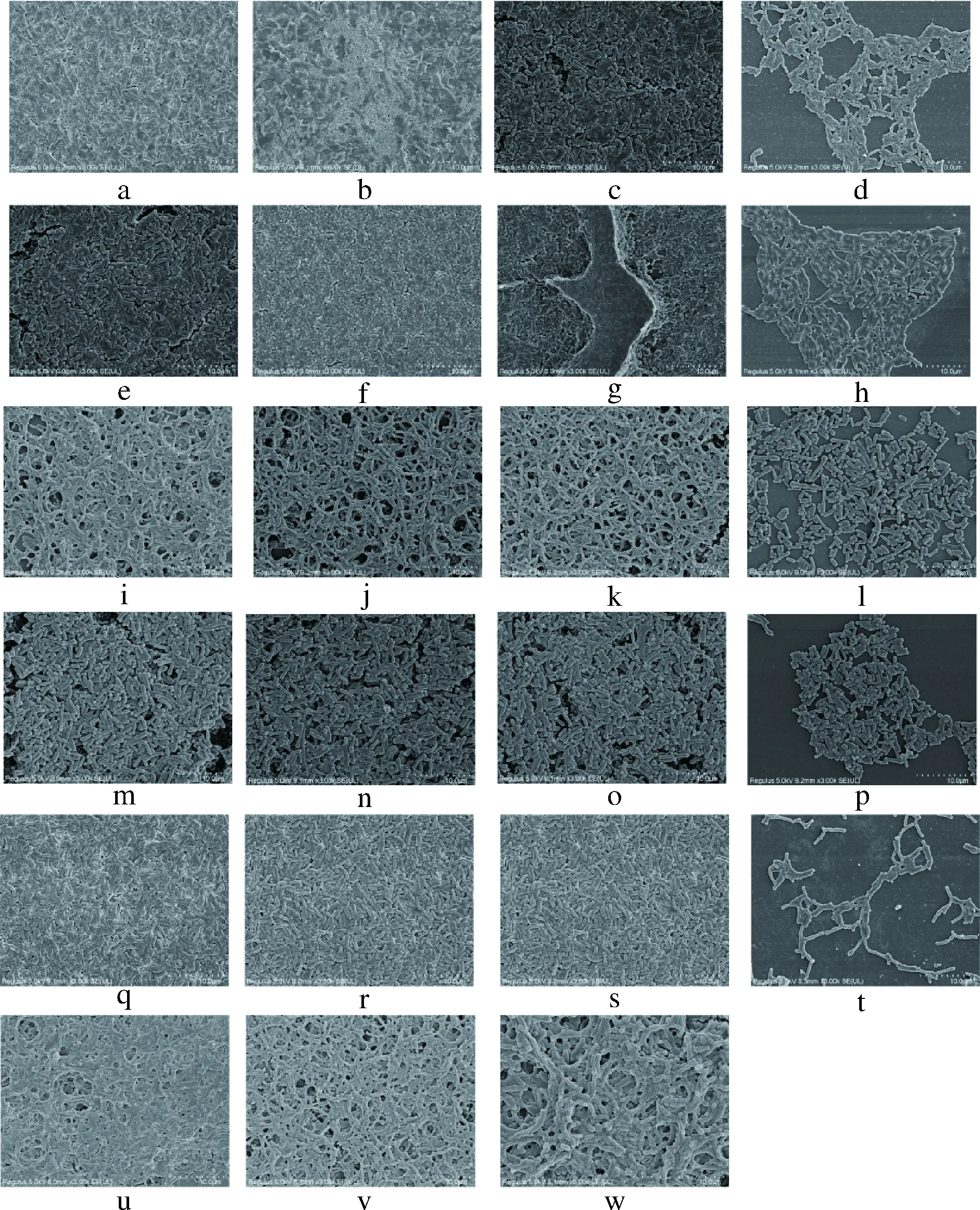
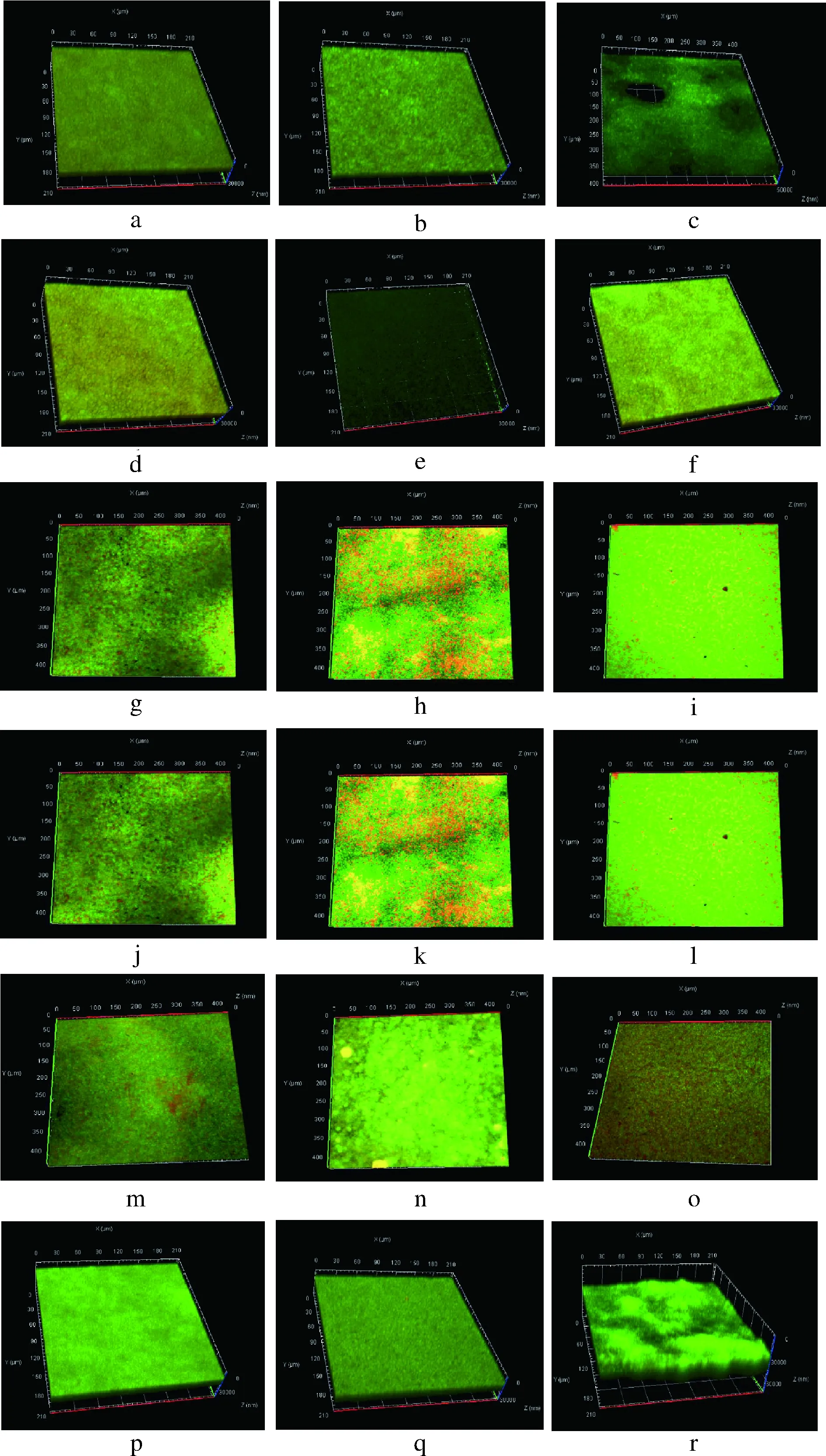
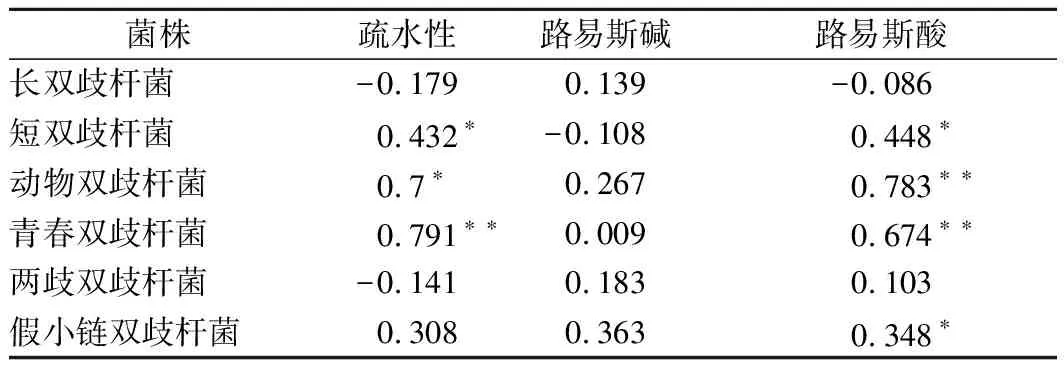
根据STEPANOVIC等[17]的方法进行改进,具体方法如下:将活化3代的双歧杆菌按2%接种量混合于MRS培养基中,每孔200 μL加入96孔板中,于37 ℃厌氧静置培养24 h。用PBS缓冲液洗涤3次,以洗去浮游菌。自然干燥后加入200 μL的0.1%结晶紫溶液室温染色30 min,用PBS缓冲液洗涤3次后每孔加入200 μL的体积分数95%乙醇,在酶标仪波长600 nm处测定吸光值。以相同条件下S.mutans成膜能力为阳性对照组,MRS培养基为空白对照,每个实验组设3个平行。成膜能力用-、+、++表示(-为OD600 nm≤1,表示双歧杆菌不成膜;+为1 1.3.2 扫描电子显微镜(scanning electron microscopy,SEM)测定双歧杆菌生物膜结构 在6孔板中放入无菌盖玻片,加入新鲜MRS培养基5 mL,并按照1%的接种量接种双歧杆菌,37 ℃厌氧培养24 h。取出盖玻片,用无菌水清洗3次,洗去表面浮游菌,用体积分数2.5%戊二醛溶液在4 ℃下避光固定16 h,用无菌水清洗并依次用体积分数15%、30%、50%、70%、100%乙醇梯度脱水,喷镀金粉,放入SEM中观察,加速电压5 kV,放大倍数3 000倍[6]。 1.3.3 激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)测定双歧杆菌生物膜 双歧杆菌生物膜形成方法同1.3.2。用无菌水清洗形成生物膜的盖玻片后立即避光染色,将3 μL的SYTO 9染料和3 μL碘化丙啶染料加入1 mL无菌水中来制备工作溶液。每个长有生物膜的玻片加入200 μL染液,避光孵育30 min,用无菌水清洗3次,洗去多余染料。用CLSM进行观察,目镜倍数为10倍,物镜倍数为20倍,激发光的波长设为480 nm/500 nm,以步距2 μm、最强信号点为焦平面进行断层扫描。用ZEN软件将扫描所得的图像重组成3D图像[19]。 1.3.4 双歧杆菌表面疏水性和路易斯酸碱特性的测定 根据细菌粘附溶剂法(bacteria adhesion to the solvent,BATS)方法,并稍作修改[20]。实验使用的溶剂为氯仿、乙酸乙酯和二甲苯。离心收集双歧杆菌(6 500×g,5 min),然后重悬于0.1 mol/L的 KNO3溶液(pH 6.2)中调节OD600为0.6。将细菌悬浮液(3 mL)与每种溶剂(1 mL)充分混合。测量水相在600 nm处的吸光度(A1)之前,将混合物放置20 min以确保两相完全分离。双歧杆菌对每种溶剂的粘附力按公式(1)计算: (1) 疏水性可分为3类:强疏水性(>50%)、中疏水性(20%~50%)和亲水性(<20%)[21]。路易斯酸碱特性分为低(<35%)、中(36%~70%)和高(71%~100%)[22]。 1.3.5 数据处理 采用Microsoft Excel 2016 进行数据处理,使用SPSS 16.0进行Spearman相关性分析,(**)P≤0.05,被认为数据具有统计学差异,(*)P<0.01,被认为数据具有显著差异。使用GraphPad Prism 7软件绘制图表。 为了研究不同双歧杆菌的生物膜形成差异性,通过微孔板实验测定了包括青春双歧杆菌(n=16),两歧双歧杆菌(n=23),长双歧杆菌(n=19),短双歧杆菌(n=24),动物双歧杆菌(n=9)及假小链双歧杆菌(n=23)共114株双歧杆菌的成膜能力,并以S.mutansATCC 25175作为阳性对照。结果如表1所示,所有的两歧双歧杆菌菌株都显示出强成膜性,长双歧杆菌则普遍表现为弱成膜性,且57.90%菌株为非成膜菌株。而在其他4种双歧杆菌中,以短双歧杆菌为例,即使是同一菌种,不同菌株间的成膜能力也表现出显著差异性:包括HNXY26M4、FJSZJ1M5、ZJHZ13M2、ZJHZD20M12、CCFM622、FFJXM1M3、FSHMX3M在内的29.17%的菌株为强成膜性菌株,而CJ1041、HuNan2016 497、 FNMGEL2M1、HuNCS6M1、FHLJDQ3M5等20.83%的菌株为弱成膜性菌株,FBJCP1M6、FBJCP2M1、FAHWH21M7、FFJFZ2M5、CJ653、CJ951、CCFM670、JSWX17M1、HNXY47M8、FFJND26M5、FBJHD5M2、FJSWX21M5等50%的菌株则为非成膜菌株,这种差异性也同样存在于动物双歧杆菌、青春双歧杆菌及假小链双歧杆菌中。由此可见,双歧杆菌的生物膜形成能力存在一定的种间和株间差异。林炳谕[7]研究认为,双歧杆菌的成膜规律存在菌株特异性而非菌种特异性,60%的长双歧杆菌具有成膜能力,与本研究结果存在差别。由此进一步表明,双歧杆菌的生物膜形成能力具有显著的菌株差异性,同时本研究进一步发现双歧杆菌成膜也存在特定的菌种成膜规律。BUJNAKOVA等[23]发现除了嗜酸乳杆菌G9表现出非常低的能力外,植物乳杆菌L2-1、发酵乳杆菌G3和202表现出非常强的生物膜形成能力,发酵乳杆菌G8、VT1、鼠李糖乳杆菌G10、183、植物乳杆菌85、干酪乳杆菌91表现出中等的生物膜形成能力。由此表明双歧杆菌和乳杆菌之间生物膜形成能力的差异存在普遍的菌种和菌株特异性。生物膜的形成是一个具有多个因素决定的复杂过程,导致差异的原因值得进一步研究。 表1 双歧杆菌生物膜形成能力Table 1 The biofilm-forming ability of Bifidobacterium 注:-: OD600 nm≤1,不成膜;+: 1 为了研究双歧杆菌生物膜的空间结构,利用SEM揭示了不同的双歧杆菌生物膜的结构差异,结果如图1所示。成膜菌株形成的生物膜处于多层紧密聚集的状态,菌体堆叠的相对密集且菌体表面附着许多细胞外聚合物,具有高度组织的结构状态。但是,非成膜双歧杆菌处于游离状态,菌体细胞的形态清晰可见。动物双歧杆菌和两歧双歧杆菌表现出网状结构,而其他双歧杆菌则紧密聚集形成厚层。长双歧杆菌FGSZY16M3(图1-b)形成的生物膜结构与另外2株长双歧杆菌不同,它分泌了更多的胞外聚合物将菌体紧密包裹在一起。类似地,短双歧杆菌ZJHZ13M2形成的生物膜(图1-g)在结构上也与另外2株长双歧杆菌表现出一定的差异,其菌体表现出空间表面平铺以及垂直堆叠的状态。这表明双歧杆菌生物膜空间结构具有一定的种间及株间差异性。TOLKER-NIELSEN等[24]指出,每个微生物的生物膜结构都是独特的,这与我们的发现相似。生物膜主要由细菌和胞外多糖组成,胞外多糖被认为是生物膜的主要基质材料,胞外多糖组成和结构以及含量的不同可能会对生物膜结构产生重大影响[25]。RZHEPISHEVSKA等[26]在研究过程中发现,在不同材料上铜绿假单胞菌会形成具有高水平环状二鸟苷酸(c-di-GMP)的蘑菇结构和扁平生物膜。 a~d-长双歧杆菌FBJ11M1,FGSZY16M3,FSHHK13M1,FJSWXJ10M2;e~f-短双歧杆菌FJSZJ1M5,HNXY26M4,ZJHZ13M2,FBJCP1M6;i~l-动物双歧杆菌AHWH4M1,FGZ9I1M8,FJSSZ6M5,HuNDA2M3;m~p-青春双歧杆菌FSDJN12W5,M1DZ09M1,HuNan2016M112,Z25;q~t-假小链双歧杆菌FSCDJY13M4,FJLHD4M2,FFJNDD5M3,FQHXN5M4;u~w-两歧双歧杆菌JSWX232,FSDJN7O5,M12901M5图1 双歧杆菌生物膜的SEM(×3 000)图Fig.1 SEM(×3 000) images of biofilms formed byBifidobacterium 为了研究不同双歧杆菌生物膜的活性,利用CLSM揭示了生物膜活死菌分布的差异性,结果如图2所示。长双歧杆菌FGSZY16M3(图2-b)、FSHHK13M1(图2-c)、短双歧杆菌HNXY26M4(图2-e)、两歧双歧杆菌JSWX232(图2-p)、FSDJN7O5(图2-q)和M129R01M5(图2-r)形成的生物膜基本上没有死菌(绿色),表明这些生物膜具有较高的活性。但是其他生物膜具有不同比例的死亡细菌(红色),生物膜活性相应减弱。总体而言,活细菌的比例高于死细菌,但活菌与死菌的比例在不同菌株的生物膜之间有所不同。 a~c-长双歧杆菌FBJ11M1,FGSZY16M3,FSHHK13M1;d~f-短双歧杆菌FJSZJ1M5,HNXY26M4,ZJHZ13M2;g~i-动物双歧杆菌AHWH4M1,FGZ9I1M8,FJSSZ6M53;j~l-青春双歧杆菌FSDJN12W5,M1DZ09M1,HuNan2016M112;m~o-假小链双歧杆菌FSCDJY13M4,FJLHD4M2,FFJNDD5M3;p~r-两歧双歧杆菌JSWX232,FSDJN7O5,M12901M5图2 双歧杆菌生物膜活死菌分布的CLSM图Fig.2 CLSM images of the distribution of live and deadbacteria in biofilms formed by Bifidobacterium 为了进一步探究影响双歧杆菌生物膜形成的限制因素,利用BATS法测定了双歧杆菌表面疏水性及路易斯酸碱特性,并与其成膜能力进行相关性分析。研究发现,短双歧杆菌、动物双歧杆菌和青春双歧杆菌的表面疏水性和路易斯酸特性与其成膜能力呈正相关(rs分别为0.432、0.7、0.791、0.448、0.783、0.674)。从图3可以看出,短双歧杆菌CJ951和CJ653以及动物双歧杆菌CCFM624等菌株具有与成膜菌株相似的特性,但却不具备生物膜形成能力。此外,假小链双歧杆菌的生物膜形成能力也与路易斯酸特性呈正相关性(rs=0.348)。长双歧杆菌的生物膜形成能力普遍较弱,并且成膜菌株与非成膜菌株表面特性没有显著差异。表面性质与生物膜形成能力之间没有相关性(rs分别为-0.179、0.139、-0.086,P>0.05)。所有两歧双歧杆菌都显示出很强的生物膜形成能力,具有较高的表面疏水性和路易斯酸特性,且表面路易斯碱特性也高于其他双歧杆菌。然而,相关性分析表明,两歧双歧杆菌表面特性与其生物膜形成能力之间没有相关性(rs分别为-0.141、0.183、103,P>0.05)。 a-长双歧杆菌;b-短双歧杆菌;c-动物双歧杆菌;d-青春双歧杆菌;e-两歧双歧杆菌;f-假小链双歧杆菌图3 双歧杆菌表面疏水性和路易斯酸碱特性Fig.3 Hydrophobicity and Lewis acid-base characteristics of Bifidobacterium strains 因此,双歧杆菌表面特性与其成膜能力具有一定的正相关性,但是相关性在种水平上有所不同。由于菌株的生长方式、阶段和培养基成分等的不同,疏水性在菌种和菌株之间甚至在同一菌株上也有所不同[27]。当菌株表面的疏水性不同时,疏水相互作用将相应地改变,从而导致生物膜形成能力的差异。AMBALAM等[28]研究发现,在胆汁的刺激下双歧杆菌的疏水性及成膜能力都有所增强。此外,MAZUMDER等[29]也发现,高疏水性的突变菌株在各种材料表面的生物膜形成能力均高于野生型菌株。路易斯酸碱相互作用涉及细菌壁接近聚合物基质时可能发生的离子转移、共价键转移或氢键转移[30]。电子受体或供体元素组的差异会影响路易斯酸碱特性的大小,从而导致细菌与载体表面的粘附和随后的生物膜形成差异。SAMOT等[31]研究发现,一些黏附性好的菌株表现出较强的给电子能力。 表2 双歧杆菌表面特性与其成膜能力的Spearman相关性Table 2 Spearman's correlations among Bifidobacteriumsurface characteristics and biofilm-forming ability 注:**,P<0.01;*,P<0.05 本文研究了青春双歧杆菌、两歧双歧杆菌、长双歧杆菌、短双歧杆菌、动物双歧杆菌及假小链双歧杆菌共114株双歧杆菌的生物膜成膜特性,研究表明双歧杆菌生物膜的形成能力存在一定的种间和株间差异性,两歧双歧杆菌为强成膜菌株,长双歧杆菌为弱成膜菌株,而短双歧杆菌、动物双歧杆菌、青春双歧杆菌及假小链双歧杆菌的成模性存在菌株差异。不同双歧杆菌形成的生物膜空间结构不同,动物双歧杆菌和两歧双歧杆菌的生物膜表现为蘑菇结构,长双歧杆菌、短双歧杆菌、青春双歧杆菌和假小链双歧杆菌所形成的生物膜则是扁平状的。此外,研究还发现双歧杆菌表面疏水性及路易斯酸碱特性与其成膜能力呈一定的正相关性,但这种相关性在菌种水平上显著不同。短双歧杆菌、动物双歧杆菌和青春双歧杆菌表面疏水性及路易斯酸特性与其成膜能力呈正相关性,假小链双歧杆菌的成膜能力仅与其路易斯酸特性有关,而长双歧杆菌和两歧双歧杆菌成膜能力与其表面特性无关。
2 结果与分析
2.1 不同双歧杆菌生物膜形成能力分析
2.2 双歧杆菌生物膜空间结构差异
2.3 双歧杆菌生物膜活、死菌分布差异
2.4 双歧杆菌表面疏水性及路易斯酸碱特性对其成膜的影响

3 结论

