茶叶微生物固态发酵中咖啡碱降解途径初探
郑城钦,马存强,2,张正艳,李肖宏,吴婷婷,周斌星*
茶叶微生物固态发酵中咖啡碱降解途径初探
郑城钦1,马存强1,2,张正艳1,李肖宏1,吴婷婷1,周斌星1*
1. 云南农业大学龙润普洱茶学院,云南 昆明 650201;2. 昆明大朴茶业有限公司,云南 昆明 650224
为探究微生物作用下咖啡碱的降解产物与途径,将普洱茶发酵中筛选鉴定的NRRL250(聚多曲霉)、NRRL4789CBS137324和CBS253.31等优势菌株分别接种至晒青毛茶进行单菌种固态发酵,并采用高效液相色谱(HPLC)测定咖啡碱、可可碱、茶碱的含量,探究微生物对咖啡碱代谢的影响;另外,基于UHPLC-QTOF-MS代谢组学技术,以灭菌处理组(ST组)和原料组(RM组)为对照,对聚多曲霉接种发酵样进行代谢组学分析。结果表明,NRRL4789CBS137324和CBS253.31等优势菌株对咖啡碱等嘌呤类碱代谢均无显著影响,而在聚多曲霉接种发酵中,咖啡碱含量显著下降(<0.05),降幅达83.89%;茶碱含量显著增加(<0.05),发酵末期含量为(25.03±1.17) mg·g-1;而可可碱保持基本稳定。由此可知,聚多曲霉对咖啡碱降解代谢有显著影响。采用UHPLC-QTOF-MS方法检出茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤等9种与咖啡碱降解相关的代谢物。在聚多曲霉作用下,茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤、7-甲基黄嘌呤含量显著提高(<0.05)。茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤和1-甲基黄嘌呤与咖啡碱及其相关代谢物的-脱甲基化途径相关。1,7-二甲基尿酸、1-甲基尿酸与咖啡碱相关代谢物的氧化途径相关。由此可知,聚多曲霉为降解普洱茶咖啡碱的优势菌株,且具有将咖啡碱转化为茶碱的潜在能力;在咖啡碱降解代谢过程中,存在聚多曲霉作用下的-脱甲基化和氧化,并以-脱甲基化为主。
普洱茶;固态发酵;聚多曲霉;咖啡碱;降解途径
黑茶是一类由微生物主导下的后发酵茶类[1]。普洱茶(熟茶)是以云南大叶种茶树鲜叶[(L.) Var.(Masteas Kitamura)]制成的晒青毛茶为原料,采取特定的加工工艺,加工形成具有独特品质特征的茶叶[2]。渥堆发酵是普洱茶(熟茶)品质形成的关键工序。在普洱茶渥堆发酵中,咖啡碱含量多呈现显著增加的变化趋势[3]。然而,由于微生物的影响,在普洱茶渥堆发酵中偶尔会出现减少的趋势[4-7]。大多数真菌和细菌对嘌呤碱的利用有限[8],前人仅在茶园和咖啡园土壤中筛选鉴定出几株可降解咖啡碱的有效菌株[9-10]。Zhou等[11]首次在普洱茶渥堆中发现可有效降解咖啡碱的菌株为聚多曲霉,其同源性高达99.8%。
咖啡碱(1,3,7-三甲基黄嘌呤)是茶叶中主要的生物碱和呈味物质[12]。研究证明,茶叶生物碱对人体心血管系统、生殖系统、呼吸和循环系统等方面的生理活性均有一定影响[13-16]。但咖啡碱的过量摄入不仅易造成肠胃功能失调、心悸、嗜睡、血压升高等不良反应,甚至会增加失眠、焦虑、心脏负荷,降低生育率,骨质疏松等健康问题[17-19]。因此,人们十分关注与生物碱含量等相关的茶饮料的开发,对低咖啡碱饮料的需求也越来越迫切。
本文将普洱茶渥堆发酵中筛选鉴定出的优势菌株分别接种至晒青毛茶中进行茶叶单菌种发酵,探究其对咖啡碱代谢的影响,从而确定可降解咖啡碱的优势菌株,并采用UHPLC-QTOF-MS技术探究可降解咖啡碱菌株作用下的咖啡碱降解代谢途径,为优势菌株在茶叶加工中的应用提供一定参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
云南大叶种群体种[Var.(JW Masteas Kitamura)]晒青毛茶购自云南昆明茶叶市场。琼脂粉(生化试剂)购自北京奥博星生物技术有限公司;乙腈(色谱纯)购自美国飞世尔有限公司。咖啡碱(≥99%)、可可碱(≥99%)、茶碱(≥99%)标准品购自美国Sigma公司。
试验菌株:NRRL250(聚多曲霉,GenBank登录号:EF652450)、NRRL4789(GenBank登录号:NR137468)CBS137324(GenBank登录号KJ775437)和CBS253.31(GenBank登录号:MH855205)筛选于普洱茶渥堆样中,在实验室–20℃条件下纯甘油保存。
1.1.2 仪器与设备
高效液相色谱仪(Agilent 1200型,美国安捷伦公司)。超高效液相色谱仪(Agilent 1290型,美国安捷伦公司)。高分辨质谱仪(Triple TOF® 6600型,美国AB Sciex公司)。色谱柱[ACQUITY BEH Amide型,规格(2.1 mm×100 mm×1.7 μm),Waters公司]。
1.2 方法
1.2.1 孢子菌悬液的制备
真菌菌株经PDA培养基活化后,用无菌水进行洗脱,转移至锥形瓶,充分振荡摇匀,并调节孢子浓度约为1.0×108CFU·mL-1(Colony forming units,CFU)于4℃保存备用。
1.2.2 真菌菌株的茶叶固态发酵[20]
称取20 g晒青毛茶,其含水量为6.25%,与12.25 mL蒸馏水混合,使得固态发酵体系含水量为38%。1×105Pa灭菌后,每培养瓶接种1 mL目标菌株的种子菌悬液,并以接种1 mL无菌水的发酵组作为对照。培养瓶均放置于恒温恒湿培养箱内(30℃,85%)进行固态发酵。参照普洱茶渥堆发酵方法,每3 d取样1次,3次重复,采取HPLC测定茶样中咖啡碱、可可碱和茶碱含量[21]。收集聚多曲霉接种发酵9 d时60℃条件下的烘干样作为接种发酵组(IF),并以灭菌组(ST)和原料组(RM)为对照,分别进行代谢组学分析。
1.2.3主要嘌呤碱含量测定
咖啡碱、可可碱、茶碱等主要嘌呤碱含量采用高效液相色谱法(HPLC)测定。上样液制备:称取3 g磨碎试样于500 mL锥形瓶中,加沸蒸馏水450 mL,立即移入沸水浴,浸提45 min(每隔l0 min摇动1次)。浸提完毕后立即趁热减压过滤,并定容至500 mL。茶汤经0.45 µm水系膜过滤后进样,进样量为10 µL。色谱条件[22-23]:流动相为乙腈和0.2%乙酸水溶液的混合溶液,A相为乙腈,B相为0.2%乙酸水溶液,流速为1 mL∙min-1。色谱柱:安捷伦反相Cl8色谱柱(250 mm×4.6 mm×5 μm);检测波长为280 nm;柱温为30℃。洗脱程序为:0 min,A相8%,B相92%;50 min,A相31%,B相69%。采取梯度洗脱,程序运行结束10 min后进下一样品。
1.2.4 茶叶代谢物萃取与上机检测
称取150 mg样品于2 mL离心管中,加入1 500 μL提取液(甲醇︰乙腈︰水=2︰2︰1),再加入30 μL核糖醇,涡旋混匀10 s;加入瓷珠,45 Hz研磨仪处理4 min,超声15 min(冰水浴);13 000 r·min-1离心15 min后提取上清液用于代谢组学检测[24]。
用于代谢组学分析的液质联用系统由Agilent 1290型超高效液相色谱仪串联Triple TOF® 6600型高分辨质谱仪组成。流动相色谱条件:A相为25 mmol·L-1醋酸铵+25 mmol·L-1氨水,B相为100%乙腈,进样体积1 μL,流速500 μL·min-1;洗脱程序为:0~0.5 min,A相5%,B相95%;7 min,A相35%,B相65%;8~9 min,A相60%,B相40%;9.1~12 min,A相5%,B相95%。
质谱条件:AB 6600 Triple TOF质谱仪能够在控制软件(Analyst TF 1.7,AB Sciex)控制下基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。其电喷雾电离(ESI)离子源参数设置如下:在正、负离子模式下采集数据,喷雾电压分别为5 500 V和–4 500 V。雾化气(GS1)、辅助加热气(GS2)和气帘气(CUR)的压力分别为60 Psi(1 Psi=6.89 kPa)、60 Psi、30 Psi,离子源温度550℃,轰击能量为35 eV;15张二级谱图每个50 ms。
1.2.5 数据处理
采用XCMS做峰寻找、峰对齐等数据处理(XCMS版本号:1.41.0)。
物质鉴定的数据处理及匹配:设minfrac为0.5,cutoff为0.8。随后基于XCMS开发的xcms4dda和xcms4lipid程序及自建库进行数据处理,其筛选原则是在forward或reverse只要其中有1个被鉴定出来即保留该peak,首先对已鉴定的二级数据的peak进行筛选。然后对一级和二级数据的peak进行匹配,寻找一级数据中的peak在二级数据中对应的peak。按照mz tolerance±25 μg·mL-1进行匹配。
1.2.6 数据分析
正交偏最小二乘法-判别分析(OPLS-DA):使用SIMCA软件(V14.1,Sartorius Stedim Data Analytics AB,Umea, Sweden)对数据进行对数(Log)转换加UV格式化处理。首先对第一主成分进行OPLS-DA建模分析,模型的质量用7折交叉验证(7-fold cross validation)进行检验;然后用交叉验证后得到的2(模型对分类变量的可解释性)、2(模型对分类变量的可解释性)和2(模型的可预测性)对模型有效性进行评判;最后通过置换检验(Permutation test),随机多次改变分类变量的排列顺序得到不同的随机Q值,对模型有效性做进一步的检验。各组对比OPLS-DA模型的模型累积解释率见表1。

表1 OPLS-DA模型参数表
注:2(cum):代表模型对变量的累计解释度;2(cum):代表模型对变量的累计解释度;2(cum):模型的可预测性
Note:2(cum): represents the cumulative interpretation ofvariables by the model,2(cum): represents the cumulative interpretation ofvariables by the model, and predictability of the2(cum): model
单变量统计分析(UCA):差异化合物筛选和鉴定本项目使用的卡值标准为Student′s检验的值小于0.05,同时OPLS-DA模型第一主成分的变量投影重要度(Variable importance in the projection,VIP)大于1。
差异代谢物的代谢通路分析(Pathway analysis):通过差异代谢物对KEGG、PubChem等权威代谢物数据库进行映射,对应物种(Thale cress)的通路数据库进行搜索和代谢通路分析。
2 结果与分析
2.1 茶叶微生物固体发酵中咖啡碱、可可碱、茶碱含量的变化
在NRRL4789CBS137324和CBS253.31接种发酵中,在不计干物质损耗的前提下,咖啡碱含量明显有大幅度增加,增幅分别为23.32%、22.24%和16.46%,对咖啡碱降解代谢均无显著影响(图1)。仅在聚多曲霉(NRRL250接种发酵中,发现咖啡碱含量显著下降(<0.05),含量由原料中的(34.39±0.686) mg·g-1降低至发酵末期的(5.54±0.548) mg·g-1,降幅高达83.89%。因此,聚多曲霉应该是可降解咖啡碱的有效菌株,可用于探究微生物作用下的咖啡碱降解代谢。
在接种发酵和灭菌处理中可可碱含量均有所增加(图2),特别在NRRL4789CBS137324和CBS253.31接种发酵中,可可碱有大幅度增加,增幅分别为21.10%、20.24%、11.58%。在灭菌处理中,可可碱的增幅约6.09%。在聚多曲霉接种发酵中可可碱仅有小幅度增加,增幅仅为4.15%左右。
由图3可见,在NRRL4789、CBS13732和CBS253.31接种发酵和灭菌处理中,茶碱含量均无显著性增加(>0.05)。在聚多曲霉接种发酵中,茶碱显著增加(<0.05),由最初的0.43 mg·g-1增加至(25.03±1.172) mg·g-1,增幅为原料的57倍以上。结合图1中咖啡碱含量变化可知:在聚多曲霉发酵中,茶碱主要来自于咖啡碱的降解。
2.2 差异代谢物筛选
为进一步分析差异显著的代谢物,将接种发酵组(IF)对原料组(RM)和灭菌组(ST)之间建立OPLS-DA模型并进行两两相互比较,以找出样品间差异代谢产物。由表1可知,接种发酵组(IF)对原料组(RM)包含2个成分,其拟合参数为2=0.865,2=1,2=0.997,表明该模型的稳定性和预测率较高;接种发酵组(IF)对灭菌组(ST)包含2个成分,其拟合参数为2=0.504,2=1,2=0.993,表明该模型的稳定性和预测率较高。对OPLS-DA模型进行置换检验,模型的排列检验结果如图4,由图4可知,模型验证结果参数:接种发酵组(IF)对原料组(RM)2截距为0.92,2截距为–0.51,发酵组(IF)对灭菌组(ST)2截距为0.8,2截距为–0.69,也表明该模型可靠,不存在过拟合现象。因此,采用建立的OPLS-DA模型进行后续的差异化合物筛选。
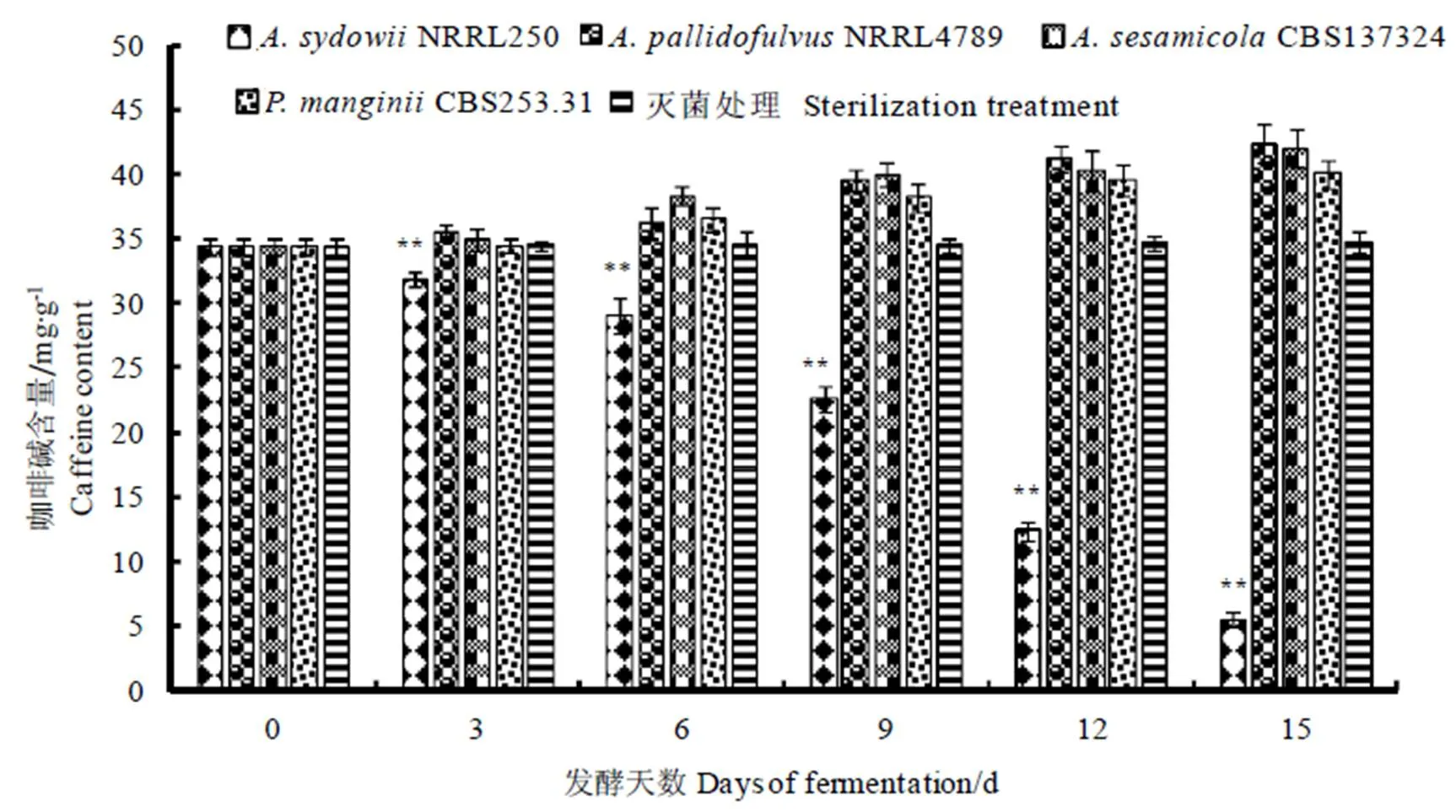
注:数值采用平均值±标准差表示,**表示同一处理下差异的显著性水平(P<0.05)。下同
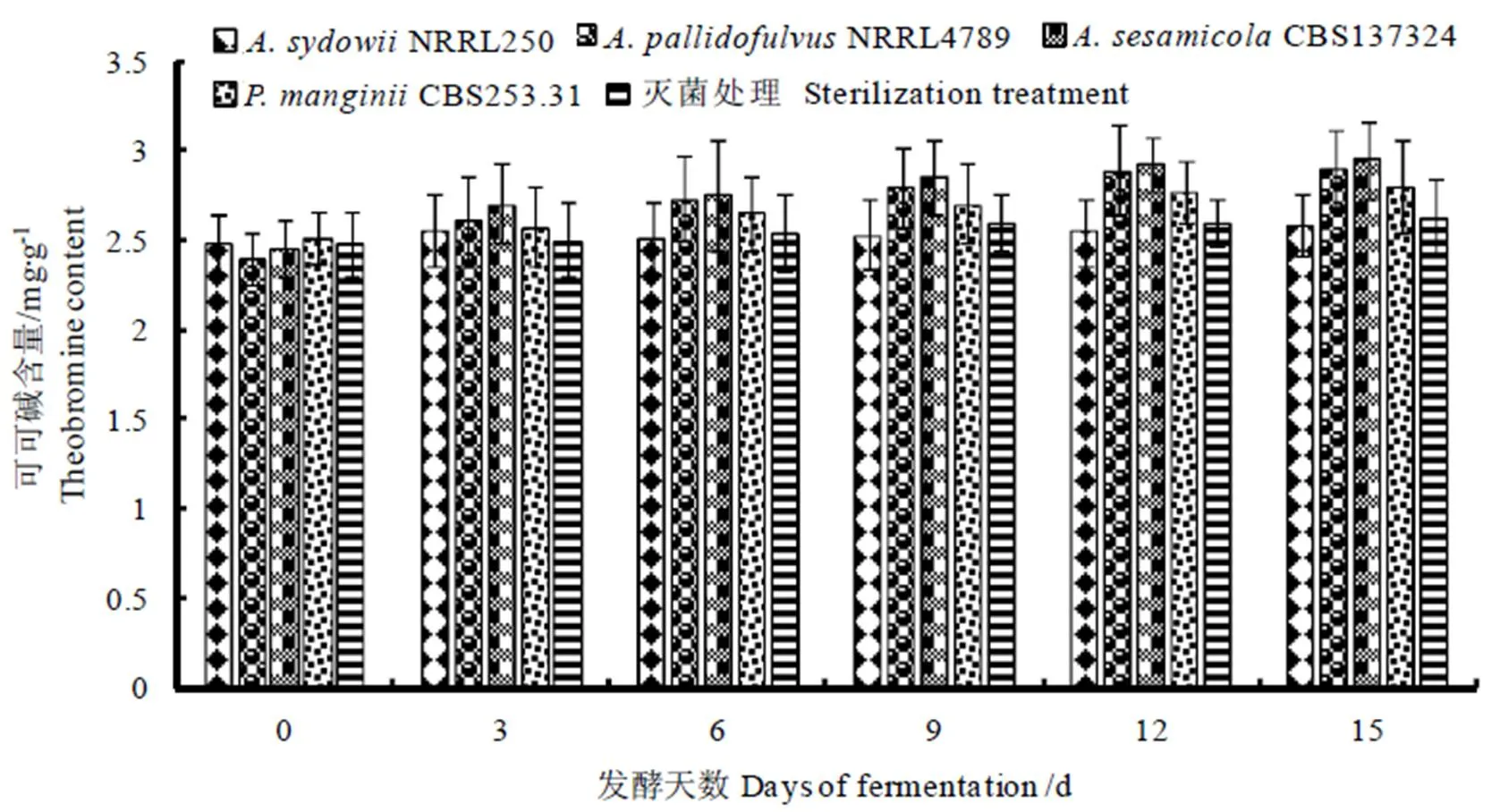
图2 单菌种接种发酵与灭菌处理中可可碱含量变化

注:数值采用平均值±标准差表示。**显示差异的显著性水平(P<0.05)

图4 IF-RM(a)和IF-ST(b)的差异代谢物OPLS-DA分析结果
2.3 聚多曲霉作用下的代谢通路富集分析
为探究微生物作用下咖啡碱降解代谢途径,采用UHPLC-QTOF-MS方法对聚多曲霉接种发酵组(IF组),与原料组(RM组)和灭菌处理组(ST组)为对照进行代谢组学分析。在正、负离子模式下,通过二级质谱分别定性匹配288种和146种代谢物。将代谢物在HDMB、PubChem和KEGG等数据库中进行匹配。正、负离子模式下,接种发酵组(IF组)和原料组(RM组)分别有92种和73种差异代谢物(VIP>1且<0.05);接种发酵组(IF组)和灭菌处理组(ST组)分别有92种和67种差异代谢物(VIP>1且<0.05)。
在正、负离子模式下,基于接种发酵组(IF组)对原料组(RM组)差异代谢物的代谢通路进行富集分析(图5)。接种发酵组(IF组)与原料组(RM组)在咖啡碱代谢(Caffeine metabolism)、嘌呤代谢(Purine metabolism)、苯丙烷代谢(Phenylalanine metabolism)、核黄素代谢(Riboflavin metabolism)、-亚麻酸代谢(-linolenic acid metabolism)、半乳糖代谢(Galactose metabolism)等方面存在显著差异。
在正、负离子模式下,基于接种发酵组(IF组)对灭菌处理组(ST组)差异代谢物的代谢通路进行富集分析(图6)。接种发酵组(IF组)与灭菌处理组(ST组)在苯丙烷代谢(Phenylalanine metabolism)、半乳糖代谢(Galactose metabolism)、核黄素代谢(Riboflavin metabolism)、-亚麻酸代谢(-Linolenic acid metabolism)、色氨酸代谢(Tryptophan metabolism)等方面存在显著差异。
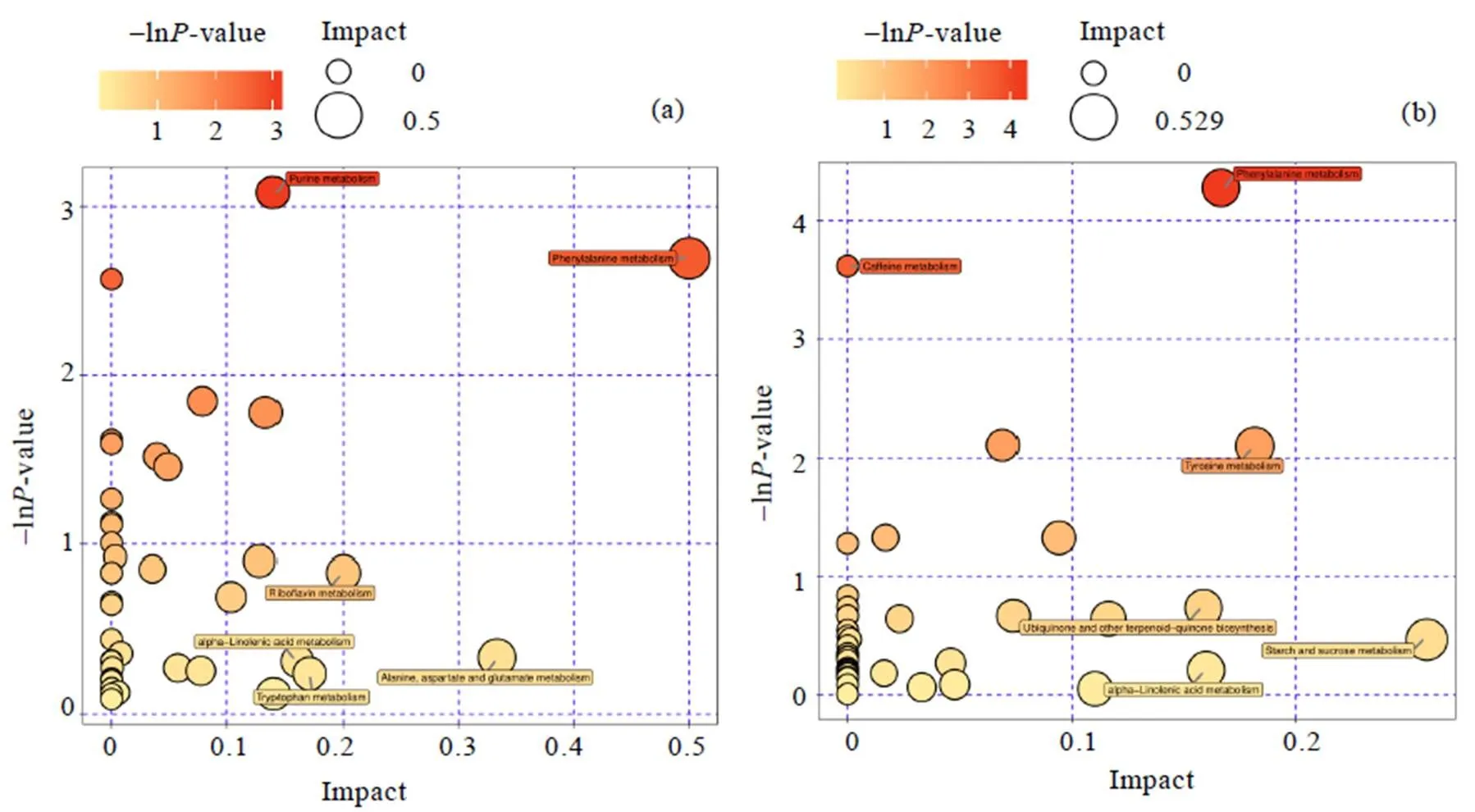
图5 在负离子模式(a)与正离子模式下(b),基于接种发酵组(IF组)对原料组(RM组)差异代谢物的代谢通路富集分析图
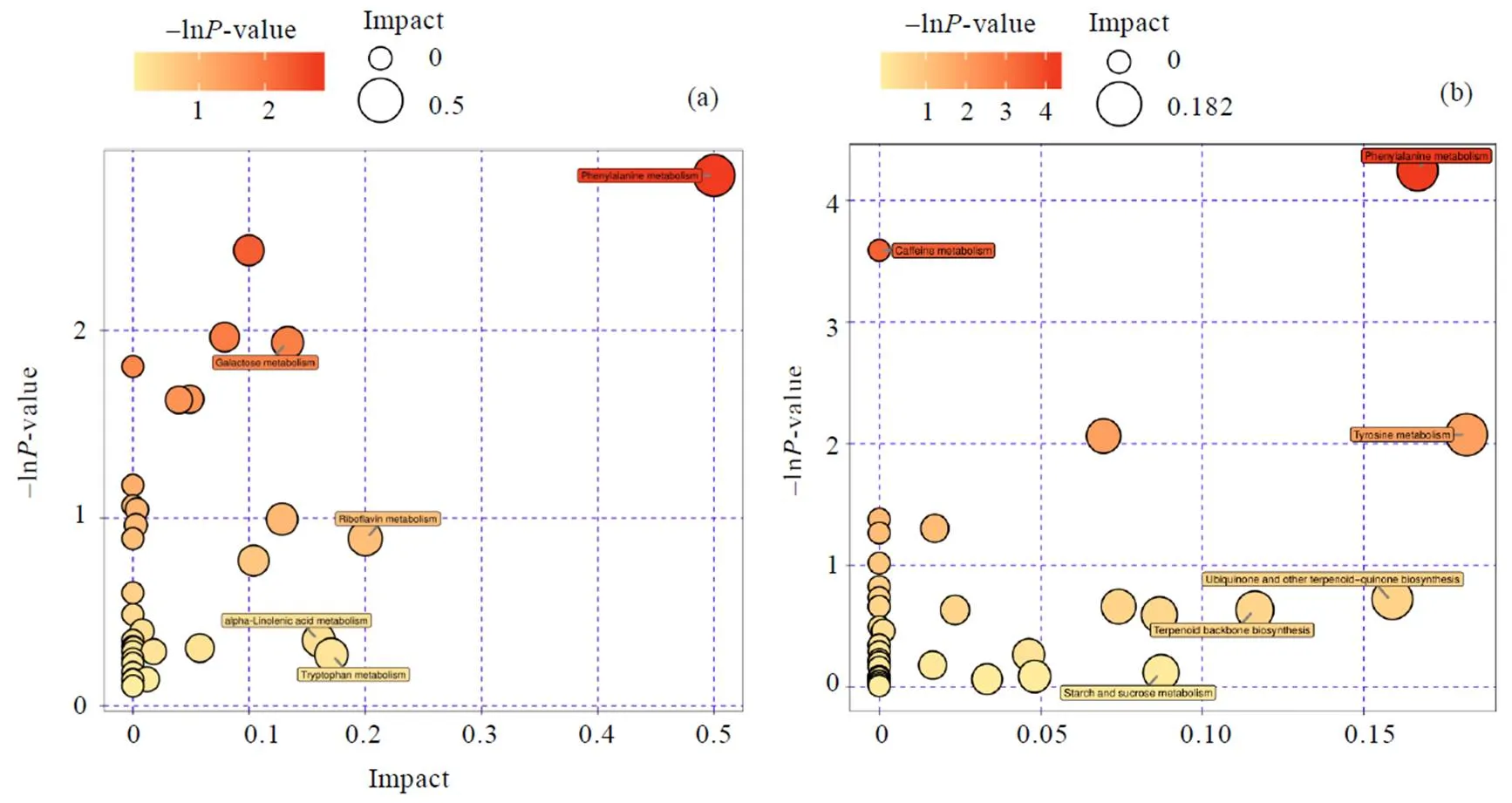
图6 在负离子模式(a)与正离子模式下(b),基于接种发酵组(IF组)对灭菌处理组(ST组)差异代谢物的代谢通路富集分析图
综合接种发酵组(IF组)与原料组(RM组)和灭菌处理组(ST组)在咖啡碱代谢(Caffeine metabolism)、嘌呤代谢(Purine metabolism)、苯丙烷代谢(Phenylalanine metabolism)、核黄素代谢(Riboflavin metabolism)、酪氨酸代谢(Tyrosine metabolism)、淀粉和蔗糖代谢(Starch and sucrose metabolism)等代谢通路富集上存在显著差异。因此,聚多曲霉对氨基酸、碳水化合物、黄酮类和咖啡碱代谢有显著影响(<0.05)。
2.4 聚多曲霉作用下咖啡碱降解代谢途径分析
本文采用UHPLC-QTOF-MS方法在接种发酵样、灭菌处理样、晒青毛茶原料样中共检测出咖啡碱、茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤、7-甲基黄嘌呤、1-甲基黄嘌呤、次黄嘌呤等7种嘌呤碱(表2)。相比于原料组(RM组)和灭菌处理组(ST组),在接种发酵组(IF组)中咖啡碱发生显著降低(<0.05),而茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤、7-甲基黄嘌呤均显著增加(<0.05),1-甲基黄嘌呤在接种发酵过程中略有增加。
在聚多曲霉接种发酵中,咖啡碱的主要降解途径如图7所示。聚多曲霉作用下,咖啡碱降解代谢存在N-脱甲基化途径和氧化途径。通过N-脱甲基化反应,咖啡碱降解为茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤、7-甲基黄嘌呤、1-甲基黄嘌呤。其中部分降解产物,氧化后产生的1,7-二甲基尿酸和1-甲基尿酸均有小幅度增加。次黄嘌呤的显著增加,可能和咖啡碱降解代谢相关。在聚多曲霉作用下,产生相关N-脱甲基酶,分别去除咖啡碱7号位甲基和3号位甲基生成茶碱和1,7-二甲基黄嘌呤,并且茶碱为主要咖啡碱降解产物,1,7-二甲基黄嘌呤为次要降解产物。
3 讨论
本文以灭菌处理为对照,采用NRRL250(聚多曲霉)、NRRL4789、CBS137324和CBS253.31等4株优势菌株分别接种至晒青毛茶进行茶叶固态发酵,并采用HPLC测定咖啡碱、可可碱和茶碱等嘌呤碱含量。结果表明,NRRL4789、CBS137324和CBS253.31对咖啡碱、可可碱、茶碱等嘌呤碱代谢无显著影响,这与普洱茶自然渥堆[25]和茶叶单菌种发酵[3]的研究结果基本一致。此外,本文仅在聚多曲霉接种发酵中发现咖啡碱含量显著下降(<0.05),茶碱含量显著增加(<0.05),这与前人研究结果一致[22]。另外,有研究报道茶碱是咖啡碱主要的代谢产物和限速步骤[26-27]。综上所述,在普洱茶发酵中咖啡碱降解的优势菌株为聚多曲霉,并具有将咖啡碱转化为茶碱的潜在能力。
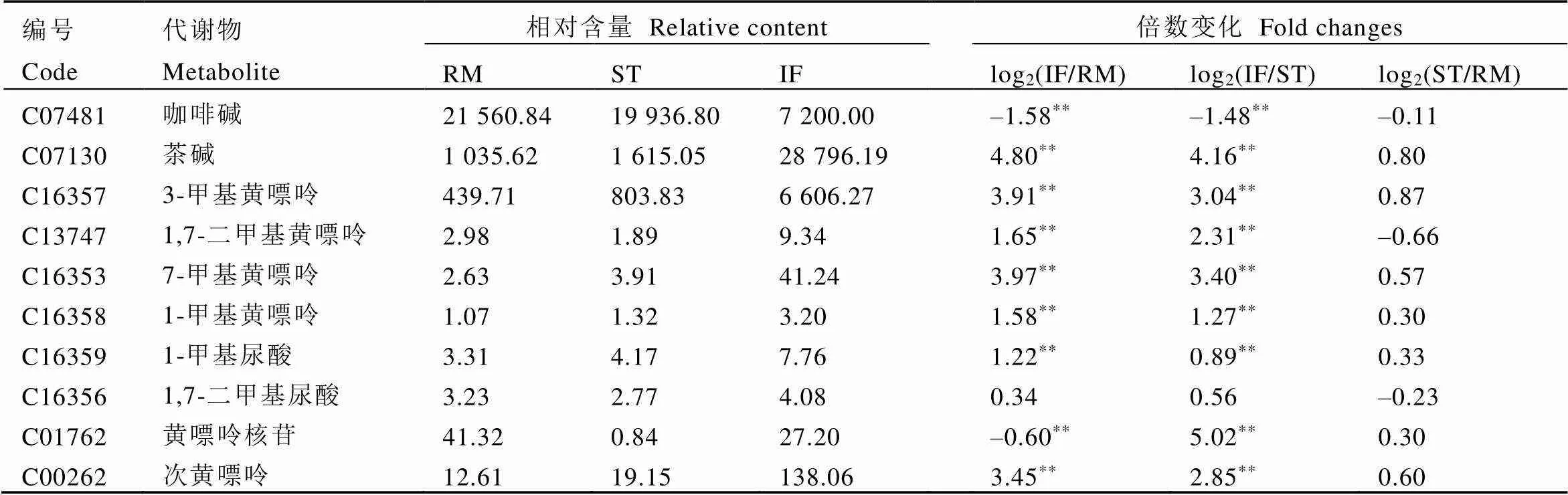
表2 不同处理组中咖啡碱代谢相关代谢物的相对含量和倍数变化
注:代谢物的相对含量为3个重复通过LC-MS/MS获得数据的平均值,相对含量是内标归一化后的值,其内标为核糖醇(≥99%)。RM为原料组,ST为灭菌处理组,IF为接种发酵组。倍数变化通过公式log2(处理/对照)进行计算。**表示同列差异显著性水平(<0.05)
Note: Relative content of each metabolite is an average of data from three replicates obtained through LC-MS/MS. The relative content is the normalized value of the internal standard, and the internal standard is ribose alcohol (≥99%). RM stands for Raw material, ST stands for Sterilization treatment, IF stands for Inoculated fermentation. Fold changes were calculated using the formula log2(treatment/control). ** indicates significance of the same column (<0.05)
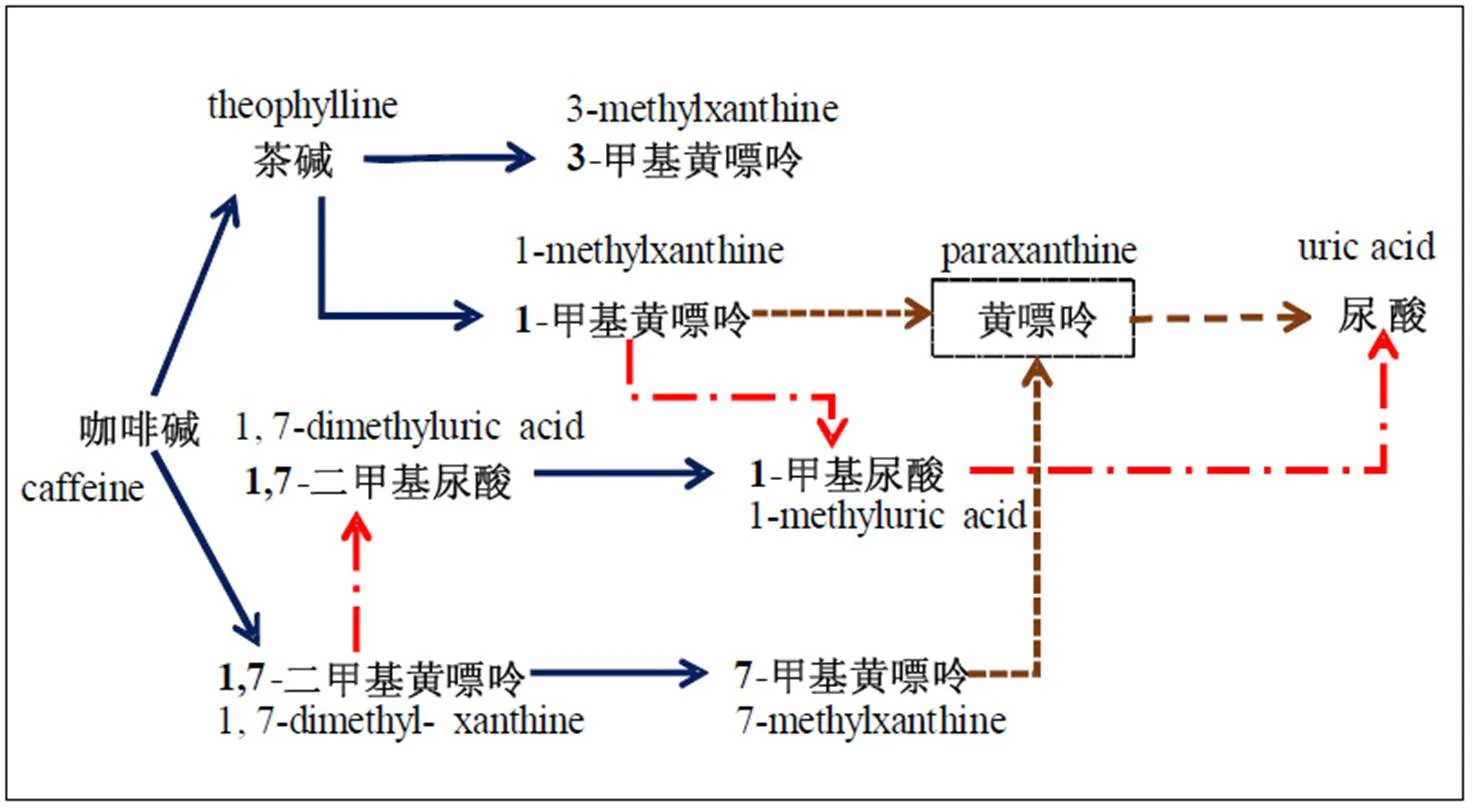
注:蓝色箭头(→)表示在SSF中检测到的N-脱甲基化通路。红色箭头(→)表示在SSF中检测到的氧化通路。棕色箭头(→)表示在SSF中未检测到的可能通路
运用UHPLC-QTOF-MS的代谢组学分析探究聚多曲霉作用下第9天发酵样中咖啡碱降解代谢相关的物质,发现茶碱、3-甲基黄嘌呤、1,7-二甲基黄嘌呤、7-甲基黄嘌呤、1-甲基黄嘌呤、1-甲基尿酸、次黄嘌呤均显著增加(<0.05)。其中,茶碱含量与HPLC检测结果一致。由此可见,茶碱作为N-脱甲基作用下咖啡碱降解的主要产物,进一步降解为3-甲基黄嘌呤或1-甲基黄嘌呤。而1,7-二甲基黄嘌呤作为-脱甲基作用下咖啡碱降解的次要产物,可通过-脱甲基作用进一步降解为7-甲基黄嘌呤或1-甲基黄嘌呤。
前人研究发现,茶树生理中咖啡碱的分解代谢途径以咖啡碱→茶碱→3-甲基黄嘌呤→黄嘌呤→尿酸→尿囊素→尿囊酸→乙醛酸→尿素→NH3+CO2为主[28-29]。在本研究中,在聚多曲霉作用下咖啡碱降解代谢中存在着-脱甲基作用和氧化作用,并以-脱甲基化作用为主,且以咖啡碱→茶碱→3-甲基黄嘌呤降解为主途径,这与Mccarthy等[30]的研究结果一致。另外,在极少数的青霉属和曲霉属类群中,真菌分解代谢咖啡碱会逐级代谢为茶碱和3-甲基黄嘌呤[31],并且以咖啡碱→1,7-二甲基黄嘌呤→7-甲基黄嘌呤降解途径为辅。1-甲基黄嘌呤的增加可能源于茶碱或1,7-二甲基黄嘌呤的进一步降解[32]。同时,通过氧化作用,少量1,7-二甲基黄嘌呤和1-甲基黄嘌呤可氧化成甲基尿酸,这与细菌参与下的嘌呤碱代谢途径一致。1,7-二甲基尿酸亦可脱甲基形成1-甲基尿酸,与Cornish等[32]在动物体内发现咖啡碱通过脱甲基后转化为1,7-二甲基黄嘌呤,进一步脱甲基后转化为1-甲基黄嘌呤,再氧化为1-甲基尿酸的代谢途径一致。-脱甲基作用是由相关的-脱甲基酶催化咖啡碱3个位点的甲基完成,最终生成黄嘌呤。目前关于茶叶中-脱甲基酶的研究报道较少。运用-脱甲基酶相关基因的超表达促使咖啡碱的降解,定向生产相应嘌呤碱存在不少难题。研究-脱甲基酶相关基因簇将促进生物降解嘌呤碱技术的研发,对解决相关领域应用咖啡碱产生的问题具有现实意义。
[1] Zhang L, Zhang Z Z, Zhou Y B, et al. Chinese dark teas: Postfermentation, chemistry and biological activities [J]. Food Research International, 2013, 53(2): 600-607.
[2] 全国原产地域产品标准化工作组. 地理标志产品普洱茶: GB/T 22111—2008 [S]. 北京: 北京标准出版社, 2008.National regional product standardization working group of the People's Republic of China. Geographical indication products Pu-erh tea: GB/T 22111—2008 [S]. Beijing: Beijing Standard Press, 2008.
[3] 陈华红, 李雪玲, 岩燕, 等. 顶头孢霉对普洱茶品质的影响[J]. 食品科技, 2011, 36(10): 53-56.Chen H H, Li X L, Yan Y, et al. The effects of a strain of Cephalosporium acremonium on the quality of Pu-er tea [J]. Food Science and Technology, 2011, 36(10): 53-56.
[4] Lv H P, Zhang Y J, Lin Z, et al. Processing and chemical constituents of Pu-erh tea: A review [J]. Food Research International, 2013, 53(2): 608-618.
[5] Zhang L, Li N, Ma Z Z, et al. Comparison of the chemical constituents of aged Pu-erh tea, ripened Pu-erh tea, and other teas using HPLC-DAD-ESI-MSn [J]. Journal of Agricultural and Food Chemistry, 2011, 59(16): 8754-8760.
[6] Wang D, Xu K L, Zhong Y, et al. Acute and subchronic oral toxicities of Pu-erh black tea extract in Sprague-Dawley rats [J]. Journal of ethnopharmacology, 2011, 134(1): 164. doi: 10.1016/j.jep.2010.11.068.
[7] Wang D, Xiao R, Hu X T, et al. Comparative safety evaluation of Chinese Pu-erh green tea extract and Pu-erh black tea extract in Wistar rats [J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 1350-1358.
[8] Hollingsworth R G, Armstrong J W, Campbell E. Caffeine as a repellent for slugs and snails [J]. Nature, 2002, 417(6892): 915-916.
[9] 栗娜, 籍保平, 李博, 等. 可降解咖啡碱菌株的筛选与鉴定[J]. 食品科学, 2010, 31(21): 218-221.Li N, Ji B P, Li B, et al. Screening and identification of astrain capable of degrading caffeine [J]. Food Science, 2010, 31(21): 218-221.
[10] Gokulakrishnan S, Chandraraj K, Gummadi S N. A preliminary study of caffeine degradation bysp. GSC 1182 [J]. International Journal of Food Microbiology, 2007, 113(3): 346-350.
[11] Zhou B X, Ma C Q, Wang H Z, et al. Biodegradation of caffeine by whole cells of tea-derived fungi,and optimization for caffeine degradation [J]. BMC Microbiology, 2018, 18(1): 53. doi: 10.1186/s12866-018-1194-8.
[12] Scharbert S, Hofmann T. Molecular definition of black tea taste by means of quantitative studies, taste reconstitution, and omission experiments [J]. J Agric Food Chem, 2005, 53(13): 5377-5384.
[13] He R, Chen L, Lin B, et al. Beneficial effects of oolong tea consumption on diet-induced overweight and obese subjects [J]. Chinese Journal of Integrative Medicine, 2009, 15(1): 34-41.
[14] 顾陈菲, 宝丽, 谢果, 等. 狭叶茶提取物对小鼠氧化应激性肝损伤的保护作用[J]. 茶叶科学, 2008, 28(2): 115-122.Gu C F, Bao L, Xie G, et al. Protective effects ofchang on oxidative stress-induced liver damage in mice [J]. Journal of Tea Science, 2008, 28(2): 115-122.
[15] Kurihara H, Fukami H, Asami S, et al. Effects of oolong tea on plasma antioxidative capacity in mice loaded with restraint stress assessed using the oxygen radical absorbance capacity (ORAC) assay [J]. Biological & Pharmaceutical Bulletin, 2004, 27(7): 1093-1098.
[16] Nawrot P, Jordan S, Eastwood J, et al. Effects of caffeine on human health [J]. Food Additives and Contaminants, 2003, 20(1): 1-30.
[17] 黄丽凤, 刘友平, 黎代余. 茶多酚提取纯化工艺研究进展[J]. 中国食品添加剂, 2010(1): 69-72.Huang L F, Liu Y P, Li D Y. Advances on research of purification of tea polyphenols from green tea leaves [J]. China Food Additives, 2010(1): 69-72.
[18] 姚永宏, 柴友荣, 李中林, 等. 降低茶叶咖啡碱的研究进展[J]. 西南农业学报. 2009, 22(6): 1799-1802.Yao Y H, Cai Y R, Li Z L, et al. Research progress for tea decaffeination [J]. Southwest China Journal of Agricultural Sciences, 2009, 22(6): 1799-1802.
[19] Iancu I, Strous R D. Caffeine intoxication: history, clinical features, diagnosis and treatment [J]. Harefuah, 2006, 145(2): 147-151, 163-164.
[20] Wang Q P, Gong J S, Chisti Y, et al. Fungal isolates from a Pu-erh type tea fermentation and their ability to convert tea polyphenols to theabrownins [J]. J Food Science, 2015, 80(4): M809-M817.
[21] 马存强, 王洪振, 周斌星, 等. 普洱茶固态发酵中转化咖啡碱为茶碱菌株的鉴定与应用[J]. 食品工业科技, 2018, 39(15): 119-124.Ma C Q, Wang H Z, Zhou B X, et al. Identification and application of fungal converting caffeine to theophylline from Pu-erh tea solid-state fermentation [J]. Science and Technology of Food Industry, 2018, 39(15): 119-124.
[22] 马存强, 周斌星, 王洪振, 等. 普洱茶渥堆发酵中可降解咖啡碱真菌菌株的筛选和鉴定[J]. 茶叶科学, 2017, 37(2): 211-219.Ma C Q, Zhou B X, Wang H Z, et al. Screen and identification of fungi strain degrading caffeine in Pu-erh tea during solid-state fermentation [J]. Jounal of Tea Science, 2017, 37(2): 211-219.
[23] Wang X G, Wan X C, Hu S X, et al. Study on the increase mechanism of the caffeine content during the fermentation of tea with microorganisms [J]. Food Chemistry, 2008, 107(3): 1086-1091.
[24] Ivanisevic J, Elias D, Deguchi H, et al. Arteriovenous blood metabolomics: a readout of intra-tissue metabostasis [J]. Sci Rep, 2015, 5(1): 12757.doi: 10.1038/srep12757.
[25] Liang Y R, Zhang L Y, Lu J L. A study on chemical estimation of Pu-erh tea quality [J]. Journal of the Science of Food and Agriculture, 2005, 85(3): 381-390.
[26] Ashihara H, Gillies F M, Crozier A. Metabolism of caffeine and related purine alkaloids in leaves of tea (L.) [J]. Plant and Cell Physiology, 1997, 38(4): 413-419.
[27] Woolfolk C A. Metabolism of N-methylpurines by a Pseudomonas putida strain isolated by enrichment on caffeine as the sole source of carbon and nitrogen [J]. Journal of bacteriology, 1975, 123(3): 1088-1106.
[28] Ashihara H, Sano H, Crozier A. Caffeine and related purine alkaloids: biosynthesis, catabolism, function and genetic engineering [J]. Phytochemistry, 2008, 69(4): 841-856.
[29] Mazzafera P. Catabolism of caffeine in plants and microorganisms [J]. Frontiers in Bioscience, 2004(9): 1348-1359.
[30] Mccarthy A A, Mccarthy J G. The structure of two N-methyltransferases from the caffeine biosynthetic pathway [J]. Plant Physiol, 2007, 144(2): 879-889.
[31] Hakil M, Denis S, Viniegra-González G, et al. Degradation and product analysis of caffeine and related dimethylxanthines by filamentous fungi [J]. Enzyme and Microbial Technology, 1998, 22(5): 355-359.
[32] Cornish H H, Christman A A. A study of the metabolism of theobromine, theophylline, and caffeine in man [J]. J Biol Chem, 1957, 228(1): 315-323.
A Preliminary Study on the Degradation Pathway of Caffeine in Tea Microbial Solid-state Fermentation
ZHENG Chengqin1, MA Cunqiang1,2, ZHANG Zhengyan1, LI Xiaohong1, WU Tingting1,ZHOU Binxing1*
1. Longrun Pu-erh Tea College, Yunnan Agricultural University, Kunming 650201, China; 2. Kunming Dapu Tea Industry Company Limited, Kunming 650224, China
In order to explore caffeine degradation products and pathways under the action of microorganisms, the dominant strains includingNRRL250,NRRL4789,CBS137324 andCBS253.31 were screened and identified during pu-erh tea fermentation.Strains were inoculated into sun-dried green tea leaves for solid-state fermentation. High performance liquid chromatography (HPLC) was used to determine caffeine, theobromine and theophylline contents to explore the effect of microorganisms on caffeine metabolism. UHPLC-QTOF-MS was used for the metabonomic analysis ofinoculated fermentation with sterilization treatment group (ST group) and raw material group (RM group). The results show that the dominant strains such asNRRL4789,CBS137324 andCBS253.31 had no significant effects on the metabolism of caffeine and other purine alkaloids. However, caffeine content was decreased significantly (<0.05) with a great reduction about 83.89% during the inoculated fermentation of. Additionally, theophylline content was increased significantly (<0.05) and arrived to (25.03±1.17) mg·g-1at the end of fermentation.While theobromine content remained stable. Therefore,has a profound effect on caffeine degradation metabolism. Nine metabolites related to caffeine degradation were detected by UHPLC-QTOF-MS during the inoculated fermentation, Among them, theophylline, 3-methylxanthine, 1,7-dimethylxanthine and 7-methylxanthine contents were significantly increased (<0.05) under the action ofwhich were related to N-demethylation pathway of caffeine and its related metabolites. 1,7-dimethyluric acid and 1-methyluric acid were related to the oxidation pathway of caffeine-related metabolites. It can be seen thatis the dominant strain that can degrade caffeine and has the potential ability to convert caffeine into theophylline. Under the action of, both N-demethylation and oxidation were found in caffeine degradation metabolism, and the former was the dominant.
Pu-erh tea, solid-state fermentation,, caffeine, degradation pathway
SI词头符号表
因数词头中文名称词头符号因数词头中文名称词头符号 1024尧Y10-1分d 1021泽Z10-2厘c 1018艾E10-3毫m 1015拍P10-6微µ 1012太T10-9纳n 109吉G10-12皮p 106兆M10-15飞f 103千K10-18阿a 102百H10-21仄z 101十da10-24幺y
S571.1;Q52
A
1000-369X(2020)03-386-11
2019-11-26
2019-12-23
云南农业云南省现代茶叶产业体系(2017KJTX007)、国家自然科学基金项目(31960617)、国家自然科学基金项目(31760225)、国家自然科学基金项目(31560221)
郑城钦,男,硕士,主要从事制茶工程与质量控制方面的研究。*通信作者:bxzhou01@126.com
投稿平台:http://cykk.cbpt.cnki.net

