血清LAMB1在结直肠癌患者中的表达及其临床意义
李 合,田由京,张 浩,陈兴超
海南医学院第一附属医院普通外科,海南 海口 570102
目前,结直肠癌是全球第三高发病率的肿瘤性疾病,与其他实体肿瘤相似,结直肠癌的死亡率往往是由转移引起的[1-2]。目前临床上用于监测结直肠癌复发转移的唯一生物标志物是血清癌胚抗原(CEA)。层粘连蛋白同样可参与包括增殖、黏附、迁移、侵袭和血管生成等,这些过程通过整合素信号介导[3-5]。在这些糖蛋白中,层粘连蛋白-1(LAMB1)被观察到在E1细胞中过度分泌,而之前并未发现其在结直肠癌细胞中分泌[6-7]。本研究通过收集参与者的血液,分析LAMB1在结直肠癌中的浓度及与相关病理分型的关系,并通过ROC曲线判断其对结直肠癌的诊断作用。现将结果报道如下。
1 资料与方法
1.1 研究对象收集在我院普通外科住院并由结肠镜活检病理学诊断为结直肠癌患者80例作为结直肠癌组,男42例,女38例,年龄(54.84±5.7)岁(40~75岁)。纳入标准:(1)符合结直肠癌临床症状、影像学及病理学诊断标准;(2)入组前未接受任何治疗,包括放疗、化疗、靶向药物及手术治疗的患者;(3)自愿签署知情同意书。排除标准:(1)未能按照预期完成研究的患者;(2)既往已确诊结直肠癌,并接受抗癌治疗或复发的患者;(3)存在肝肾功能损伤、心脏及其他脏器功能异常的患者;(4)合并其他系统肿瘤者。
对照组为符合纳入及排除标准的未患结直肠癌的同期住院患者80例,男39例,女41例,年龄(55.12±3.2)岁(45~70岁)。纳入标准:(1)未患任何癌症的患者;(2)无结直肠癌的家族史;(3)近3个月内影像学及结肠镜检查明确无结直肠癌;(4)自愿签署知情同意书。排除标准:(1)既往患有其他系统肿瘤疾病;(2)存在肝肾功能损伤、心脏及其他脏器功能异常;(3)妊娠期女性。本研究经过我院评审委员会的批准。
1.2 方法
1.2.1 标本采集及处理:所有入组者在空腹情况下(8 h未进食任何食物和水)采集外周静脉血5 ml,于低温离心机,1 500 r/min离心10 min,使用1 ml加样枪缓慢将上层血清吸入1.5 ml EP管中并分装,保存于-80 ℃冰箱中待检测。
1.2.2 血清中LAMB1和CEA浓度的检测:使用USCN Life Sciences(SEA184Hu)提供的ELISA试剂盒测定血清样本中LAMB1和CEA的浓度。ELISA过程中所有洗版步骤均采用ELx50微板带式洗版机(BioTek,Winooski)进行。使用酶标仪(Thermo Fisher)对样本OD450 nm的吸光度进行检测。所有的ELISA数据采用OriginPro 8.6(OriginLabs)统计软件进行分析。ELISA具体操作步骤:(1)加样:取出孵育相应抗体的ELISA试剂盒,将稀释好的样品加入酶标反应孔中,每样品至少加3孔,每孔100 μl,置于37 ℃,40~60 min;(2)洗涤:用洗涤液满孔洗涤3遍,每遍3 min;(3)加入酶标抗体:根据酶结合物提供商提供的参考工作稀释度进行稀释,37 ℃孵育30~60 min;(4)洗涤:用洗涤液满孔洗涤3遍,每遍3 min;(5)终止反应:每孔加入终止液50 μl终止反应,于20 min内测定实验结果;(6)检测结果:用酶标仪对样本OD450 nm的吸光度进行检测。
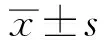
2 结果
2.1 两组患者血清中LAMB1与CEA的比较结直肠癌组患者血清中的LAMB1含量明显高于对照组(t=29.712,P=0.000),结直肠癌组患者血清中的CEA含量明显高于对照组(t=23.125,P=0.001)(见表1)。
2.2 结直肠癌患者血清中LAMB1、CEA与临床特征的关系结直肠癌患者血清中的LAMB1含量和CEA与性别、年龄、肿瘤直径及肿瘤部位无相关性(P>0.05);但与肿瘤浸润深度及TNM分期呈正相关(P<0.05),与结直肠癌分化程度呈负相关(P<0.05)(见表2)。

表1 两组患者血清中LAMB1和CEA的比较 Tab 1 Comparison of serum LAMB1 and CEA between two groups
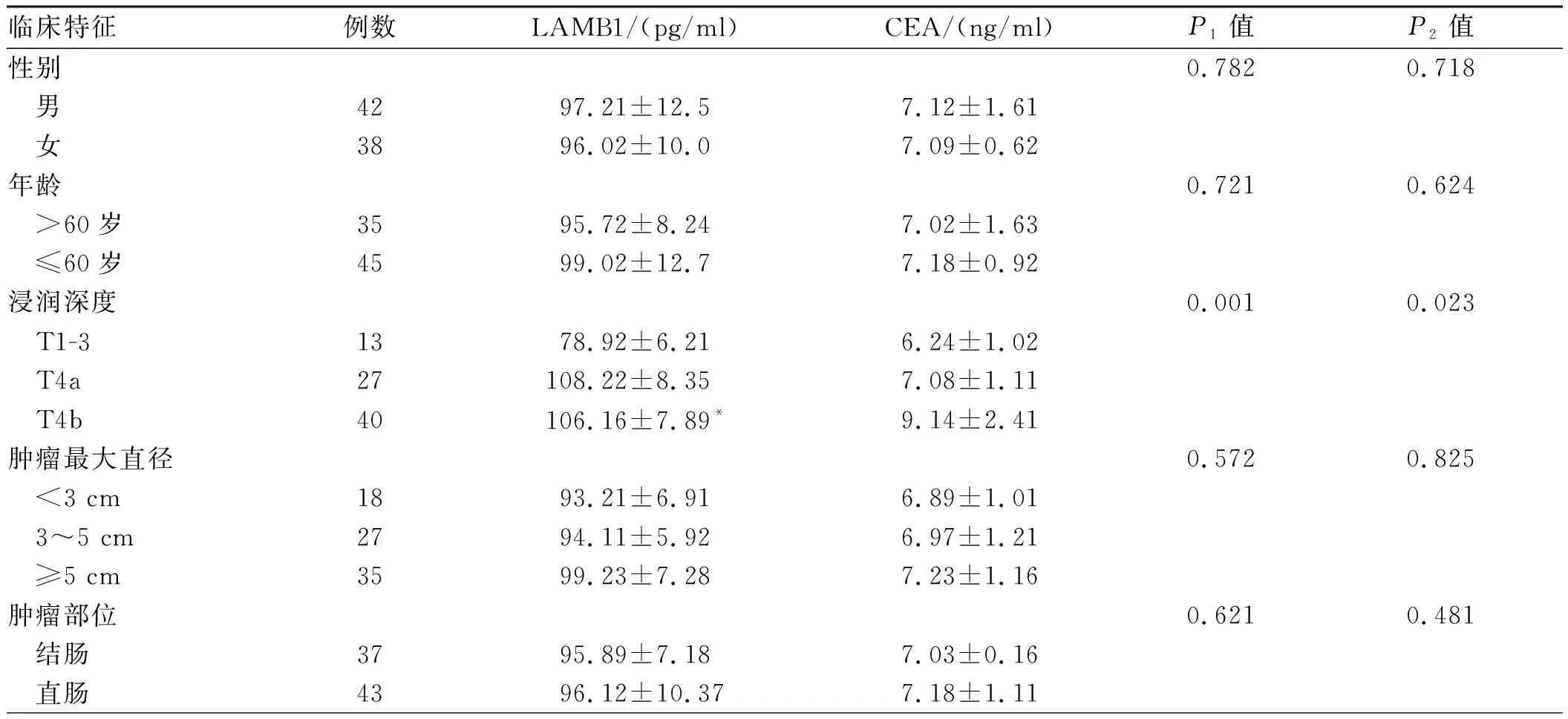
表2 结直肠癌患者血清中的LAMB1、CEA与临床特征的关系Tab 2 Relationship of levels of serum LAMB1 and CEA in colorectal cancer patients with clinical characteristics
续表2
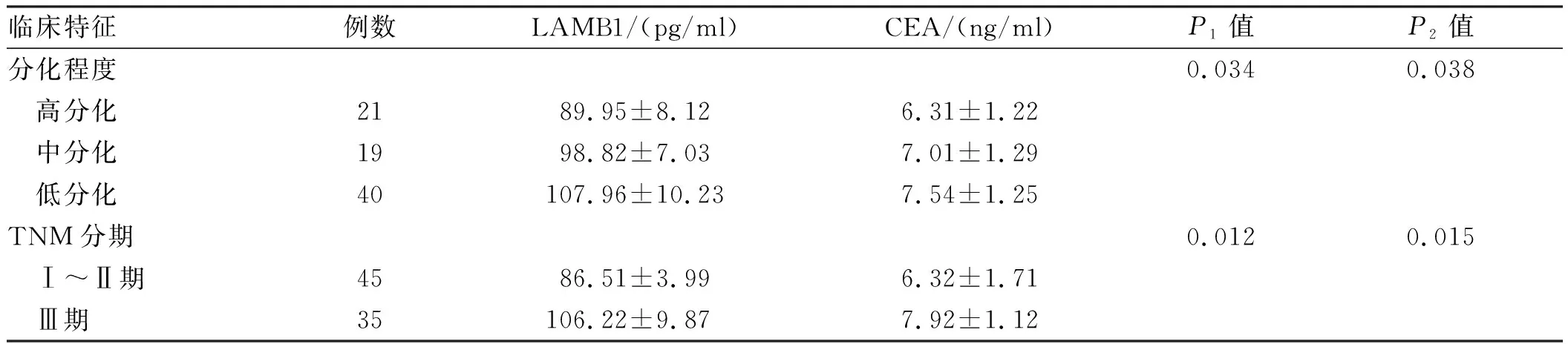
临床特征例数LAMB1/(pg/ml)CEA/(ng/ml)P1值P2值分化程度0.0340.038 高分化2189.95±8.126.31±1.22 中分化1998.82±7.037.01±1.29 低分化40107.96±10.237.54±1.25TNM分期0.0120.015 Ⅰ~Ⅱ期4586.51±3.996.32±1.71 Ⅲ期35106.22±9.877.92±1.12
注:P1值为LAMB1含量与病理分型关系的比较;P2值为CEA含量与病理分型关系的比较。
2.3ROC曲线评估及分析评估LAMB1、CEA对结直肠癌的诊断效果,在区分结直肠癌组与对照组时,LAMB1对结直肠癌诊断时的ROC曲线下面积(AUC)为0.887,临界值为89.02 pg/ml,CEA对结直肠癌诊断时的AUC为0.842,临界值为5.02 ng/ml,LAMB1与CEA同时对结直肠癌诊断时的AUC为0.901,表明LAMB1对结直肠癌的诊断具有一定效果,尤其与CEA联合检测时准确率更高(见图1)。
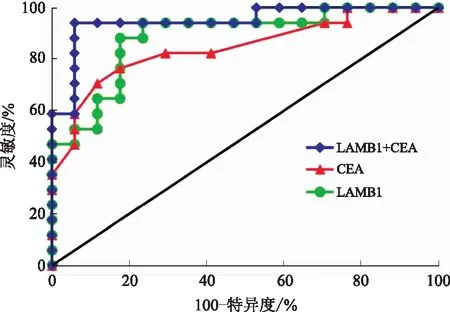
图1 单独或联合检测血清中LAMB1与CEA水平的ROC曲线Fig 1 ROC curve of levels of serum LAMB1 and CEA detected alone or combination
3 讨论
结直肠癌Ⅳ期患者的5年生存率为8.1%,较Ⅲc期患者的44.3%大幅下降。结直肠癌患者最常见的远处转移形式是肝转移[8]。在诊断时,约1/4的患者会出现肝转移(同步转移),另有25%~30%的患者随后会在肝脏中发展为继发性肿瘤。即使患者接受手术切除,约有1/2的患者会复发,超过60%的患者与肝相关[9-11]。
层粘连蛋白(LAMB)是组成基底膜最丰富的非胶原糖蛋白。已鉴定出超过14种层粘连蛋白亚型,每一种均具有不同的组织分布和功能[11]。目前,人们对肿瘤中分泌蛋白的富集也越来越感兴趣,以增强对低丰度肿瘤特异性生物标志物的检测。在各种用于富集分泌蛋白的策略中,糖蛋白富集是最常用的方法之一。在各种富集技术中,多凝集素亲和层析法(MLAC)是最有效、最灵活、最经济的糖蛋白捕获方法之一。LAMB1的YIGSR肽被证明与67 kDa层粘连蛋白受体(LamR)结合,这种相互作用被发现促进细胞黏附[12]。后续研究进一步表明,LamR还可能参与增殖、血管生成、迁移和侵袭。此外,LamR的过表达已被证明与结直肠癌的进展和转移有关[13]。因此,过度分泌LAMB1及其受体LamR的过度表达可能在结直肠癌转移过程中发挥重要作用。另一方面,LAMB1的机制也可以通过其所附的碳水化合物分子来介导。由于糖基化模式的改变是癌症进展的一个常见特征,碳水化合物分子的增加或修饰可能导致LAMB1的相应增加。我们的发现与文献中的几篇报道相似,在文献中发现LAMB1在肝细胞癌组织中表达增加[14-15],并与角蛋白-19共同表达,与肝细胞癌预后不良相关。因此,由于目前尚无任何结直肠癌临床样本中LAMB1的研究,我们决定进一步验证结直肠癌患者血清样本中LAMB1的水平。
结直肠癌手术切除后常规监测CEA水平,因为高CEA水平已被证明与患者预后较差相关[16]。然而,CEA的升高也可能发生在炎症条件下,如肝炎和炎症性肠病。此外,文献中关于CEA对结直肠癌预后的作用存在相互矛盾的数据[17-18]。因此,迫切需要具有更高灵敏度和特异度的新型生物标志物来改善患者预后。本研究中我们通过收集结直肠癌患者及未患结直肠癌疾病对照的血清样本,并采用ELISA法分别检测LAMB1和CEA的含量,结果显示,结直肠癌组患者血清中的LAMB1和CEA含量明显高于未患结直肠癌的对照组,结果表明,结直肠癌组患者血清中的LAMB1含量变化可能与CEA一样作为结直肠癌诊断的新型生物标志物。同样,有学者研究显示,LAMB1基因在耐化学反应的结直肠癌中上调[19],并与溃疡性结肠炎相关,而溃疡性结肠炎已知会增加结直肠癌的风险。此外,据报道,在结直肠癌患者中发现了LAMB1错义/无义突变,在不同的研究中观察到的频率为1%~4.5%。目前,只有Lin等[20]对结直肠癌患者血清LAMB水平进行了研究,但他们研究中使用的抗层粘连蛋白酶免疫检测试剂盒似乎针对的是LAMB1链。我们需要进一步研究结直肠癌患者血清中的LAMB1浓度与患者的临床病理分型及预后的关系,在本研究中结果显示,结直肠癌患者血清中的LAMB1和CEA与性别、年龄、肿瘤直径及肿瘤部位无相关性,但与肿瘤浸润深度及TNM分期均呈正相关,与结直肠癌分化程度呈负相关。
此外,我们观察到LAMB1比CEA具有更好的诊断性能。单分析LAMB1、单分析CEA及同时分析LAMB1与CEA对结直肠癌诊断时的AUC分别为0.887、0.842及0.901,ROC分析表明,LAMB1在区分结直肠癌患者和对照者方面优于CEA。此外,LAMB1联合CEA可进一步提高诊断性能。与CEA联合应用时,可将结直肠癌患者与未患结直肠癌对照者区分开。这表明LAMB1可能作为一种血清学生物标志物用于结直肠癌的诊断。
综上所述,LAMB1在结直肠癌患者血清中的表达情况可反映患者病理分型,并且对于结直肠癌的诊断具有较高的准确率。虽然我们的研究结果表明分泌的LAMB1可能参与结直肠癌转移,但其确切机制尚不清楚。

