葛根及其配伍对重症肌无力大鼠骨骼肌线粒体结构的影响
李蒙 文颖娟 杨俊超 王江 柏鲁宁

〔摘要〕 目的 探讨葛根及其配伍对重症肌无力大鼠骨骼肌线粒体结构的作用机制。方法 (1)造模:给模型大鼠以腹部、足垫、背部皮下注射200 μL(含R 97-116∶100 μg)免疫乳剂进行造模,30 d和45 d后,分别以同样方法对造模大鼠强化接种,以大鼠Lennon肌力评分≥1级为模型鼠。(2)分组与处理:除空白组外,造模成功鼠随机分为模型组、强的松组、葛根组、葛芪组、葛参组、葛妙组、葛芪参妙组,每组20只。造模成功2周后,给予空白组、模型组蒸馏水灌胃,其他组予相应药物灌胃,连续4周。(3)标本检测:透射电镜观察骨骼肌线粒体超微结构;免疫组化法检测FGF、NGF、IGFs表达。结果 与模型组比较,各组的线粒体形态均有恢复,其中葛芪组和葛芪参妙组治疗后整体形态恢复较好;与模型组比较,各治疗组FGF、NGF、IGFs的阳性表达率都有所升高,差异有统计学意义(P<0.01)。结论 葛根及其配伍可能通过改善肌肉生成调控因子的阳性表达促进线粒体结构的恢复,达到治疗重症肌无力的目的。
〔关键词〕 重症肌无力;葛根配伍;骨骼肌线粒体超微结构;肌肉生成调控因子
〔Abstract〕 Objective To explore the action mechanism of Radix Puerariae and its compatibility on the mitochondrial structure of skeletal muscle in myasthenia gravis rats. Methods (1)modeling: The model rats were established by injecting 200 μL (including r 97-116∶100 μg) immune emulsion into abdomen, foot pad and back subcutaneously. After 30 days and 45 days, the rats were inoculated with the same method, and Lennon score ≥ 1 was used as the model rats. (2)Grouping and treatment: In addition to the blank group, the successfully modeling rats were randomly divided into a model group, a prednisone group, a Radix Puerariae group, a Geqi group, a Geshen group, a Gemiao group and a Geqishenmiao group, with 20 rats in each group. After 2 weeks of successful modeling, the blank group and model group were given distilled water by gavage, and the other groups were given drugs by gavage for 4 weeks. (3)Sample detection: The mitochondrial ultrastructure of skeletal muscle was observed by transmission electron microscope. The expression of FGF, NGF and IGFs was detected by immunohistochemistry. Results Compared with the model group, the mitochondrial morphology of each group recovered, and the whole morphology of the Geqi group and the Geqishenmiao group recovered better after treatment; Compared with the model group, the positive expression rates of FGF, NGF and IGFs in each treatment group increased, and the difference was statistically significant (P<0.01). Conclusion Radix Puerariae and its compatibility may promote the recovery of mitochondrial structure by improving the positive expression of myogenic regulatory factors, so as to achieve the purpose of treating myasthenia gravis.
〔Keywords〕 myasthenia gravis; compatibility of Radix Puerariae; ultrastructure of skeletal muscle mitochondria; regulation factors of muscle formation
重癥肌无力(myasthenia gravis,MG)是一种难治性自身免疫性疾病,以眼肌或全身肌无力为主要表现[1],到目前为止,其病理机制尚不十分清楚,病因以乙酰胆碱受体(acetylcholine receptor, AchR)受损为主,即神经肌肉接头处突触后膜中因AchR分子数量减少无法产生足够的终板电位而导致肌肉传递功能障碍[2],最终产生肌无力的症状。中医学认为MG病机要点为脾气虚弱无以运化水谷精微,使筋脉失养以致“脾无以主肌肉”而发病,且脾气虚弱日久见湿热、瘀血、痰浊等浊邪堆积。本项目前期研究[3]从“脾气虚弱兼浊邪堆积”的角度为切入点,认为本病多以虚实夹杂证为主,已证实葛根及其配伍不仅能改善肌无力症状[4-7],且能作用于胃肠平滑肌线粒体[8],具有较高的临床应用价值。本研究通过配制分别含有100 μg肽段的完全弗氏佐剂、不完全弗氏佐剂和磷酸盐缓冲液(PBS)的混合乳液诱导自身免疫性重症肌无力大鼠模型,观察葛根及其配伍对线粒体超微结构与肌肉生成调控因子[9]包括成纤维细胞生长因子(fibroblast growth factor,FGF)、神经生长因子(nerve growth factor,NGF)和胰岛素样生长因子(insulin-like growth factors, IGFs)的影响,旨在从促进肌肉生长调控因子的角度探讨复方配伍对抗肌无力的内在机制及主要起效配伍,进一步研究葛根及其配伍对MG的作用机制。
1 材料
1.1 实验动物
6~8周龄SPF级Lewis雌性大鼠160只,体质量(180±20) g,许可证号:SCXK(陕)2013-001,购于西安交通大学实验动物中心。于陕西中医药大学实验中心适应性饲养一周后进行实验。
1.2 实验药物
(1)葛根组:葛根20 g;(2)葛芪方组:葛根20 g,黄芪15 g;(3)葛参方组:葛根20 g,黄芪15 g,丹参15 g;(4)葛根和四妙散方组(简称葛妙组):葛根20 g,苍术15 g,黄柏15 g,牛膝15 g,薏苡仁15 g;(5)葛芪参妙方组(简称葛芪参妙组):葛根20 g,黄芪15 g,丹参15 g,苍术15 g,黄柏15 g,牛膝15 g,薏苡仁15 g。中药饮片来源于陕西中医药大学校医院,阳性对照组药物:强的松(天律药业集团新郑股份有限公司)。实验药物均置于4 ℃冰箱保存备用。
1.3 试剂与仪器
鼠源性AchR-α亚基97-116肽段序列由南京金斯瑞生物科技公司提供;2.5%磷酸盐缓冲液、完全福氏佐剂CFA、不完全福氏佐剂IFA(Sigma公司);兔抗FGF一抗(货号:ab15080)、兔抗NGF一抗(货号:ab125219)、兔抗IGFs一抗(货号:ab13065)、正常山羊血清(货号:ZLI-9021)均为北京中山金桥生物有限公司提供;FGF、NGF、IGFs免疫组化检测试剂盒均由上海茁彩生物科技公司提供。H-500IV透射电镜(日本日立公司),FinesseE切片机(上海华骏医疗器材有限公司),ELX550型酶标仪(Bio-Rad公司)。
2 方法
2.1 分组方法
将实验大鼠分为空白组、模型组、强的松组、葛根组、葛芪组、葛参组、葛妙组、葛芪参妙组,每组20只。
2.2 造模方法
将R97~116、CFA、PBS三者按1∶1.5∶1.5的比例充分混匀制成免疫乳剂;取140只大鼠予以腹部、足垫、背部皮下注射200 μL(含R97~116∶100 μg)乳剂进行造模,取20只大鼠为空白組皮下注射相同剂量PBS,完成首次免疫;首次免疫后30 d和45 d,将R97~116、IFA、PBS三者按1∶3∶3的比例充分混匀制成免疫乳剂,取乳剂200 μL(含R97~116:50 μg)对造模大鼠强化接种,空白组同样注射相同剂量PBS。通过测量体质量和Lennon肌力评定[10]来评估造模是否成功,并对大鼠进行Lennon肌力评定,以进一步确定MG大鼠模型制备成功。
2.3 成模评估方法
(1)实验期间每周测1次大鼠体质量并记录,以造模后大鼠体质量增加缓慢为评价标准;(2)Lennon肌力评定标准分级方法按症状严重程度分为四级:0级,无明显的无力表现;1级,四肢力量差,光滑地面上前肢打滑,活动减少且易疲劳;2级,明显无力,休息时身体呈隆起姿势,头尾下垂,大腿外展,前肢趾弯曲,动作笨拙,行走不稳;3级,严重无力表现,无撕咬动作,肌肉震颤,呼吸困难,濒死或死亡。以活动减少,动作缓慢,抓持时挣扎力量减弱,叫声短促低沉,毛发暗淡,体质量开始增长缓慢或者下降趋势,以及Lennon肌力评分≥1级为成模标准。
2.4 干预方法
空白组、模型组给予蒸馏水灌胃,葛根及其配伍组予中药浓缩液分别给药。按大鼠每日用药剂量相当于成人(以60 kg为标准)的6.25倍给药[11],大鼠用药量=(成人每日用药量/60 kg)×6.25。葛根组2.08 g/(kg·d),葛芪组3.65 g/(kg·d),葛参组3.65 g/(kg·d),葛妙组8.33 g/(kg·d),葛芪参妙组11.46 g/(kg·d),强的松组予强的松混悬液5.4 mg/(kg·d)给药。每日灌胃1次,连续灌4周。
2.5 检测指标
2.5.1 线粒体超微结构 处死并分离大鼠坐骨神经,沿其坐骨神经走向找到进入胫骨前肌的分支,取神经进入肌肉部位(连同神经)切割修成2 mm×2 mm×2 mm大小,浸于2.5% PBS固定2 h (4 ℃)后,再浸于1%四氧化锇液固定1 h,进行脱水、渗透、包埋,切片、染色等处理后,于透射电镜下放大20 000倍和40 000倍观察骨骼肌线粒体超微结构。
2.5.2 FGF、NGF、IGFs检测 采用免疫组化检测FGF、NGF、IGFs表达:用磷酸盐缓冲液PBS溶液冲洗脱蜡、入水处理后的石蜡切片,用枸橼酸盐缓冲液进行抗原修复,滴加山羊血清封闭液,室温下30 min。滴加FGF、NGF、IGFs一抗,4 ℃过夜。PBS冲洗3次,加入二抗,孵育20 min。PBS溶液冲洗3次,DAB染色,苏木精复染,中性树胶封片,光学显微镜观察,ImagePro图像分析系统进行分析,计算积分光密度(IOD)值。
2.6 统计学处理
实验数据用SPSS 19.0统计软件进行处理,按照“x±s”来表示,对于符合正态分布数据比较采用t检验和方差分析法,非正态分布数据采用秩和检验。其中P<0.05为差异有统计学意义。
3 结果
3.1 大鼠体质量变化情况
免疫后,造模大鼠在4周后体质量增加减慢,尤其在第4周加强免疫后,与空白组比较,造模各组的大鼠体质量的增加量明显减缓;治疗后,中药各组和强的松组比较,葛芪参妙组的大鼠的体质量增长值逐渐超过强的松组(P<0.05),其他中药组虽然体质量增长趋势也在增加,但和强的松组区别不明显。见表1。
3.2 Lennon肌力评定结果
按照Lennon肌力评价方法给予评分,造模各组老鼠与空白组比较,肌无力症状明显,差异有统计学意义(P<0.01);治疗一月后,與模形组比较,中药各组和阳性对照强的松组的肌无力症状明显改善,差有统计学意义(P<0.05);与强的松组比较,葛芪参妙组的肌力恢复更加明显(P<0.05),其他中药各组肌力恢复不及强的松组,差异不明显。见表2。
3.3 电镜下骨骼肌线粒体超显微结构
电镜下空白组的超微结构正常;模型组中,骨骼肌肌肉间隙相对增宽,细胞核与核膜保存尚可,内质网和线粒体中Z线出现扭曲或消失,大鼠肌原纤维内线粒体数量明显增多,其大小不一,部分体积增大,有巨大线粒体,线粒体形态明显改变为多形性。治疗后强的松组和各个中药组的都有恢复,巨大线粒体减少,异性线粒体变少,线粒体嵴致密度相对较为均匀,结构较为清晰,排列规律性恢复较好,葛芪组和葛芪参妙组经过治疗后整体形态恢复较好。见图1。
3.4 肌肉生成调控因子检测
3.4.1 FGF FGF在组织中阳性表达率以细胞间质中棕黄色颗粒的颜色和区域大小表示,表达越多,反应的颜色越深,区域越大。图中可见空白组中FGF阳性表达区域较为广泛,模型组中因子的颜色表达区域减少,并且肌细胞出现萎缩和衰亡,细胞间隙较为分散;药物治疗后该因子区域颜色出现加深,表达率升高,疗效显著。见图2。
模型组和空白组比较,阳性表达IOD值降低(P<0.01);治疗组和模型组比较,阳性表达率均升高(P<0.01);各中药组和强的松组比较,阳性表达都比较高(P<0.05);葛根及其配伍组组间比较:葛芪参妙组>葛妙组、葛参组、葛芪组>葛根组,(P<0.05)。见表3。
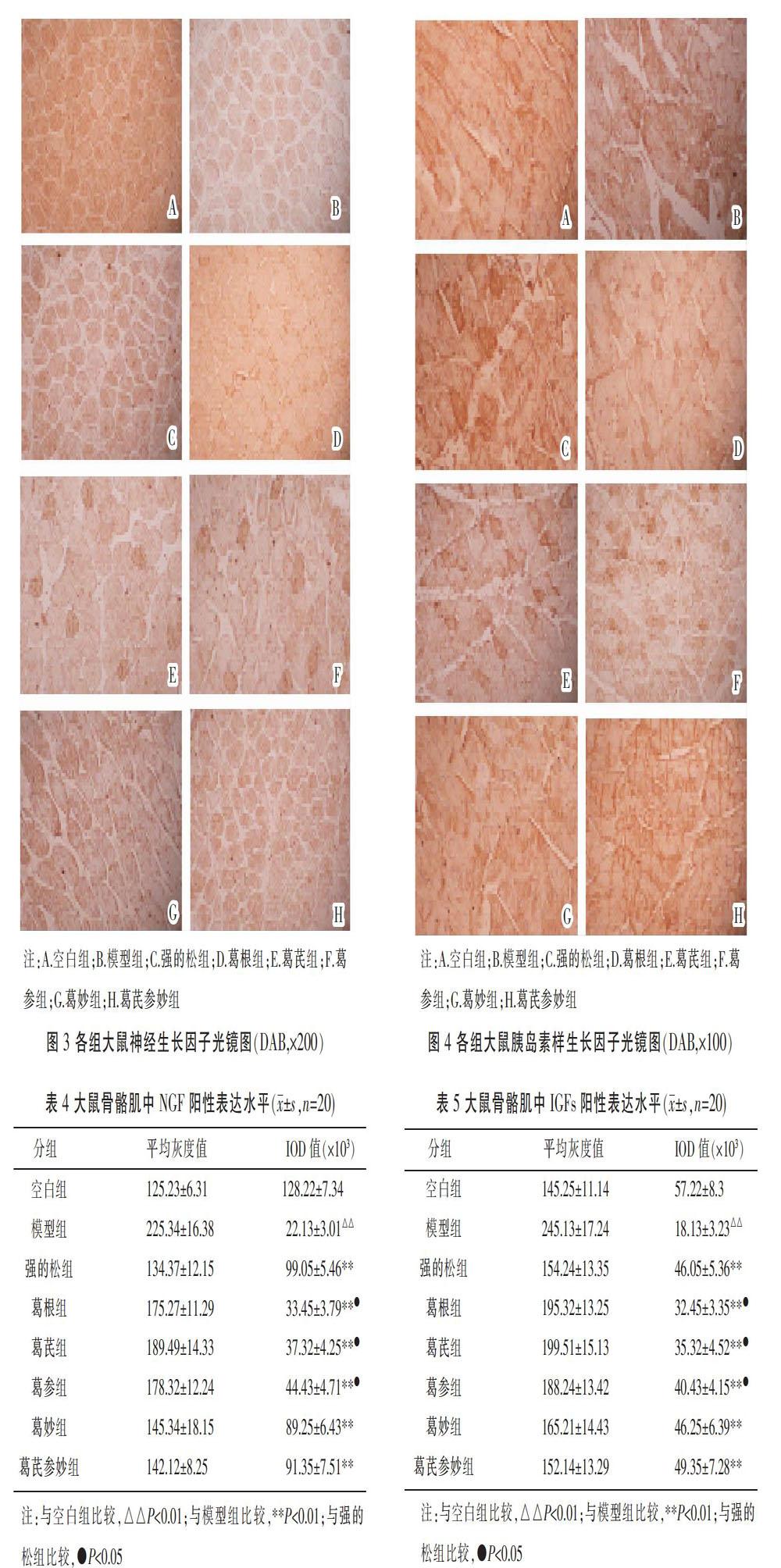
3.4.2 NGF 空白组可见NGF广泛表达于神经细胞周围;模型组肌肉及神经纤维束可见比较松散,且阳性表达显示点颜色及区域均比较少;治疗后强的松组及葛妙组和葛芪参妙组阳性表达显示点颜色及区域又出现恢复性高表达。见图3。
模型组与空白组比较,NGF阳性表达IOD值大大降低,(P<0.01);各治疗组与模型组比较,NGF阳性表达IOD值均升高(P<0.01);治疗组中阳性表达IOD值比较:强的松组、葛妙组、葛芪参妙组>葛参组>葛芪组、葛根组(P<0.05)。见表4。
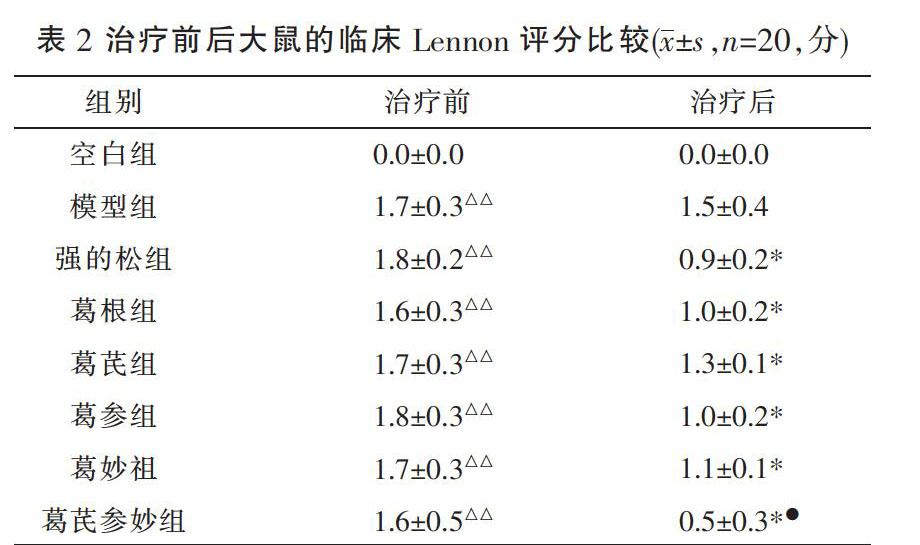
3.4.3 IGFs 模型组大鼠在人工造模后,肌细胞出现了较为严重的形状改变,IGFs的阳性表达明显少于正常大鼠的表达,用药治疗后大鼠的肌细胞均出现了一定程度的修复,IGFs的表达也明显升高,显示区域的颜色和面积都增加,可见在肌细胞受损区域IGFs表达较多,成肌细胞和肌纤维细胞都出现了一定程度的增殖修复。见图4。
与空白组比较,模型组大鼠IGFs阳性表达IOD值差异有统计学意义(P<0.01);与模型组比较,各治疗组大鼠IGFs阳性表达率IOD值升高差异有统计学意义(P<0.01);各治疗组组间相比较,强的松组和葛妙组、葛芪参妙组IOD阳性表达率差异无统计学意义(P>0.05),且强的松组高于葛参组、葛芪组、葛根组,差异有统计学意义(P<0.05)。见表5。
4 讨论
根据MG以肌肉痿废不用、运动无力且进行性加重[12]为主的临床特点,将其归属于中医学“痿证”范畴。中医学认为,脾气虚弱兼浊邪堆积是MG主要发病机制[3],其辨证总属虚实夹杂。《素问·痿论》中“治痿者独取阳明”的基本原则与《素问·热论》中“阳明主肉,其脉挟鼻络于目”的论述为治疗MG提供了思路源泉,李东垣亦提出脾胃受损是痿证的根源,而中医学“脾主肌肉”理论又为从脾胃论治MG提供了有力的理论依据。虚实夹杂证在MG发病过程中长期存在,脾气虚弱既化源不足又无以运化水湿,故筋脉失养或痰热湿瘀等浊邪客于经络而发病;脾胃升清降浊功能失常,浊邪堆积与脾气虚弱又可互为因果,故葛根及其配伍从脾胃论治MG,以单味药葛根解肌升津,葛根、黄芪配伍升提中气,葛根、黄芪、丹参相伍既活血又可祛瘀生新,葛根加四妙散活血通经、清利湿热,葛根配伍黄芪、丹参、四妙散共奏升清降浊之效。临床中,钱春红等[13-14]用黄芪葛根汤益气升阳兼以补血养血,并配合温针灸通过增强机体免疫功能治疗MG,疗效显著。李声岳[15]用以葛根为君药的葛根举陷汤健脾益肾、升阳举陷治疗眼肌型MG取得满意疗效。有学者提出“脾-肌肉-线粒体”相关学说[16],认为中医学的“脾”与肌肉线粒体密切相关[17],而MG的病变部位主要在肌肉,其中线粒体功能正常与否是肌肉运动的关键[18],本项目前期实验研究亦表明葛根不仅可作用于胃肠平滑肌线粒体,葛根及其配伍亦能作用于线粒体而改善肌无力症状[4-7]。故本项目从脾胃出发,选用以葛根及其配伍组合,通过其改善线粒体结构与功能来治疗MG合情合理。
本实验研究结果可见,经过治疗后观察线粒体超微结构,强的松组和各个中药组的线粒体都有恢复,其中巨大线粒体减少,异性线粒体变少,线粒体嵴致密度相对较为均匀,结构较为清晰,排列规律性恢复较好,葛芪组和葛芪参妙组经过治疗后整体形态恢复较好。该结果从实验角度证实了选用葛根及其配伍治疗MG的可行性。
FGF广泛存在于机体组织细胞中,是一类能够促进细胞增殖的生长因子;NGF在肌细胞的生长、发育、再生过程中起主导地位,能够促进骨骼肌成肌细胞的增殖;IGFs能够促进细胞的生长分化[19-20]。三者均能促进肌细胞的增殖,是促进肌肉生成的重要调控因子,故肌肉生成调控因子是肌肉生长的关键,也是影响MG肌肉生长的关键因子。根据MG虚实夹杂的特点,众医家治疗本病多主张扶正祛邪,但缺乏药物配伍疗效对比的实验研究。故本实验从MG的病机入手,设立葛根及其配伍组与强的松组、模型组进行对照,在观察其对肌肉生成调控因子的影响中发现,各治疗组中,FGF的阳性表达率:葛芪参妙组>葛妙组、葛参组、葛芪组>葛根组(P<0.05)。NGF治疗组中阳性表达IOD值比较:葛妙组、葛芪参妙组>葛参组>葛芪组、葛根组(P<0.01)。IGFs治疗组组间比较:葛妙组、葛芪参妙组>葛参组、葛芪组、葛根组(P<0.01)。该结果表明,葛根及其配伍均可促进肌肉生成调控因子(FGF、NGF、IGFs)的表达,其中,葛芪参妙组与葛妙组对肌肉生成调控因子的促进作用更显著,其次为葛参组与葛芪组,单味药葛根的促进作用最弱。究其原因,葛芪参妙组和葛妙组配伍用药精良,在单味药葛根的基础上分别配伍四妙散、黄芪、丹参,舒肌利湿、益气活血,治疗上扶正祛邪,有效促进肌肉生长调控因子的增殖;而葛参组、葛芪组虽有配伍,由于仅有两味药,其药效不及葛芪参妙组与葛妙组,因此对肌肉生长调控因子的促进作用较弱;单味药葛根疗效不及配伍组,这也凸显了中医配伍用药的重要性。在进一步的研究中,基于辨证论治的前提下可以考虑多增加几组配伍用药的数量,以期通过其对肌肉生成调控因子的促进作用,改善肌无力症状,使MG患者受益。
本项目基于“脾主肌肉”理论[21],通过研究葛根及其配伍组合对MG大鼠骨骼肌线粒体超微结构以及FGF、NGF、IGFs等肌肉生成調控因子的作用,以期明确葛根与哪一组药物配伍能有效促进肌肉生成调控因子的表达,来改善MG大鼠线粒体的结构并影响其功能。采用对照治疗的方法,明确了葛根及其配伍组较强的松组有更好的治疗效果,同时发现单味葛根疗效不及配伍组,证实中医配伍用药的重要性,为临床用药提供了思考与启迪。
参考文献
[1] 栗 爽,付 锦,杨 丹,等.重症肌无力的免疫发病机制研究[J].脑与志,2018,26(12):790-792,799.
[2] 高 丽,李壮林.重症肌无力的发病机制及临床治疗研究进展[J].中外医学研究,2019,17(9):173-176.
[3] 文颖娟.葛根及其配伍治疗重症肌无力探析[J].陕西中医学院学报,2012,35(2):64-66.
[4] 文颖娟,杨俊超.葛根复方对实验性自身免疫性重症肌无力大鼠血清RNS和AchR-Ab表达影响[J].中成药,2015,37(11):2357-2361.
[5] 杨俊超,文颖娟,王 超.葛根复方对重症肌无力大鼠IFN-γ和TGF-β1的影响[J].陕西中医,2015,36(9):1266-1267.
[6] 文颖娟,杨俊超,王 超.葛根复方对重症肌无力实验大鼠心肌线粒体酶活性的影响[J].现代中医药,2015,35(1):65-67.
[7] 杨俊超,姚远友,文颖娟.葛根及其复方对重症肌无力大鼠肌力恢复和IL-4的影响[J].陕西中医学院学报,2014,37(6):85-87.
[8] 文颖娟,李志花.葛根芩连汤及其拆方对UC大鼠结肠平滑肌线粒体跨膜电位的影响[J].陕西中医学院学报,2012,35(6):68-73.
[9] 刘 燕,杨 琳.影响肌肉生成的调控因子[J].饲料工业,2007,28(7):17-22.
[10] VANTEEMAR S. SREERAJ, SUDHIR VENKATARAMAIAH, ADITYA SUNKA, et al. Successful administration of electroconvulsive therapy in a patient with treatment-resistant schizophrenia and coexisting myasthenia gravis[J]. Indian Journal of Psychiatry, 2019, 61(6): 653-654.
[11] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:332-335.
[12] 刘 洋.中医理论创新琐谈(一)——以肝藏血主筋论治重症肌无力为例[J].中国中医基础医学杂志,2017,23(2):272-274.
[13] 钱春红,陈 惠.黄芪葛根汤配合温针灸治疗老年重症肌无力疗效及对T淋巴细胞亚群的影响[J].现代中西医结合杂志,2018,27(21):2353-2356.
[14] 刁殿琰,郭明秋,殷晓捷,等.黄芪葛根汤配合温针灸治疗老年重症肌无力的疗效及对T淋巴细胞亚群的影响[J].中国中医急症,2017,26(12):2108-2111.
[15] 张燕平.李声岳治疗眼肌型重症肌无力经验[J].中医杂志,2006,47(2):97.
[16] 刘友章.健脾祛湿方药在重症肌无力治疗中的应用——187例重症肌无力病例回顾分析[A].中华中医药学会脾胃病分会.中华中医药学会第二十一届全国脾胃病学术交流会暨2009年脾胃病诊疗新进展学习班论文汇编[C].深圳:中华中医药学会脾胃病分会,中华中医药学会,2009:5.
[17] 文颖娟,周永学,王 江.基于“线粒体—肌肉—脾”探讨脾胃失调与重症肌无力发病的关系[J].现代中医药,2013,33(5):25-27.
[18] CHO HYO MIN, SUN WOONG. The coordinated regulation of mitochondrial structure and function by Drp1 for mitochondrial quality surveillance[J]. BMB Reports, 2019,52(2):109-110.
[19] 赵 胜,毛 奇.补阳还五汤合八珍汤治疗糖尿病肌萎缩的疗效及其对患者血糖、胰岛功能、神经传导功能、血清相关因子的影响[J].中国实验方剂学杂志,2018,24(22):175-180.
[20] 李君子,毛 静,王丽丽,等.补肺健脾方对COPD大鼠骨骼肌IGF-1、mTOR和HIF1-α的影响[J].中医学报,2018,33(2):268-273.
[21] 陈志伟,李锦球,宋雅芳,等.基于AMPK、p38MAPK及COX Ⅳ探讨脾主肌肉与重症肌无力的关系[J].辽宁中医杂志,2019,46(9):1844-1846.

