甲磺酸阿帕替尼片联合放化疗对比单独放化疗治疗食管鳞癌:平行对照、探索性Ⅱ期临床研究
黄志宇 吴海山 姚奇伟 郑步宏 李建成

[摘要] 目的 探討甲磺酸阿帕替尼片联合放化疗治疗食管鳞癌的临床疗效及安全性。方法 方便选取该院收治的经病理学确诊的II、III、IV期食管鳞癌初治患者,随机分为单纯放化疗组、甲磺酸阿帕替尼片联合放化疗组,随访至疾病进展,统计分析所有患者无进展生存时间、临床疗效及安全性。结果 该研究共纳入2017年1月—2018年8月在该院接受治疗的37例食管鳞癌初治患者,其中单纯放化疗组(对照组)有19例, 甲磺酸阿帕替尼片联合放化疗组(实验组)有18例。单纯放化疗组中位无进展生存时间为3个月(范围1-9),甲磺酸阿帕替尼片联合放化疗组中位无进展生存时间为5个月(范围1-17),差异无统计学意义(χ2=1.143,P=0.285)。单纯放化疗组肿瘤缓解深度(Depth of Response,DPR)≥50%者3例,DPR<50%者16例;甲磺酸阿帕替尼片联合放化疗组DPR≥50%者9例,DPR<50%者9例,差异有统计学意义(χ2=4.937,P=0.026)。实验组中,高血压、肝功能损害、手足综合征、腹泻的发生率分别为11.11%(2/18)、5.56%(1/18)、11.11%(2/18)和5.56%(1/18)。对照组中乏力、腹泻、高血压的发生率均为5.26%(1/19)。 结论 甲磺酸阿帕替尼片联合放化疗对比单独放化疗治疗食管鳞癌可提高肿瘤缓解深度、改善肿瘤近期疗效, 并有提高无进展生存时间的趋势。不良反应主要表现为高血压、肝功能损害、手足综合征、腹泻。
[关键词] 阿帕替尼;放化疗;食管鳞癌
[Abstract] Objective To explore the clinical efficacy and safety of apatinibmesylate combined with chemoradiotherapy in the treatment of esophageal squamous cell carcinoma. Methods Convenient select the newly diagnosed patients with stage II, III and IV esophageal squamous cell carcinoma who were diagnosed by pathology were randomly divided into chemoradiotherapy alone group, apatinibmesylate combined with chemoradiotherapy group and follow-up to disease progression. Progression-free survival, clinical efficacy, and safety were all evaluated in all patients. ResultsBetween January 2017 and August 2018, a total of 37 patients fulfilled the inclusion criteria, 19 of whom receivedchemoradiotherapy alone (control group), while 18 received apatinibmesylate combined with chemoradiotherapy (experimental group). The median progression-free survival time was 3 months(range,1-9) in the chemoradiotherapy alone group and 5 months(range,1-17) in the combination of apatinibmesylate group, the difference was not statistically significant (χ2=1.143, P=0.285). In the chemoradiotherapy alone group, there were 3 patients with DPR (depth of response) ≥50% and 16 patients with DPR<50%, whereas there were 9 patients with DPR≥50% and 9 patients with DPR<50% in the combination of apatinibmesylate group, the difference was statistically significant(χ2=4.937, P=0.026). In the experimental group, the incidence of hypertension, liver function damage, hand-foot syndrome, and diarrhea were 11.11% (2/18), 5.56% (1/18), 11.11% (2/18), and 5.56% (1/18). And the rate of fatigue, diarrhea, and hypertension in the control group was 5.26%(1/19). Conclusion Apatinibmesylate combined with chemoradiotherapy for esophageal squamous cell carcinoma can improve the tumor deepness of response and response rate, and exhibited the trend in increasing the progression-free survival time. Adverse reactions mainly reported as hypertension, liver damage, hand-foot syndrome, and diarrhea.
[Key words] Apatinibmesylate; Chemoradiotherapy; Esophageal squamous cell carcinoma
食管癌是我国常见的恶性肿瘤,随着手术、化疗及放疗技术的发展,食管癌的临床治疗有了很大的进展,但是其5年生存率仍低于30%[1-2]。随着近几年分子肿瘤学的进展,分子靶向治疗在多种肿瘤中显示出较好疗效,在食管癌治疗中的应用探索也越来越多。甲磺酸阿帕替尼是酪氨酸激酶抑制剂,是我国自主研制的药物,是一种新型口服小分子抗血管生成制剂,可高度选择性地结合并抑制血管内皮细胞生长因子受体-2(Vascular Endothelial Growth Factor Receptor- 2,VEGFR-2),从而抑制肿瘤血管生成,抑制肿瘤生长,有利用度高、耐受性好的特征[3-7]。最开始甲磺酸阿帕替尼主要用于在临床中治疗晚期胃癌,后随着对其他恶性肿瘤的研究发现,阿帕替尼对肺癌、乳腺癌、肝癌等恶性肿瘤效果显著。既往有文献报道食管鳞癌细胞高表达VEGFR1-3[8-9],但目前将阿帕替尼用于食管鳞癌治疗研究的文献很少。该研究拟将新型抗肿瘤血管生成药物阿帕替尼联合放化疗对比单独放化疗治疗食管鳞癌,评估临床疗效及不良反应。共纳入2017年1月—2018年8月在该院接受治疗的37例食管鳞癌初治患者,目前随访至2018年9月,后续将继续随访。报道如下。
1 资料与方法
1.1 一般资料
该次研究在医院伦理委员会批准的前提条件下开展,方便选取在该院接受治疗的37例食管鳞癌初治患者作为研究对象,且患者均同意加入此次研究。观察对象纳入标准:年龄:≥18 周岁;经病理学(包括组织学或细胞学)确诊的食管鳞癌患者,病理分期为II 期、III 期和IV 期(依据AJCC 第8版);至少有一个影像学检查可测量病灶(RECIST 标准1.1 版本);ECOG PS:0~2 分;预计生存期≥3 个月;无严重心、肺、肝功能障碍;无黄疸及消化道梗阻;未伴发急性感染;主要器官功能正常,血常规、血生化及凝血功能检查基本正常。排除标准:既往曾接受放化疗或阿帕替尼治疗者;晚期复发或伴有远处转移者;已知或怀疑对化疗药物紫杉醇、奈达铂等过敏者;怀孕期或哺乳期妇女;以往或同时患有其他恶性肿瘤,但是已治愈的皮肤基底细胞癌和宫颈原位癌除外;患有高血压且经降压药物治疗无法降至正常范围内者(收缩压>140 mmHg,舒张压>90 mmHg);患有I级以上冠心病、心律失常(包括QTc 间期延长男性>450 ms,女性>470 ms)及心功能不全;凝血功能异常(INR、APTT>1.5 ×ULN),具有出血倾向者;既往有心脑血管病史,目前仍口服溶栓药或抗凝药的患者。食管有深溃疡或穿孔倾向或呕血者;尿蛋白阳性的患者(尿蛋白检测2+或以上,或24 h尿蛋白定量>1.0 g);根据研究者的判断,有其他严重的危害患者安全或影响患者完成研究的伴随疾病的患者或研究者认为不适合纳入者。随机将研究对象分为对照组和实验组。对照组19例,实验组18例。对照组:男12例,女7例;年龄为48~83岁;临床分期:II期4例、III期7例、IV期8例;实验组:男15例,女3例;年龄为46~81岁;临床分期:II期5例、III期9例、IV期4例。两组食管癌患者的临床资料差异无统计学意义(P>0.05),可展开对比研究。详细数据见表1。
1.2 方法
對照组:以“紫杉醇(泰素)(国药准字H20090547):135 mg/m2,静滴,d1及奈达铂(鲁贝)(国药准字H2005 0563):80 mg/m2,静滴,d2”方案化疗;21 d为一个治疗周期,治疗2~4 个周期。放疗:6MV-X 线,调强放疗,参照食管吞钡造影、胸部CT、食管镜检查勾画食管肿瘤靶区(GTV)及危及器官(OAR),包括脊髓、两侧肺等。95%的等剂量线包括PTV,并以该等剂量线作为处方剂量,PTV内部剂量差异在±5%以内,脊髓受照量在50%的等剂量线以下,心脏V40<40%,两肺Vmean<15% ,脊髓最大剂量Dmax<45 Gy/6 周。照射总剂量为50~63 Gy,常规分割(5 次/周,2~2.1Gy/次)。
实验组:甲磺酸阿帕替尼片(艾坦)(国药准字H20140103)500 mg口服,d1~d21;“紫杉醇(泰素)(国药准字H20090547):135 mg/m2,静滴,d1及奈达铂(鲁贝)(国药准字H20050563):80 mg/m2,静滴 ,d2”方案21 d为一个治疗周期,治疗2~4 个周期;放疗:放疗方法及剂量同对照组放疗方案。患者在结束放化疗后,给予阿帕替尼维持治疗至疾病进展。若患者出现难以忍耐的不良反应,则可减少药物剂量,每日用药250 mg。
1.3 观察指标
观察患者用药期间的不良反应(蛋白尿、血压升高、手足综合征、乏力、腹泻、肝功能损害等)发生情况。对比患者放化疗后及口服6个星期后的疗效,根据用药后患者肿瘤瘤体的变化情况(RECIST标准1.1 版本)将疗效评判标准分为4个等级:若瘤体完全消失,则表明病情完全缓解(CR);若瘤体比治疗前缩小30%以上,则为部分缓解(PR);若治疗后瘤体缩小不足30%,或增大但值不超过20%,则为疾病稳定(SD);若治疗后瘤体增大,值超过20%,或出现新的转移病灶,则表明疾病进展(PD)。客观缓解率(Objective response rate,ORR)是指肿瘤缩小达到一定量并且保持一定时间的比例,包括完全缓解(CR)和部分缓解的病例(PR)。同时引用肿瘤缓解深度(Depth of Response,DPR),即肿瘤退缩的深与浅进一步分析肿瘤消退情况。随访至疾病进展或病人死亡,统计分析无进展生存时间(Progression-Free Survival,PFS):指患者从接受治疗开始,到观察到疾病进展或者发生因为任何原因的死亡之间的时间。随访内容包括:病史和体格检查、血液实验室检查、食管及上腹部CT、食管钡透造影、必要时完善食管镜、颅脑MRI、骨ECT或全身PET-CT等。化疗期间每2周期复查1次,放化疗后每3个月复查1次,持续2年,随后每半年复查1次,持续至5年,此后每年复查1次。记录疾病进展时间及死亡时间、死亡原因。
1.4 统计方法
应用SPSS 15.0统计学软件分析数据,计数资料用[n(%)]表示,组间比较行χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效
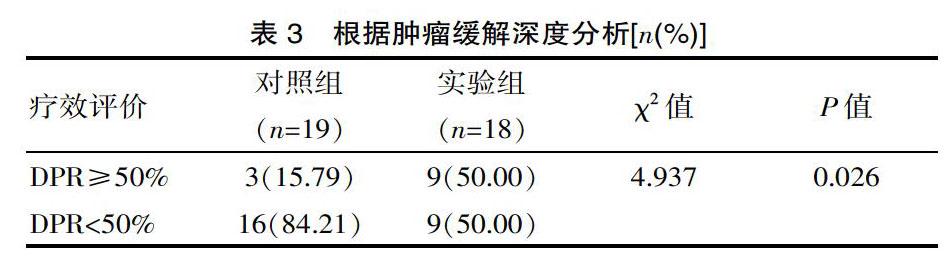
对照组CR者0(0/19)例、PR者16(16/19)例、SD者2(2/19)例、PD者1(1/19)例;实验组中CR者0(0/18)例、PR者9(9/18)例、SD者9(9/18)例、PD者0(0/19)例,对照组达客观缓解为16例(84.21%),实验组达客观缓解为9例(50.00%),差异有统计学意义(χ2=4.937,P=0.026),见表2。而根据肿瘤缓解深度分析:对照组DPR≥50%为15.79%(3/19),实验组DPR≥50%为50%(9/18),差异有统计学意义﹙χ2=4.937,P=0.026﹚,见表3 。
2.2 不良反应
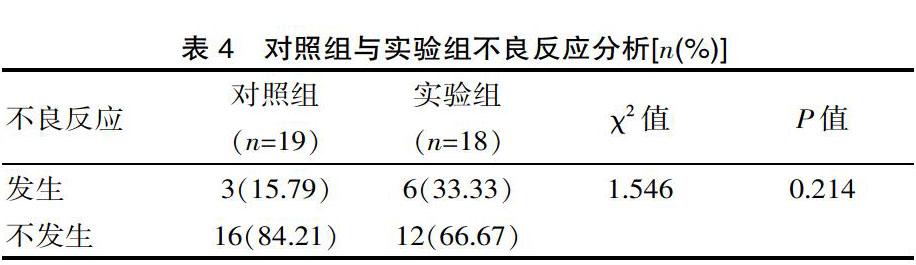
实验组中,口服药2~3周期间,2例发生高血压,发生率为11.11%(2/18);1例发生肝功能损害,发生率为5.56%(1/18);2例发生手足综合征,發生率为11.11%(2/18),予下调阿帕替尼剂量为250 mg/d口服后好转,另有1例发生腹泻,发生率为5.56%(1/18)。对照组中有1例发生乏力,1例发生腹泻及1例发生高血压,发生率均为5.26%(1/19)。两组不良反应发生率相比, 差异无统计学意义(P>0.05),见表4。
2.3 下调阿帕替尼剂量后疗效分析
对比近期疗效,对照组DPR≥50%为15.79%(3/19),实验组500 mg(阿帕替尼500 mg口服)DPR≥50%为53.85%(7/13),实验组250 mg(下调阿帕替尼250 mg口服)DPR≥50%为40.00%(2/5),差异无统计学意义(P>0.05),见表5。
2.4 生存分析
随访至2018年9月,对照组中有1例死亡,发生率为5.26%(1/19),其余18例患者未见进展;实验组中,无死亡病例,发生率为0.00%(0/18),18例患者疾病未见进展。对照组中位PFS为3个月(范围1-9);实验组中位PFS为5个月(范围1-17)。两组对比,差异无统计学意义(P>0.05),见图1。
3讨论
进入21世纪,随着生活水平提高,恶性肿瘤已经成为严重危害人类健康的疾病。恶性肿瘤是一种多基因疾病,它的发生、发展与其血管生成密切相关[10],其中血管内皮生长因子及其受体(VEGF/VEGFR)信号通路是诱导肿瘤血管新生最重要的调控途径,也是多种抗肿瘤血管生成剂的关键靶点之一[11]。研究发现,血管内皮生长因子(VEGF)及血管内皮生长因子受体(VEGFR)在促进血管生成的过程中发挥着重要的作用[12-14]。阿帕替尼是我国首个完全自主研发的1.1类抗肿瘤新药,也是全球第一个在晚期胃癌患者中被证实为安全有效的小分子抗血管生成靶向药物。该药已于2014年由国家食品药品监督管理总局(CFDA)批准上市,用于晚期胃或胃-食管结合部腺癌的三线或三线以后治疗。一项III期随机双盲对照临床实验共入组了267例晚期胃癌患者,研究结果显示阿帕替尼能明显提高晚期胃癌患者的中位无进展生存期及中位生存期[15]。其他的许多研究也证实了阿帕替尼在晚期胃癌治疗具有优势[16-17]。此外,阿帕替尼在其他实体瘤的临床研究中也展现了较好的抗肿瘤活性[3,18-20],正在开展多项临床研究。
食管癌是我国常见的恶性肿瘤之一[21],而食管鳞状细胞癌是其最主要的类型[22]。文献报道食管鳞癌细胞高表达VEGFR1-3,而越来越多的数据提示食管癌中VEGF‐VEGFR表达与预后具有相关性[8,23]。在一项研究中发现,食管鳞癌细胞胞浆中VEGFR1的表达与淋巴结转移相关,和预后无关;胞浆VEGFR2表达与临床病理特征及预后不相关,而与肿瘤血管密度及淋巴结播散有关,揭示了VEGFR及其配体作用后与肿瘤进展的相关性[24-26]。因此,VEGFR可能成为食管癌的重要治疗靶点。
一项研究中,共纳入62例一线化疗失败的晚期食管鳞癌患者,予口服阿帕替尼治疗,其疾病控制率及缓解率分别为74.2%和24.2%,提示了阿帕替尼用于治疗晚期食管鳞癌的潜在性[27]。另一项研究结果显示,阿帕替尼对某些晚期食管癌患者有明显疗效,可在短时间内改善症状。该研究最后2例患者均死于大出血[28],因此该研究在严格把握入组标准的条件下将甲磺酸阿帕替尼与放化疗联合以治疗II、III、IV期食管鳞癌初治患者,是一项平行对照、探索性的II期临床实验。研究结果显示甲磺酸阿帕替尼联合放化疗对比单纯放化疗,对照组客观缓解率高于实验组(按RECIST标准1.1 版本分析)。但根据DPR(肿瘤缓解深度)进一步分析发现,甲磺酸阿帕替尼联合放化疗组DPR≥50%者占50%,而单纯放化疗组DPR≥50%者仅占15.79%, 差异有统计学意义﹙P<0.05﹚,可见阿帕替尼联合放化疗治疗食管鳞癌可提高肿瘤缓解深度,有助于肿瘤最大程度的退缩。这与上述实验的结果相一致。因该研究随访时间短,该研究结果需谨慎考虑。
既往有研究结果建议阿帕替尼的口服剂量为500 mg/d,可明显降低毒副作用而提高用药的安全性[29]。而上述实验的研究认为食管鳞癌患者口服阿帕替尼500 mg/d,其毒副反应发生率较高,需要进一步调整阿帕替尼的剂量[27]。该研究中口服阿帕替尼组有5例因不耐受不良反应,予下调剂量为250 mg/d口服后,根据大部分时间(>50%口服时间)口服剂量计算不同阿帕替尼剂量对近期疗效的影响,发现口服不同剂量阿帕替尼并联合放化疗对近期疗效影响不大。但口服阿帕替尼500 mg/d 组DPR≥50%者占53.85%,而口服250 mg/d组DPR≥50%者占40.00%,可见阿帕替尼治疗食管鳞癌疗效可能具有浓度依赖性,这与体外试验阿帕替尼联合传统化疗药物对食管癌ECA109细胞的抑制作用具有浓度依赖性的结果相一致[26]。文献报道阿帕替尼对食管癌细胞株ECA109具有良好的细胞生长抑制、促凋亡作用,且与传统化疗药物联用有协同抑制作用,能够增强多种传统化疗药物的化疗敏感性,如多西紫杉醇、依托泊苷、氟尿嘧啶、奥沙利铂、多柔比星等[30-32],其发挥作用机制可能与下调VEGF 、AKT 表达有关。
既往众多研究显示联合阿帕替尼治疗恶性肿瘤并不明显增加肿瘤患者的毒副反应,且通常其不良反应在积极对症处理后均可耐受[30],该研究针对不良反应发生情况分析,单纯放化疗组不良反应总发生率为15.79%,甲磺酸阿帕替尼联合放化疗组不良反应总发生率为33.33%,差异无统计学意义(P>0.05)。对照组中乏力、腹泻及高血压,发生率均为5.26%(1/19),而甲磺酸阿帕替尼联合放化疗组中高血压、肝功能损害、手足综合征、腹泻,发生率分别为11.11%(2/18)、5.56%(1/18)、11.11%(2/18)和5.56%(1/18)。两组中各项不良反应发生率均差异无统计学意义(P>0.05)。且甲磺酸阿帕替尼联合放化疗组所发生的不良反应程度较轻,通过下调阿帕替尼剂量并配合对症处理后可耐受。
该研究的主要研究终点为无进展生存期(PFS),因该研究开展时间短,以患者接受治疗开始,到观察到疾病进展、因任何原因死亡或采用最后一次影像学检查日期作为终点的这段时间为无进展生存期。研究结果发现单纯放化疗组1例患者死亡,甲磺酸阿帕替尼聯合放化疗组未见肿瘤进展,两组中位PFS分别为3个月(范围1~9)、5个月(范围1~17),差异无统计学意义(P>0.05)。但甲磺酸阿帕替尼联合放化疗组在提升PFS有一定的趋势,且甲磺酸阿帕替尼联合放化疗组可提高DPR,或许可进一步提高肿瘤局部控制率,进而延长PFS、OS。这有待大型、前瞻性研究来证实。
综上所述,在初治II、III、IV期食管鳞癌患者的临床治疗中,甲磺酸阿帕替尼联合放化疗较单纯放化疗相比,可提高肿瘤缓解深度,有助于肿瘤最大程度的退缩。其较容易发生不良反应,但属于可控制、可耐受范畴。
[参考文献]
[1] Allemani CMT,Di Carlo V, Harewood R, et al.Global surveill ance of trends in cancer survival 2000-14 (CONCORD-3)_ analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries.[J]. Lancet, 2018.
[2] MartinekJ,Akiyama JI,Vackova Z,et al. Current treatment options for esophageal diseases[J]. Ann N Y Acad Sci,2016,1381(1): 139-151.
[3] Qiu H,Li J,Liu Q,et al. Apatinib,a novel tyrosine kinase inhibitor,suppresses tumor growth in cervical cancer and synergizes with Paclitaxel[J]. Cell Cycle,2018,17(10): 1235-1244.
[4] Zhang H. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther,2015﹙9﹚: 6075-6081.
[5] Ye X,Ni Y. Angiogenesis and apatinib: Can be used for the patients with non-gastic cancer[J].Journal of Cancer Research and Therapeutics,2018,14(4): 727.
[6] Chen LT,Oh DY,Ryu MH,et al. Anti-angiogenic Therapy in Patients with Advanced Gastric and Gastroesophageal Junction Cancer: A Systematic Review[J].Cancer Res Treat,2017,49(4): 851-868.
[7] SP,YZ,HP,et al. Intracellular autocrine VEGF signaling promotes EBDC cell proliferation,which can be inhibited by Apatinib[J]. Cancer letters,2016,373(2): 193-202.
[8] 汪慧,冯志寅,陈晓. VGEFR2在哈萨克族食管鳞癌中的表达及临床病理参数分析[J]. 新疆医科大学学报,2016,9(39): 1197-1200,1210.
[9] Wen Wen Xu,Bin Li,Alfred Ky Lam,et al. Targeting VEGFR1- and VEGFR2-expressing non-tumor cells is essential for esophageal cancer therapy[J].Oncotarget,2014,6(3): 1790-1805.
[10] NF,Ap A. Ten years of anti-vascular endothelial growth factor therapy[J]. Nature reviews. Drug discovery,2016,15(6): 385-403.
[11] 涂艷,彭枫.阿帕替尼治疗恶性肿瘤的临床研究进展[J]. 中国肿瘤临床,2016,12(43): 545-548.
[12] JH.Beyond HER2: recent advances and future directions in targeted therapies in esophagogastric cancers[J]. Journal of gastrointestinal oncology,2016,7(5): 763-770.
[13] Cs A,RR,Sj S,et al. VEGF-A/VEGFR2 signaling network in endothelial cells relevant to angiogenesis[J]. Journal of cell communication and signaling,2016,10(4): 347-354.
[14] Zhao JZX,Gong C,Zhang J. Targeted therapy with apatinib in a patient with relapsed small cell lung cancer: A case report and literature review[J].Medicine,2017,96(50): e9259.
[15] JL,SQ,JX,et al. Randomized,Double-Blind,Placebo-Controlled Phase III Trial of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenoca rcinoma of the Stomach or Gastroesophageal Junction[J]. Journal of clinical oncology:official journal of the American Society of Clinical Oncology,2016,34(13): 1448-1454.
[16] GR,AR,KP,et al. Apatinib: A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J]. Cancer letters,2016,372(2): 187-191.
[17] CL,SW,WX,et al. Apatinib inhibits cellular invasion and migration by fusion kinase KIF5B-RET via suppressing RET/Src signaling pathway[J].Oncotarget,2016,7(37): 59236-59244.
[18] Sun D,Hou H,Zhang C,et al. The efficacy and safety of apatinib for refractory malignancies: a review and meta-analysis[J]. Onco Targets Ther,2018,11: 6539-6554.
[19] Li X,Li X,Fang X,et al. Long-term progression-free survival of third-line apatinib in lung squamous cell carcinoma[J]. OncoTargets and Therapy,2018,Volume 11: 4047-4050.
[20] Kou PZ,Y Shao,W YuJ.Significant efficacy and well safety of apatinib in an advanced liver cancer patient: a case report and literature review[J].Oncotarget,2017,8(12): 20510-20515.
[21] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018.
[22] Wang QL,Xie SH,Wahlin K,et al. Global time trends in the incidence of esophageal squamous cell carcinoma[J]. Clin Epidemiol,2018(10):717-728.
[23] WQ,Jd F,FY,et al. Clinical implications of PTEN and VEGF expression status,as well as microvessel density in esophageal squamous cell carcinoma[J].Oncology letters,2015,10(3): 1409-1415.
[24] Cui Y,Dong C,Wu B,et al. Expression of cyclooxygenase-2,vascular endothelial growth factor,and epidermal growth factor receptor in Chinese patients with esophageal squamous cell carcinoma[J].J Cancer Res Ther,2015,11(5):44-48.
[25] Eng L,Azad A,Qiu X,et al. Discovery and validation of vascular endothelial growth factor(VEGF)pathway polymorp hisms in esophageal adenocarcinoma outcome[J]. Carcinog enesis,2015,36(9): 956-962.
[26] 安改麗,旭 李,黄尚科,等. 阿帕替尼联合顺铂对食管癌ECA109细胞抑制作用及机制探讨[J]. 陕西医学杂志,2017,46(2):148-151.
[27] JL,LW.Efficacy and safety of apatinib treatment for advanced esophageal squamous cell carcinoma[J]. OncoTar gets and therapy,2017,10(undefined): 3965-3969.
[28] Wang W,Zhang L,Xie Y,et al. Fatal hemoptysis in patients with advanced esophageal cancer treated with apatinib[J].OncoTargets and Therapy,2018,2018:2565-2570.
[29] X H,J Z,B X,et al. Multicenter phase II study of apatinib,a novel VEGFR inhibitor in heavily pretreated patients with metastatic triple-negative breast cancer[J]. International journal of cancer,2014,135(8): 1961-1969.
[30] Cheng H,Sun A,Guo Q,et al. Efficacy and safety of apatinib combined with chemotherapy for the treatment of advanced gastric cancer in the Chinese population: a systematic review and meta-analysis[J].Drug Design,Develop ment and Therapy,2018,2018: 2173-2183.
[31] Gourley C. Apatinib and etoposide: surprising efficacy of an oral combination[J].The Lancet Oncology,2018,19(9): 1146-1147.
[32] Lan CY,Wang Y,Xiong Y,et al.Apatinib combined with oral etoposide in patients with platinum-resistant or platinum-refractory ovarian cancer (AEROC): a phase 2,single-arm,prospective study[J].The Lancet Oncology,2018,19(9): 1239-1246.
(收稿日期:2019-11-22)

