机械通气联合PS对早产儿RDS的治疗效果*
方婉茹,王鉴*
(贵州医科大学附院 新生儿科,贵州 贵阳 550004)
新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)为肺表面活性物质(pulmonary surfactant,PS)缺乏所致,表现为患儿生后数小时出现进行性呼吸困难、青紫、吸气性三凹征和呼吸衰竭[1],病理上表现为肺透明膜,故又称肺透明膜病(hyaline membrane disease of the lung,HMD)[2]。PS在胎龄18~20周开始分泌,胎龄35~36周达到正常水平[3],故RDS多见于早产儿,是新生儿死亡的常见病因[4]。机械通气联合PS替代治疗已成为世界各地许多新生儿重症监护病房(neonatal intensive care unit,NICU)个性化治疗策略的一部分,多年的临床经验证实PS替代疗法治疗RDS疗效肯定[5-6]。既往研究表明,导致RDS的母亲因素包括妊娠期糖尿病、择期或选择性剖宫产及胎膜早破,新生儿因素与胎龄、新生儿窒息及性别有关[7],早期予以大剂量PS治疗RDS效果明显[8-9],但关于机械通气联合PS治疗RDS时机的研究不多。因此,本研究回顾性分析采用呼吸机辅助通气联合PS治疗100例RDS早产儿资料,分析不同出生后小时龄开始PS治疗对RDS患儿的动脉血气指标、插管呼吸机使用率、住院时间、并发症及病死率的影响,为临床治疗提供依据。
1 对象和方法
1.1 对象、主要药剂与仪器
1.1.1对象及分组 选取2015年1月-2017年12月收治的RDS早产患儿,要求符合《实用新生儿学》(第四版)中RDS诊断标准[2],排除出生时胎龄≥37周、经临床综合分析排除引起相同呼吸窘迫表现的其他疾病(胎粪吸入综合征、湿肺、宫内感染性肺炎及先天性心脏病等)及无需呼吸机辅助通气的患儿。共纳入RDS早产患儿100例,男65例、女35例,胎龄28~36+6周(31.93±1.92周),出生体质量700~3 350 g、平均(1 749.30±535.39)g,按PS治疗时间不同分为A组(PS开始治疗时间为新生儿出生后小时龄<6 h)、B组(PS开始治疗时间为新生儿出生后小时龄≥6 h~<12 h)和C组(PS开始治疗时间为新生儿出生后小时龄≥12 h)。各组患儿一般临床资料见表1。
1.1.2主要药剂和仪器 猪肺磷脂注射液(固尔苏Curosurf,意大利凯西制药公司,批号H20080428和H20080429)、i-STAT System300-G手持式血液分析仪(美国Abbott公司)、STEPHAN CPAP小儿呼吸机(德国F.Stephan GmbH公司)、SERVO-i西门子呼吸机(德国西门子公司)。
1.2 方法
1.2.1PS治疗方法 入选患儿均常规给予保暖、保持呼吸道通畅,维持酸碱平衡、纠正电解质紊乱,防治感染,保护心脑等重要脏器功能等一般治疗。当患儿临床上出现呼吸窘迫表现、并进行性加重、鼻导管或头罩给氧不能缓解的低氧血症,立即给予呼吸机辅助通气。当导致患儿机械通气的病因好转或去除,通过撤机筛查试验及自主呼吸试验(spontaneous breathing trial,SBT)[10]时予以撤机。对于生后需要气管插管稳定的患儿立即给予PS治疗,或当持续呼气末正压通气(continue positive end-expiratory pressure ventilation,CPAP)压力≥6 cm H2O、吸入氧浓度(fraction of inspiration O2,FiO2)>30%、患儿病情进一步恶化,给予PS治疗[11]。本研究采用的PS为猪肺磷脂注射液,避光、保存于2~8 ℃,使用前将药瓶升温至37 ℃,并上下摇匀。用药前充分吸痰,通过气管内插管将药液滴注到下部气管,患儿按仰卧位、右侧卧位及左侧卧位顺序分别依次给药,然后根据患儿情况,选择适宜的机械通气方式辅助通气。给药后若无需有创呼吸机辅助通气的患儿可直接拔除气管导管,改为无创鼻塞持续呼气末正压通气(nasal obstruction with continuous positive end-expiratory pressuren,nCPAP)辅助通气。用药6 h内尽量避免拍背吸痰,使药液充分均匀分布;用药后密切监测血气、经皮氧饱和度,根据结果酌情调整给氧浓度,以避免高氧血症。
1.2.2临床资料收集和检测 收集患儿的临床资料信息,包括性别、胎龄、出生体质量、母亲产前使用激素比例、重度RDS比例、插管呼吸机使用、住院时间、肺部感染、肺出血、颅内出血、支气管肺发育不良(bronchopulmonary dysplasia,BPD)及病死情况,其中肺部感染的诊断有肺部体征和(或)影像学支持[2],肺出血、颅内出血及BPD的诊断均符合相应诊断标准[12-14]。所有患儿均分别于PS治疗前、PS治疗后3~6 h、12 h及24 h抽取左手桡动脉血0.1~0.2 mL进行动脉血气分析:包括pH值、动脉氧分压(partial pressure of oxygen,PaO2)及动脉二氧化碳分压(partial pressure of carbon dioxide,PaCO2),并计算氧合指数(PaO2/FiO2)。
1.3 统计学分析
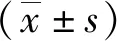
2 结果
2.1 一般资料
3组新生儿的出生胎龄及体质量、母亲产前使用激素比例、重度RDS所占比例、男性RDS所占比例及PS使用剂量差异均无统计学意义(P>0.05)。见表1。
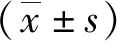
表1 各组新生儿的一般资料比较Tab.1 The comparison of general data in the newborns of each
2.2 PS治疗前后动脉血气指标比较
组间比较的结果显示,PS治疗前各组患儿的pH、PaO2、PaO2/FiO2及PaCO2比较,差异均无统计学意义(P>0.05);PS治疗后,A组各时点的pH 、PaO2及PaO2/FiO2均明显高于B组与C组,PaCO2均明显低于B组与C组(P<0.05),而B组、C组各个时间点的血气指标比较,差异均无统计学意义(P>0.05)。组内比较的结果显示,A组患儿pH值、PaO2及PaO2/FiO2从3~6 h开始较治疗前明显升高,PaCO2从12 h开始较治疗前明显降低(P<0.05);B组患儿pH值和PaO2从3~6 h,PaO2/FiO2从12 h开始较治疗前明显升高,PCO2从12 h开始较治疗前明显降低(P<0.05);C组患儿pH值、PaO2从3~6 h开始较治疗前明显升高(P<0.05),而PaCO2在治疗后24 h时较治疗前明显降低(P>0.05)。见表2。
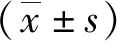
表2 各组新生儿PS治疗前后的血气指标比较Tab.2 The comparison of arterial blood gas indexes in the newborns of each group before and after the
注:(1)与同组PS治疗前比较,P<0.05;(2)与A组同时点比较,P<0.05;。
2.3 不同PS治疗时间对早产儿RDS转归的影响
A组早产儿的插管呼吸机使用率、肺部感染率、BPD发生率及病死率均低于C组,差异均有统计学意义(P<0.05)。见表3。
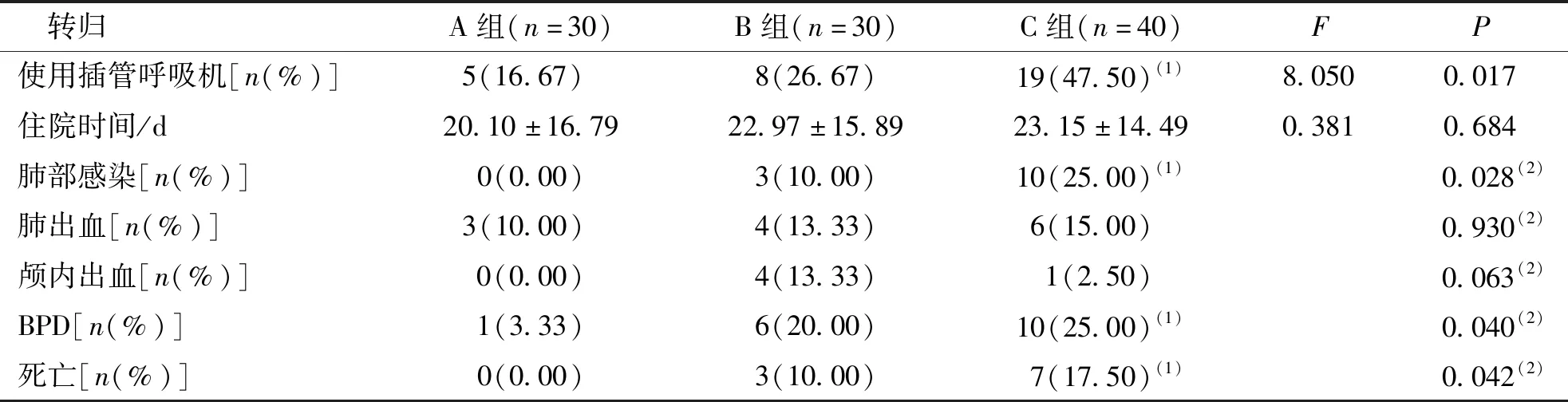
表3 各组新生儿RDS转归比较Tab.3 The effect of RDS prognosis in the newborns of each group
注:(1)与A组比较,P<0.05;(2)为Fisher确切概率法(无检验统计量值,仅有P值)。
3 讨论
PS是肺泡上皮细胞分泌的一种以磷脂和特异性蛋白质为主要成分的混合物质,在胎龄35~36周达正常水平,主要分布于肺泡内,其功能是降低肺表面张力,维持肺泡的稳定性,增加肺泡的顺应性和肺组织的弹性,在呼气末防止肺泡萎陷,保证在整个通气循环有充分的气体交换,有助于维持肺泡与毛细血管之间的液体平衡,防止肺水肿[15]。当新生儿发生RDS时,予以呼吸机辅助通气,维持一定的呼气末正压能有效防止肺萎陷,改善氧合,减少CO2潴留,避免呼吸肌疲劳,同时应尽早联合外源性肺表面活性物质治疗[16]。此治疗方法能迅速纠正PS分泌不足的病因,缓解患儿呼吸窘迫症状,既是对因治疗,又是对症治疗[17]。本研究结果表明,使用PS后患儿的pH值、PaO2及PaO2/FiO2较用药前明显升高,PaCO2较用药前明显下降(P<0.05);且PS治疗后,A组的pH值、PaO2及PaO2/FiO2较B、C组高,PaCO2较B和C组低(P<0.05)。分析其可能原因:RDS患儿体内内源性PS进行性消耗,肺泡进行性萎陷,当肺通气、换气功能障碍,氧合不能满足机体需要时,就会出现低氧血症、高碳酸血症和酸中毒。补充外源性PS后,PS能迅速进入各级肺泡组织,降低肺泡表面张力,避免肺泡萎陷,维持肺泡功能残气量,肺功能恢复,氧合正常。通过分析患儿的血气指标发现,补充PS后,患儿的pH值、PaO2、PaO2/FiO2及PaCO2明显改善,患儿的低氧血症、高碳酸血症及酸中毒得到明显纠正,提示PS能有效的改善RDS患儿氧合,提高患儿肺通气、换气功能,通畅患儿呼吸,进而纠正酸中毒,与大量相关临床研究结果相符[18-20]。研究也显示PS治疗时间越早效果越显著,若治疗开始较晚,缺氧、酸中毒可能已引起肺毛细血管通透性增高,且肺组织损害是不可逆转的[21],故而推荐尽早使用PS治疗RDS患儿。
本研究经PS治疗后,3组患儿的插管呼吸机使用率、肺部感染率、BPD的发生率及病死率有明显差异,以A组最低(P<0.05)。因此,尽早使用PS能降低插管呼吸机使用率、患儿肺部感染及BPD的发生率,明显降低患儿的病死率。既往研究表明,PS能降低插管呼吸机使用率和住院时间,降低患儿死亡率[22]。分析其原因:RDS患儿肺顺应性过低,单纯采用机械通气容易导致气压伤,尽早补充外源性PS可有效提高患儿肺顺应性,减少对插管呼吸机的依赖及对氧的需求,有效降低BPD的发生。且机械通气为有创操作,容易引发肺部感染,尽早下机能减少肺部感染的发生,提高患儿的生存质量。本研究3组患儿的住院时间虽以A组最短,但差异无统计学意义(P>0.05),与既往研究[23]结果不一致,考虑可能与患儿合并其他疾病导致住院时间延长有关。本研究3组患儿的肺出血、颅内出血差异无统计学意义(P>0.05),可能与样本量不足有关,后续研究可加大样本量。
根据截止2018年最新文献的证据,欧洲新生儿专家对2016版欧洲RDS防治指南进行修改的基础上发布了2019版欧洲早产儿RDS管理指南[11,23]。在PS给药时机方面,2019版指南指出对RDS患儿应该在疾病早期给予其抢救性PS治疗,PS早期治疗应成为标准化的治疗方案,对出生后需要气管插管稳定时可以在产房使用PS。在PS给药方法方面,既往建议INSURE技术(intubation-surfactant-extubation,INSURE)[24],现在提倡LISA/MIST技术(less invasive surfactant administration,LISA)/(minimally invasive surfactant treatment,MIST),即在CPAP下,使用喉镜和Magill钳将细软导管置于自主呼吸早产儿气管内的一种侵入性较小的PS给药的技术[25]。该技术降低气管插管对气管黏膜损伤的风险,避免了PS运用过程中正压通气过程[26]。有研究显示,LISA/MIST可减少早产儿机械通气时间,提高早产儿生存率[27],降低患儿BPD复合结局风险及对氧的需求[28]。本研究为回顾性临床资料分析,故给药方法采用老方法,但本研究显示尽早PS治疗RDS患儿的有效性与最新指南一致。
综上所述,呼吸机辅助通气联合PS是RDS首选的治疗方法,同时尽早PS治疗是治疗成功的关键,能有效改善RDS患儿的肺通气、换气功能,提高氧合,纠正酸中毒,缓解患儿呼吸窘迫的症状,降低插管呼吸机使用率,患儿肺部感染及BPD的发生率,挽救患儿生命。

