铜和镉胁迫对海洋青鳉摄食行为的影响
陈剑明 徐永健 卢光明, 宁 燕 潘 霞
(1. 宁波大学海洋学院, 应用海洋生物技术教育部重点实验室, 宁波 315832;2. 中国科学院宁波材料技术与工程研究所, 宁波 315211)
重金属由于其来源广、存留时间长、具有蓄积性、能沿着食物链转移富集及对环境产生持久性影响等特点, 是河口和近岸水域的重要污染物。重金属还能沉积在环境中, 并随时被重新释放回上覆水体中再次造成危害[1]。其中, 汞、镉、铜、铅、锌等几种剧毒重金属较容易被生物体吸收, 已被美国环保局(USEPA)列入环境优先污染物名单,进行优先监控[2]。已有研究表明, 这些重金属能影响到水生动物的生理和行为[3—6]。但经文献检索,目前对鱼类摄食行为影响的研究报道并不多。已有的研究涉及镉离子暴露, 对鲑(Oncorhynchus kisutch)仔鱼的嗅觉有毒性并对其行为产生影响, 对斑马鱼(Danio rerio)的嗅觉介导的行为也具有影响,以及对虹鳟(Oncorhynchus mykiss)的社会行为产生影响等等[7—9]; 锌、铜离子对鲤(Cyprinus carpio)的摄食潜伏期和食物摄取存在影响[10]。近年来还有一些研究采用生物的行为反应作为生态毒性测试和水质监测的手段和工具[11—13], 不仅敏感、快速、易于操作和廉价, 更是将在细胞水平上获得的毒性效应与在种群和群落上观察到的影响联系起来, 对生态毒理学具有重要的意义。
海洋青鳉(Oryzias melastigma), 又名黑点青鳉、印度马达卡(Indian medaka)。作为海水模式生物, 具有体型较小、性别差异明显、世代周期短、产卵率高, 鱼卵和幼体对环境中各类污染物的干预敏感, 盐度适应范围广等特性[14—16]。此外, 海洋青鳉为一种群居性鱼类, 具有体色透明易于观察、行为敏捷, 雌雄性个体之间有较明显的生理差异等特点, 深受海洋生态毒理学研究者的推崇。一般来说,不同生理特性与生活方式会影响到鱼类的摄食行为[17,18], 因此海洋青鳉也是一种研究行为学的良好实验对象。近年来以海洋青鳉为实验对象的毒理学研究结果, 主要围绕不同的胁迫条件下(包括CO2加富、重金属、生物毒素、有机污染物、新兴的持续性有机污染物等)对海洋青鳉的生长发育、生理生化、遗传毒性、神经毒性等方面的开展[19—25]。关于污染物胁迫对海洋青鳉摄食行为方面的研究尚未见报道。本文以海洋青鳉为研究对象, 探讨重金属铜和镉对其摄食行为的影响, 主要进行雌雄两性个体间以及个体与群体间的比较与分析, 探讨不同浓度铜和镉离子对海洋青鳉的摄食行为特征及摄食效率的影响, 阐明铜和镉离子对海洋青鳉的行为生态毒性, 为海洋青鳉作为生物标志物提供理论依据和参考。
1 材料与方法
1.1 实验材料
本实验在宁波大学水产养殖校内基地进行。实验用海洋青鳉来自本实验室培育。选择一批年龄为6月龄的成熟个体, 体长(3.47±0.22) cm, 体高(1.20±0.06) cm, 体宽(0.42±0.05) cm, 体重(0.84±0.13) g, 移养到 50 m×40 m×45 m的水族玻璃缸中作为试验生物。暂养条件为: 砂滤海水, 盐度(25±1)‰、温度(25±1)℃、光强2000 lx、光周期14 L∶10D、内置1个充气石充空气。在日常管理中, 青鳉饲喂颗粒饲料(高够力牌鳉鱼专用饲料), 饲料平均单粒重为0.5546 mg。定时定点定量投喂, 每天下午4点,吸污并补充水体后(更新20%)投喂饲料, 投喂量约为鱼体重10%。定期进行鱼缸的清洗, 每日检查鱼的活动情况, 确保处于良好的生存状态。
1.2 实验方法
2种重金属离子各设3个浓度梯度, 共用1个对照组。分别用硫酸铜和氯化镉(国药集团化学试剂有限公司)配制, 3个铜浓度分别为0.017、0.087和0.174 mg/L, 镉浓度分别为0.65、3.249和6.497 mg/L,每个浓度组都设3个重复, 分别放养雄鱼和雌鱼各10尾。试验容器为玻璃水族缸, 内放海水30 L。
为了确定青鳉摄食所需时间及摄食量, 在正式拍摄前先进行预实验。将经过24h饥饿处理的青鳉转移到拍摄缸内, 待鱼适应环境后(约1h), 采用 2 台摄像机分别在水平正面和垂直上面进行拍摄。通过分析录相, 测得单尾青鳉平均一次饱食量为10—12粒饲料(约6 mg), 为鱼体重的8%—10%; 并明确了适宜的拍摄时间长度为50min, 其组成为: 投饵前5min+摄食时间35min+停止摄食后10min。当青鳉有5min以上没有摄食动作时就看作已处饱食状态, 停止试验。正式拍摄前, 对各组鱼进行体重和体长的测量, 然后饥饿24h, 其他操作步骤同预实验。每组至少进行6个个体的拍摄。每组试验分别观察单一个体(分雌雄性别)以及群体(3对)的摄食行为。在观察群体时, 每条试验鱼在背鳍上用棉线做标记用于分辨不同的鱼个体, 统计群体每条鱼的信息, 记录有关数据。比较雌雄性别间以及单一个体与群体中的个体间的摄食行为异同。
1.3 数据处理
数据表述为平均数±标准差(Mean±SD), 使用SPSS22.0 软件对所得指标进行统计学分析和处理,置信区间为95%。利用sigmaplot 14.0 对实验数据进行绘图。统计分析在相同温度、盐度条件下, 雌雄性个体、单一个体与群体中的个体间的摄食响应时间、摄食量、总摄食次数等。有关海洋青鳉的摄食行为特征参数定义如下:
摄食响应时间(s): 从饲料定点投入起到实验鱼开始摄食(包括尝试摄食)第一颗饲料间的时间间隔;
摄食量(g): 为绝对摄食量, 即实验鱼在一次拍摄时间内(即一次饱食)所摄入的饲料总量。
摄食速率(粒/min): 为实验鱼摄入第4至第8粒饲料时的平均速率, 即进食稳定后平均每分钟摄入的饲料数量。
摄食成功率(%)=成功摄食次数/总摄食次数×100; 其中, 总摄食次数为实验鱼有摄食动作且口吻部触碰到饲料的次数。成功摄食次数表示实验鱼把饲料吞入口腔的次数(包括吞入后再吐出)。
摄食效率(g/min): 在一次饱食过程中, 实验鱼在单位时间内摄入的饲料量。
2 结果
2.1 铜和镉对海洋青鳉摄食响应的影响
暴露在Cu2+和Cd2+环境中, 青鳉的雌雄两性个体和群体对饵料的响应时间与对照组相比均有显著性变化(P<0.05, 图1)。
在Cu2+暴露下, 第4天时, 同一浓度组中,雄鱼摄食响应时间大于雌鱼, 而两者单个体的响应时间都比群体长; 总体上, Cu2+对雄鱼的影响大于雌鱼。在不同浓度组中, 与对照组相比, 0.017和0.087 mg/L组的三个类群所测的数据都较小(P<0.05), 且随浓度增加而进一步缩短; 而0.174 mg/L组的结果不太一样, 雌鱼的变化不大, 而雄鱼有大幅地升高, 出现了最长的摄食响应时间(13.78min); 至第15天, 同浓度组的情况与第4天类似。不同浓度组间, 0.017和0.087 mg/L组和对照组间也变化不大, 而最高浓度组中观察到青鳉在整个拍摄期间对食物全无响应。
Cd2+对海洋青鳉的摄食响应时间造成的影响与Cu2+有较大的不同。第4天时, 同一浓度组中,雌、雄鱼单个体间的结果较为接近, 而远大于群体(P<0.05)。Cd2+对雌鱼的影响较雄鱼大(数据升高更快)。在不同浓度组中, 与对照组相比, 0.65 mg/L组中雄鱼的响应时间仅略有增加, 而雌鱼却增加地非常明显(P<0.05), 而群体反而有所下降; 3.249 mg/L组中雌鱼和雄鱼对饵料的响应时间都有大幅增加,增幅高于0.65 mg/L组及对照组, 群体的变化不大;在最高浓度组(6.497 mg/L)中, 雌雄鱼对饵料已无响应; 第15天时, 在次高浓度组的雌鱼和雄鱼单个体组也出现停食。总体上, 随着Cd2+暴露时间的延长, 海洋青鳉对饵料的响应时间也在增长。

图1 不同浓度Cu2、Cd2+对青鳉摄食响应时间的影响Fig. 1 Effects of Cu2 and Cd2+ on the response time to food in male fish, female fish and different fish groups
2.2 铜和镉对海洋青鳉摄食量的影响
暴露在Cu2+和Cd2+环境中, 青鳉的雌雄两性个体和群体对饵料的摄食量与对照组相比也均有显著性变化(P<0.05, 图2)。
在Cu2+暴露下, 第4天时, 海洋青鳉雌鱼和雄鱼的单个体组和群体组的摄食量均出现先升高后降低的现象, 浓度为0.087 mg/L处理组的摄食量最大,摄食量分别为雌性个体 (103±6.5) mg, 雄性个体(101±5.7) mg, 群体 (266±8.2) mg, 且在最高浓度0.174 mg/L处下降, 但仍高于对照组的摄食量。在雌性个体、雄性个体、群体间的摄食量呈现一致的升降趋势; 暴露至第15天时, 海洋青鳉的摄食量随着浓度的递增而升高, 但在最高浓度组(0.174 mg/L)时已停止摄食。在同浓度Cu2+暴露条件下, 随着暴露时间的增加, 各浓度组海洋青鳉的摄食量均出现先上升后下降的趋势, 在暴露第4天时, 海洋青鳉的摄食量最高; 暴露浓度为0.017和0.087 mg/L下,尽管暴露第15天时海洋青鳉的摄食量有所降低, 但仍高显著高于对照组(P<0.05), 而在最高浓度组中的青鳉在整个拍摄过程中对食物全无响应。结果表明, 低浓度的Cu2+暴露能促进海洋青鳉的摄食,但浓度过高时起抑制作用。
Cd2+对海洋青鳉表现出明显的抑制作用。暴露于Cd2+后, 海洋青鳉雌雄两性个体与群体的摄食量与对照组相比均有显著性差异(P<0.05)。随着Cd2+浓度的递增, 在暴露第4天和第15天时, 海洋青鳉雌雄两性个体和群体的摄食量与对照组相比均显著降低(P<0.05)。总体上, 雌性个体的摄食量均要大于雄性个体, 而群体摄食量显著大于雌鱼、雄鱼单个体摄食量。在相同浓度Cd2+暴露条件下, 随着暴露时间的增加, 海洋青鳉的摄食量逐渐下降,在暴露第15天时达到最低。暴露浓度为0.65 mg/L组, 第15天时海洋青鳉的摄食量分别降至雌性个体(1.66±0.67) mg、雄性个体(1.11±0.44) mg, 群体(51.58±7.71) mg; 在中高浓度组, 随着Cd2+暴露时间的增加, 雌鱼、雄鱼单个体出现停食, 而群体的摄食量也进一步下降。这表明, 海洋青鳉的摄食量受Cd2+的浓度和暴露时间影响显著(P<0.05)。结果表明, 海洋青鳉对Cd2+较敏感, 低浓度的Cd2+即能抑制对海洋青鳉的摄食行为, 使其摄食量降低, 而长期的暴露也起到明显的抑制作用。
2.3 铜和镉对海洋青鳉摄食成功率的影响
暴露在Cu2+和Cd2+环境中, 青鳉的雌雄两性个体和群体对饵料的摄食量与对照组相比也均有显著性变化(P<0.05, 图3)。
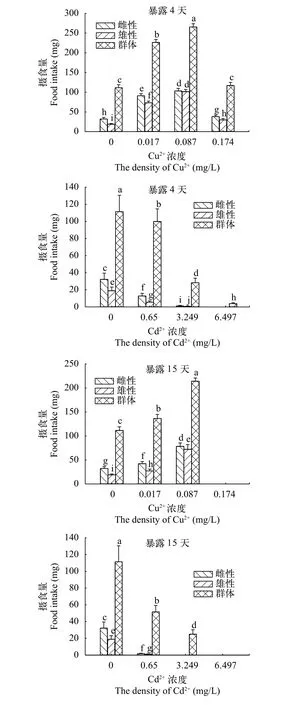
图2 不同浓度Cu2+、Cd2+对海洋青鳉摄食量的影响Fig. 2 Effects of Cu2+ and Cd2+ on food intake in male fish,female fish and different fish groups

图3 不同浓度Cu2+、Cd2+对海洋青鳉摄食成功率的影响Fig. 3 Effects of Cu2+ and Cd2+ on the feeding success rate in male fish, female fish and different fish groups
在Cu2+暴露下, 第4天时, 海洋青鳉雌雄两性个体和群体的摄食成功率均出现先升高后降低的现象, 浓度为0.017 mg/L处理组的摄食成功率最高, 摄食成功率雌性为(39.44±5.8)%, 雄性为 (37.21±7.12)%,群体为 (47.25±9.7)%; 在暴露第15天时, 海洋青鳉的摄食成功率随着Cu2+浓度的升高而显著降低(P<0.05), 当Cu2+浓度为0.174 mg/L时, 在整个拍摄过程中, 海洋青鳉雌雄两性个体和群体均已无摄食行为。在同一浓度Cu2+暴露下, 中高浓度组海洋青鳉的摄食成功率均随暴露时间的增加而降低, 且与对照组相比均有显著性差异(P<0.05)。在Cu2+暴露下, 雌鱼个体的摄食成功率高于雄鱼个体, 群体的摄食成功率高于雌鱼、雄鱼单个体。雌雄两性个体与群体的摄食成功率随暴露时间的增加变化趋势一致, 且差异性显著(P<0.05)。结果表明, 尽管短期低浓度的Cu2+对海洋青鳉的摄食成功率具有提升作用, 但是长期的暴露或者高浓度的Cu2+暴露下对海洋青鳉的摄食成功率是具有抑制作用的。
Cd2+对海洋青鳉表现出明显的毒性作用。暴露于Cd2+后, 海洋青鳉雌雄两性个体与群体的摄食成功率与对照组相比均有显著性差异(P<0.05)。随着Cd2+浓度的递增, 在暴露第4和第15天时, 海洋青鳉雌雄两性个体和群体的摄食成功率与对照组相比均显著降低(P<0.05)。总体上, 雌性个体的摄食成功率均要高于雄性个体, 而群体摄食成功率显著高于雌鱼、雄鱼单个体摄食量。在相同浓度Cd2+暴露条件下, 随着暴露时间的增加, 海洋青鳉的摄食成功率均逐渐下降, 在暴露第15天时达到最低;在3.249 mg/L组, 随着Cd2+暴露时间的增加, 雌鱼、雄鱼单个体出现停食, 而群体的摄食量也进一步下降; 而在最高浓度组中的海洋青鳉在拍摄全程中对食物全无响应。结果表明, Cd2+的浓度增加或暴露时间增长对海洋青鳉的摄食成功率具有抑制作用。

图4 不同浓度Cu2+、Cd2+对海洋青鳉摄食效率的影响Fig. 4 Effects of Cu2+ and Cd2+ on feeding efficiency in male fish,female fish and different fish groups
2.4 铜和镉对海洋青鳉摄食效率的影响
暴露在Cu2+和Cd2+环境中, 青鳉的雌雄两性个体和群体对饵料的摄食量与对照组相比也均有显著性变化(P<0.05, 图4)。
在Cu2+暴露下, 第4天时, 海洋青鳉雌雄两性个体和群体的摄食效率均随着Cu2+浓度的递增而出现先升高后降低的趋势, 浓度为0.017 mg/L处理组的摄食效率最高, 海洋青鳉的摄食效率最高, 分别为雌性的 (1.24±0.15) mg/min, 雄性的 (1.18±0.1) mg/min和群体的 (1.32±0.14) mg/min; 在最高浓度组时,雄鱼单个体的摄食效率相比于雌鱼单个体下降更快, 表明在高浓度的Cu2+对雄鱼的摄食效率影响更大; 在暴露第15天时, 海洋青鳉的摄食效率随着Cu2+浓度的升高而显著降低(P<0.05), 当Cu2+浓度为0.174 mg/L时, 在整个拍摄过程中, 海洋青鳉雌雄两性个体和群体均已无摄食行为。在同一浓度Cu2+暴露下, 中高浓度组海洋青鳉的摄食效率均随暴露时间的增加而降低, 且与对照组相比均有显著性差异(P<0.05)。在Cu2+暴露下, 雌鱼个体的摄食效率大于雄鱼个体, 群体的摄食效率大于雌鱼、雄鱼单个体。雌雄两性个体与群体的摄食效率随暴露时间的增加变化趋势一致, 且差异性显著(P<0.05)。结果表明, 尽管短期低浓度的Cu2+对海洋青鳉的摄食效率具有促进作用, 但是长期的暴露或者高浓度的Cu2+暴露下对海洋青鳉的摄食效率是具有抑制作用的。
Cd2+对海洋青鳉的摄食表现出明显的抑制作用。暴露于Cd2+后, 海洋青鳉雌雄两性个体与群体的摄食效率与对照组相比均有显著性差异(P<0.05)。随着Cd2+浓度的递增, 在暴露第4和第15天时, 海洋青鳉雌雄两性个体和群体的摄食效率与对照组相比均显著降低(P<0.05)。在第4和第15天时, 同一浓度组中, 雌、雄鱼间的摄食效率较为接近, 且均显著低于群体(P<0.05), 表明Cd2+对海洋青鳉摄食效率的影响无明显的性别差异。在相同浓度的Cd2+下, 随着暴露时间的增加, 海洋青鳉雌雄两性个体与群体的摄食效率均显著降低(P<0.05)。海洋青鳉雌雄两性个体与群体的摄食效率随着暴露时间的增加变化趋势一致, 且差异性显著(P<0.05)。在中高浓度组时, 海洋青鳉随着暴露时间的延长而摄食效率持续降低, 直至出现停食现象(摄食效率降至0)。结果表明, Cd2+浓度的增加或暴露时间的延长对海洋青鳉的摄食效率均有抑制作用。
3 讨论
水生动物由于其生活环境的特殊性, 其自身与水充分接触, 极易受到外界环境的影响。水生生物适应外界环境的变化首要体现在其行为反应上, 运动或摄食的改变是一种主动的趋利避害的方式, 并通过行为调节机制以保持生物体内生理环境的稳定。因此, 以生物行为状态的强弱变化为指标, 可以作为水质环境变化的监测手段[13]。
3.1 Cu2+对海洋青鳉的摄食行为的影响
在重金属暴毒时, 海洋青鳉表现出明显的摄食行为变化, 其摄食情况与暴露浓度、暴露时间呈明显的相关性, 这结果与海洋青鳉在毒物条件下调整和适应能力密切相关。相似的结果也在其他鱼中观察到: 柴敏娟等[26]报道 Cu2+对金鱼摄食行为有抑制作用, 在Cu2+的最低浓度为0.1 mg/L, 随着浓度的升高对摄食行为的抑制就越强; 在低浓度Cu2+条件下, 鲤的摄食反应速度大大降低, 随着浓度的升高会增加它们的摄食反应时间, 甚至出现停食[10]。本研究也得到相似的结论, 此外, 我们在实验中还发现, Cu离子浓度在低于0.1 mg/L时对摄食有促进作用。作者认为, 在低浓度Cu2+胁迫下, 海洋青鳉在低浓度Cu2+胁迫下对食物的响应时间缩短以及摄食量的增加, 可能有与Cu2+本身具有杀菌作用有关,因此海洋青鳉能更好地适应此环境; 而过高的Cu2+浓度以及长时间的胁迫, 超过了海洋青鳉正常的生理变化范围而产生了抑制作用, 以至于出现行动缓慢、摄食量减少、甚至对食物无响应的现象。另外, 在不同浓度Cu2+暴露下海洋青鳉雌性个体的摄食量以及摄食速度要大于雄性个体, 雌性个体对重金属的耐受性要强于雄性个体。因此, 青鳉摄食行为的变化既受环境污染物浓度的影响, 又与污染物暴露时间相关, 还与其自身的性别相关。
3.2 Cd2+对海洋青鳉的摄食行为的影响
有研究发现, Cd2+作为一种嗅觉毒物, 在0.002 mg/L浓度下即可削弱虹鳟的行为反应[9]。Kevin等[8]在研究Cd2+、Zn2+对斑马鱼稚鱼嗅觉介导的神经行为影响时, 也证实了Cd2+降低了斑马鱼稚鱼的嗅觉敏感性。嗅觉是鱼类对食物响应的重要感觉器官之一, 嗅觉损伤不仅可直接影响鱼类对食物的响应,也影响鱼类归巢、求偶和繁等行为[27—29]。本研究结果也表明, 在镉暴毒下, 海洋青鳉表现出明显的摄食行为变化, 其摄食情况与镉的暴露浓度呈明显的浓度剂量效应。在各浓度实验组中, 在第4天时海洋青鳉对食物的响应时间就都大于对照组, 有可能此时海洋青鳉的嗅觉功能已经受损, 因此造成了海洋青鳉摄食成功率和摄食效率大大降低。而在15d的Cd2+长期胁迫下, 随氯化镉浓度升高, 海洋青鳉群体的摄食量逐渐下降, 在3.249和6.497 mg/L浓度下, 雌雄性个体均未摄食, 已无行为表现。这表明在长时间、中高浓度Cd2+胁迫下海洋青鳉的嗅觉以及其他生理功能严重受损而无法进食。这与乔波等[30]研究者报道的微量重金属对摄食行为的影响所表现出的抑制作用相吻合。
3.3 差异性响应
关于研究结果中, 不同性别之间、个体与群体之间出现的摄食行为上的差异, 在雌、雄性个体之间对于重金属的响应基本呈现一致升降, 且雌性个体的摄食量、摄食响应速度均要大于雄性个体, 这可能与海洋青鳉自身的生理特性有关[17,18], 在繁殖期间, 雌性个体需要更多的能量用于性腺的成熟以及恶劣环境下确保更多的卵子数量。而群体相对于个体更短的食物响应时间, 与鱼类的集群行为中的模仿和竞争有关[31,32], 因此往往群体的摄食量也强于单体的摄食水平, 与本研究的结果一致。在重金属铜暴露下, 个体与群体摄食行为变化基本一致;在重金属镉暴露下, 个体与群体出现明显差异。
本研究利用重金属胁迫开展海洋青鳉摄食行为的变化分析, 可分析研究环境胁迫对生物摄食行为的响应机制, 可开发和建立水质连续的生物监测体系, 结合经典生态毒理学分析, 将个体水平上获得的毒性效应与在种群和群落上观察到的影响联系起来, 得到更加丰富的理论数据, 对生态毒理学具有重要的意义。同时, 也可通过对海洋青鳉摄食行为的观察分析, 对其长期的封闭和半封闭的人工养殖提供生产指导, 具有重要的现实意义。

