LPA/LPA1信号通路与糖尿病肾脏疾病
袁紫东 王秋月
中国医科大学附属第一医院内分泌与代谢病科,沈阳 110001
糖尿病肾脏疾病(DKD)的发病机制复杂,涉及多种细胞、分子途径,多种因素共同作用。目前认为,与DKD发病相关的因素包括血流动力学改变、高血糖、晚期糖基化终末产物(AGEs)、蛋白激酶C(PKC)途径、多元醇途径、氧化应激、炎性反应、过氧化物酶体增殖物活化受体γ(PPARγ)活化等诸多方面[1-2]。
溶血磷脂酸(LPA)是一种小分子生物活性甘油磷脂,其通过至少6种G蛋白耦联受体(GPCRs),即 LPA1-6,调节不同的细胞效应。LPA/LPA1信号通路可能在系膜细胞增殖、纤维化、足细胞损伤、炎性反应及氧化应激等环节发挥作用,进而促进DKD的疾病进展,而抑制LPA1可以减轻肾脏损伤。笔者认为,LPA/LPA1信号通路可能为研究DKD的发病机制提供新思路,成为治疗DKD的新靶点。因此,通过查阅文献,本文就LPA/LPA1信号通路与DKD发病机制研究新进展进行综述。
1 LPA/LPA1信号通路概述
LPA的相对分子质量为430 000~480 000,具有一条脂肪酸链和一个磷酸基团作为其极性头端。LPA是甘油脂质从头合成的关键代谢中间体,而且是质膜的组成成分[3]。20世纪60年代初期,Vogt等发现LPA诱导了离体兔十二指肠的收缩。从那时起,大量研究发现LPA具有生物活性,可以调节多种细胞效应,诱导多种细胞过程,包括平滑肌细胞收缩、血小板聚集、细胞增殖、细胞迁移、细胞转化、预防细胞凋亡、减少细胞因子和趋化因子分泌等[3-5]。
LPA通过至少6种7次跨膜GPCRs介导的细胞外信号转导,发挥功能作用,这些LPA受体被命名为LPA1-6:蛋白质名称LPA1~LPA6,基因名称LPAR1~LPAR6(人类)和Lpar1~Lpar6(非人类)。其中,LPA1~LPA3(也分别称为vzg-1/Edg2、Edg4、Edg7)是内皮细胞分化基因(endothelial cell differentiation gene, Edg)家族的成员;LPA4(P2Y9/GPR23)、LPA5(GPR92/93)和LPA6(P2Y5)属于嘌呤能受体(P2Y)家族[3]。这些GPCRs与4种Gα蛋白(G12/13、Gq/11、Gi/o和Gs)中的一种或多种耦联,引发多种信号级联,下游信号级联涉及诸多介质,如Ras、Rho、Rac、蛋白激酶B、丝裂原活化蛋白激酶(MAPK)、PKC和腺苷酸环化酶[4]。
1996年,LPA1成为第一个被确认的溶血磷脂受体,是6种LPA受体中研究最为广泛的。哺乳动物LPAR1基因编码含有364个氨基酸具有7-TM结构域的相对分子质量为41 000的蛋白质。在小鼠和人类中,LPA1在心脏、脑、胎盘、骨骼肌、肾脏、胰腺、脾脏、前列腺、睾丸、卵巢、小肠和结肠中广泛表达[6]。研究发现,Lpar1-/-小鼠显示出50%的围产期致死率、存活者体型缩小、颅面畸形和坐骨神经施万细胞凋亡增加,提示LPA/LPA1信号通路在胚胎发育过程中的重要作用[7]。近年来,大量研究发现LPA/LPA1信号转导的异常可能介导一系列病理过程,如神经及精神系统疾病、疼痛、心血管疾病、纤维化、骨骼疾病、癌症、不育和肥胖等[5-6]。
2 LPA/LPA1信号通路与DKD的相关机制
2.1 LPA/LPA1信号通路与系膜细胞增殖 肾小球系膜细胞是肾脏固有细胞的主要类型之一,参与DKD的发病过程。DKD早期的病理改变是系膜细胞增殖,随后,细胞的生长停滞,细胞发生肥大。因此,系膜细胞增殖是早期DKD病理生理机制的关键因素,最终导致慢性肾功能不全[8-9]。各种致病因素,包括高血糖、血脂异常、高血压、AGEs、某些细胞因子(如转化生长因子β)均可诱导肾小球系膜细胞过度增殖和(或)肥大,从而导致细胞外基质蛋白(ECM)的聚积和肾小球基底膜(GBM)增厚[9]。因此,抑制系膜细胞增殖是早期控制DKD进展的方法之一。
LPA诱导不同类型细胞的增殖,包括系膜细胞,而人们对LPA在系膜细胞增殖方面涉及的分子机制知之甚少。Kim等[8]通过动物模型和体外实验研究发现,LPA通过细胞周期调节蛋白刺激肾小球系膜(SV40 MES13)细胞的增殖。Krüppel样因子5(KLF5)的表达在db/db小鼠的肾皮质和LPA处理的SV40 MES13细胞中上调。通过siRNA转染下调KLF5的表达则抑制了LPA诱导的SV40 MES13细胞增殖。在LPA处理的SV40 MES13细胞和db/db小鼠的肾皮质中,MAPK被激活,随后早期生长反应因子1(Egr1)的表达增加。另外,LPA显著增加SV40 MES13细胞中Ras相关C3肉毒杆菌毒素底物(Rac1)GTP酶的活性,LPA诱导的过度增殖通过抑制Rac1活性而减弱。基于这些结果,可得出结论,Rac1/MAPK/KLF5信号通路是LPA在DKD模型中诱导系膜细胞增殖的机制之一。该研究并未讨论LPA1的表达水平以及LPA1与Rac1/MAPK/KLF5信号通路的作用关系。曾有研究发现,在肿瘤细胞中,Rac1激活由LPA1信号通路介导[10]。因此,推测在系膜细胞中,LPA诱导的Rac1活化由LPA1介导。未来关于LPA/LPA1信号通路促进系膜细胞增殖及其分子机制方面应进行进一步实验研究。
2.2 LPA/LPA1信号通路与足细胞损伤 足细胞、内皮细胞和GBM构成肾小球滤过屏障。在DKD早期即观察到足细胞结构及功能异常。足细胞的修复和(或)再生能力有限,是高度分化的终末细胞,足细胞损伤将导致蛋白尿和进行性肾小球硬化,足细胞损伤的程度是DKD的主要预后决定因素之一[11-12]。内皮型一氧化氮合酶基因敲除(eNOS-/-)db/db小鼠模型为加速型DKD模型,其具有与人类DKD相似的进行性肾病的独特特征,包括早期明显的蛋白尿、系膜溶解、小动脉玻璃样变性、局灶节段性肾小球硬化和结节性肾小球硬化以及中度高血压。在eNOS-/-db/db小鼠8周龄时即可观察到足细胞损伤的超微结构证据,如空泡聚积、假性囊肿、足突消失和胞浆内电子致密液滴[5,13]。Zhang等[5]研究发现,在非糖尿病小鼠中,LPA1和LPA3主要在肾小管上皮细胞中表达,在肾小球中极少表达。然而,在eNOS-/-db/db小鼠的肾小球中,LPA1和LPA3表达均增加。用nephrin(足细胞标志物)进行双重免疫荧光染色表明,肾小球中LPA1和LPA3的表达增加主要发生在足细胞,但也存在于其他肾小球细胞类型。而通过BMS002(LPA1/LPA3拮抗剂)处理,可明显减轻小鼠足细胞损伤。因此,推测LPA/LPA1可能参与介导足细胞损伤而在DKD进展中发挥作用,但由于相关报道有限,仍需进一步探讨其具体机制。
2.3 LPA/LPA1信号通路与纤维化 纤维化可被看作是一个不受控制的愈合过程,其导致ECM的过度聚积。各种刺激(感染、自身免疫反应、机械损伤等)可导致组织损伤,从而产生修复过程替换受损细胞。在慢性组织损伤中,促纤维化介质持续产生会导致不受控制的愈合过程,与过度ECM重塑相关的结缔组织替代受损细胞,最终导致瘢痕形成[14]。
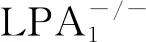
2.4 LPA/LPA1信号通路与炎性反应、氧化应激 慢性低度炎性反应和免疫反应在DKD发病机制中起着至关重要的作用。据报道,DKD患者的肾脏组织中存在炎性细胞浸润以及细胞黏附分子、趋化因子和促炎细胞因子的表达增加[19]。此外,氧化应激在DKD的发生和发展中也起重要作用。过度的氧化应激激活多种细胞内信号通路,刺激转录因子,从而导致ECM沉积增加,基质降解减少,最终导致肾小球硬化和肾脏纤维化[20]。Toll样受体(TLRs)是一类模式识别受体,介导炎性反应和免疫反应,TLR4通常由免疫细胞中的脂多糖或非免疫细胞中的内源性配体(如热休克蛋白)激活。核因子-κB是TLR4信号通路的下游效应蛋白,是一种核转录因子,可介导多种炎性反应过程[21-22]。据报道,TLR4/核因子-κB信号通路与糖尿病和DKD的进展有关[23]。活性氧簇是氧化应激的关键物质,NADPH氧化酶是在各种病理条件下产生活性氧簇的重要酶促来源,而研究发现,TLR4也可以激活NADPH氧化酶,从而导致活性氧簇产生[20,24]。Lee等[25]研究发现,在SV40 MES13细胞以及糖尿病小鼠肾脏中,LPA处理增加了TLR4和NADPH氧化酶的表达,进而增加活性氧簇的产生。LPA诱导的炎性反应因子和纤维化因子的表达由TLR4和NADPH氧化酶介导。在链脲佐菌素诱导的糖尿病小鼠肾脏中,LPA1的表达与氧化应激呈正相关。而特异性LPA1拮抗剂AM095,通过抑制TLR4/核因子-κB和NADPH氧化酶系统,从而抑制糖尿病小鼠肾脏组织炎性反应信号级联反应,有效预防DKD的发病,提示LPA1拮抗剂可能为DKD潜在的治疗靶点。目前关于LPA/LPA1在DKD炎性反应与氧化应激方面的报道有限,未来有待更全面的研究。
3 LPA/LPA1信号通路与DKD在临床方面的进展
在临床研究方面,Shimizu等[26]通过回顾性、单中心队列研究发现,2型糖尿病合并DKD患者的血清ATX(一种产生LPA的酶)水平与蛋白尿和DKD有关。而Saulnier-Blache等[27]发现,DKD患者尿液中LPA含量增加,说明其参与人类DKD的发生。Michalczyk等[17]研究发现,慢性肾脏疾病患者中,进行保守治疗、腹膜透析以及接受肾移植患者的血浆LPA水平与健康志愿者相比明显升高,证实慢性肾脏疾病与血浆LPA水平升高有关。然而,在DKD中尚未查阅到关于血液LPA水平的定量信息。
4 结语
LPA/LPA1信号通路可能通过调节系膜细胞增殖、纤维化、足细胞损伤、炎性反应及氧化应激等过程参与DKD的进展。尽管LPA/LPA1通路在DKD发病的具体分子机制有待深入研究,LPA/LPA1通路对于进一步理解DKD的发病机制具有重要意义,它可能成为DKD治疗的新靶点。

