介入栓塞与开颅夹闭治疗脉络膜前动脉瘤的效果比较及预后影响因素分析
祝 斐,刘建武,陈志华,宋书欣,朱健明
(1.中国人民解放军庐山康复疗养中心神经外科,江西 九江 332000;2.南昌大学第二附属医院神经外科,南昌 330006)
脉络膜前动脉动脉瘤来自脉络膜前动脉起始部(包括脉络膜前动脉)到颈内动脉分叉处,在颅内动脉瘤中约占2%~5%[1]。治疗上主要有介入栓塞和开颅夹闭,但由于脉络膜前动脉供血区域的重要性及缺乏其他分支代偿,介入栓塞及开颅夹闭均可能造成严重并发症。本研究对南昌大学第二附属医院2014年1月至2019年1月收治的行血管内介入栓塞或开颅夹闭治疗的98例脉络膜前动脉动脉瘤患者的临床资料进行回顾性分析,比较2种手术方法的治疗效果及并发症,分析影响脉络膜前动脉动脉瘤预后的相关因素。
1 资料与方法
1.1 一般资料
98例脉络膜前动脉动脉瘤患者,男29例(29.6%),女69例(70.4%);年龄31~77岁,平均(52.8±9.7)岁;破裂动脉瘤72例(73.5%),微小动脉瘤(直径≤3 mm)31例(31.6%),宽颈动脉瘤39例(39.8%);动脉瘤累及脉络膜前动脉88例(89.8%)。其中采用血管内介入栓塞治疗72例(A组),采用开颅夹闭治疗26例(B组)。
1.2 纳入标准和排除标准
纳入标准:1)CTA或DSA确诊脉络膜前动脉动脉瘤;2)接受介入栓塞或开颅夹闭治疗。排除标准:1)治疗后复发动脉瘤;2)合并其他位置动脉瘤并同时治疗;3)合并脑血管畸形或烟雾病;4)Hunt-Hess评分Ⅳ、Ⅴ级;5)不能耐受手术。
1.3 治疗方法
所有患者术前均行颅脑CTA或DSA,评估动脉瘤大小、瘤颈情况、动脉瘤和脉络膜前动脉关系等,结合患者或家属意愿,选择血管内介入栓塞或开颅夹闭治疗。1)血管内介入栓塞治疗:取仰卧位,全身麻醉后消毒铺巾,Seldinger技术穿刺股动脉,置入6F鞘,6F导引导管在泥鳅导丝引导下,置入同侧颈内动脉末端,微导管尖端塑形后微导丝引导下到位动脉瘤腔,选择合适弹簧圈成蓝,继续填入合适弹簧圈,对于需要支架辅助栓塞的动脉瘤,填入适量弹簧圈后选择合适支架,半释放支架,继续放入合适弹簧圈后完全释放支架,造影栓塞满意,结束手术。2)开颅夹闭治疗:取仰卧位,全身麻醉后,Mayfield头架固定,常规消毒铺巾,采用改良翼点入路,逐层切开头皮,分离颞肌脂肪垫,翻开皮肌瓣,铣开骨瓣,咬除蝶骨脊、悬吊硬膜,剪开硬膜后显微镜下打开颈动脉池、外侧裂、视交叉池,显露后交通动脉、脉络膜前动脉、A1、M1,分离暴露动脉瘤,临时阻断下夹闭动脉瘤,夹闭满意,松开临时阻断,术区彻底止血,间断缝合硬膜,放置引流,骨瓣回纳,逐层关颅,结束手术。所有患者术后6个月行颅脑DSA复查。
1.4 随访及评估指标
术后6个月行脑血管造影复查,采用改良RanKin量表(mRS)评价预后:预后良好(mRS≤2级),预后不良(mRS>2级);Raymond分级评价动脉瘤闭塞情况:Raymond分级1级为完全闭塞。观察术后缺血并发症发生情况。
1.5 统计学方法
2 结果
2.1 一般资料比较
A组72例,男20例(27.8%),女52例(72.2%);平均年龄(53.83±9.66)岁;微小动脉瘤24例(33.3%),宽颈动脉瘤28例(38.9%),破裂动脉瘤52例(72.2%);动脉瘤累及脉络膜前动脉64例(88.9%)。B组26例,男9例(34.6%),女17例(65.4%);平均年龄(49.92±9.39)岁;微小动脉瘤7例(26.9%),宽颈动脉瘤11例(42.3%),破裂动脉瘤20例(76.9%);动脉瘤累及脉络膜前动脉24例(92.3%)。2组患者的性别、年龄及动脉瘤特征等一般资料比较差异无统计学意义(P>0.05)。
2.2 预后比较
所有患者均顺利完成手术,无再次治疗病例。A组预后良好66例(91.7%)、动脉瘤完全闭塞65例(90.3%)、术后发生缺血并发症10例(13.9%),B组分别为23例(88.5%)、25例(96.2%)、5例(19.2%),2组预后良好率、动脉瘤完全闭塞率、术后缺血并发症发生率比较差异均无统计学意义(均P>0.05)。
2.3 脉络膜前动脉动脉瘤预后影响因素
单因素分析显示,动脉瘤大小是影响脉络膜前动脉动脉瘤预后的因素,见表1。
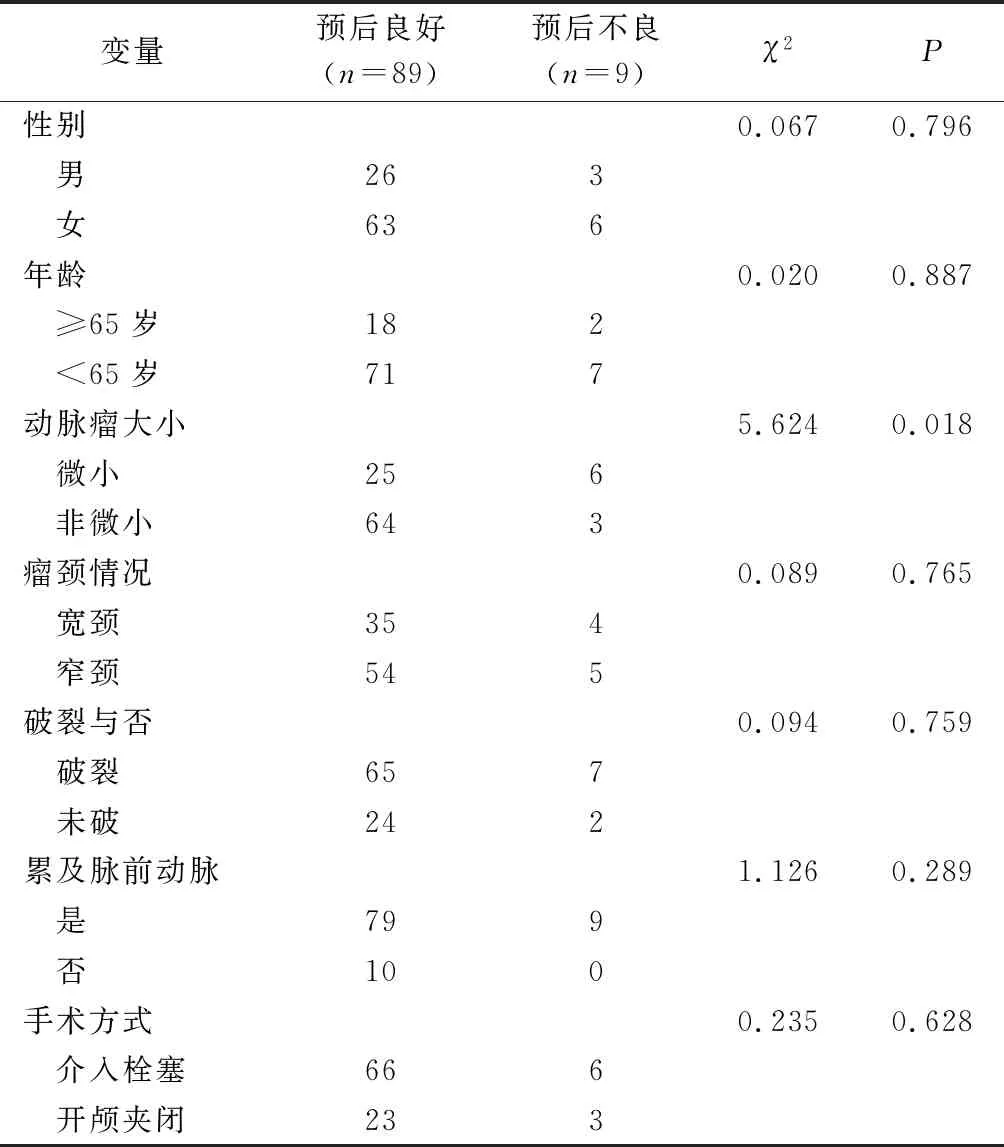
表1 脉络膜前动脉动脉瘤预后影响因素的单因素分析 例
3 讨论
脉络膜前动脉瘤临床上少见,其破裂率为26.7%[2],临床上初步诊断主要依靠CTA,部分脉络膜前动脉在CTA上显影不佳,而且部分动脉瘤直径较小,CTA漏诊、误诊也比较常见。大多数脉络膜动脉瘤起自脉络膜前动脉与颈内动脉交界处[3],微小动脉瘤、宽颈动脉瘤也多见;脉络膜前动脉与后交通动脉距离1.5~9.0 mm,到颈内动脉分叉处距离2.5~10 mm[4],脉络膜前动脉管径细,其平均管径为0.75~1.20 mm[5],供血内囊、视束等重要部位,易发生严重并发症。目前,血管内介入栓塞和开颅夹闭治疗是主要治疗方法,但对于首选哪种治疗方法并无统一意见。
血管内介入栓塞和开颅夹闭治疗对于大部分脉络膜前动脉动脉瘤均适用,开颅动脉瘤夹闭能直接观察动脉瘤与颈内动脉、脉络膜前动脉的解剖关系,能较好地保护载瘤动脉及其分支血管,但部分动脉瘤显微镜下暴露不佳,夹闭也可能存在瘤颈残留或造成脉络膜前动脉狭窄;分离动脉瘤过程可能造成周围组织损伤甚至动脉瘤破裂,手术过程中的牵拉造成周围组织水肿,临时阻断和血管痉挛也可发生缺血并发症,同时也存在颅内感染可能。介入栓塞治疗血管内操作,创伤小,对部分不能耐受开颅手术患者也适用,能多角度观察动脉瘤与颈内动脉、脉络膜前动脉关系,对于宽颈动脉瘤需要支架联合弹簧圈治疗,介入材料的使用可能造成血栓形成,栓子形成及血管痉挛同样可以引起缺血并发症。大多数学者认为,手术夹闭治疗完全夹闭率高,不易复发,但有较高并发症,恢复时间长,介入栓塞创伤小、恢复快,但费用高,复发率高[6]。
本研究纳入98例脉络膜前动脉瘤患者,A组(介入栓塞)72例,其中支架辅助弹簧圈栓塞32例(32.7%),单纯弹簧圈栓塞40例(40.8%);B组(开颅夹闭)26例(26.5%),无死亡、再治疗病例,2组术后缺血并发症发生率比较差异无统计学意义,术后6个月随访2组预后良好率及完全闭塞率比较差异亦无统计学意义。98例患者术后均无再出血,26例夹闭患者均无明确颅内感染,但2组患者缺血并发症发生率高,占15.3%,高于本中心同期动脉瘤治疗后总体缺血并发症发生率,其中部分患者症状可基本恢复,考虑血管痉挛,脉络膜前动脉综合征发生率略低于HELGASON等[7]报道的8.7%,6个月后随访预后不良率9.2%。单因素分析显示,动脉瘤大小是影响预后的因素。微小动脉瘤瘤体小、瘤壁薄、宽颈也多见,动脉瘤分离或夹闭过程中容易破裂出血,夹闭也容易发生缺血并发症[8];微小动脉瘤介入栓塞过程中发生破裂出血的概率、致残率、致死率也高于其他动脉瘤[9-11]。9例预后不良患者动脉瘤均累及脉络膜前动脉,动脉瘤位置也可能影响预后,累及脉络膜前动脉的动脉瘤治疗过程中更大概率造成脉络膜前动脉狭窄或血管痉挛,此外此类动脉瘤治疗上也更具难度,但两者差异无统计学意义(P>0.05),考虑样本量小,存在偏倚。此外,动脉瘤的初诊大部分依靠CTA,CTA部分上动脉瘤与颈内动脉、脉络膜前动脉解剖关系显示不清,评估不充分也可能影响预后。对于CTA显影不佳的脉络膜前动脉动脉瘤建议进一步行脑血管造影,精确评估动脉瘤与脉络膜前动脉关系及朝向,预计动脉瘤暴露困难的建议行栓塞治疗,术前充分评估及个性化治疗可能降低并发症及提高预后良好率。
本研究为单中心、非随机对照研究,存在一定偏倚,远期动脉瘤复发率仍需长期随访。血管内介入栓塞和开颅夹闭均对脉络膜前动脉动脉瘤均有满意疗效,术前充分评估、个性化治疗对于提高预后良好率有重要意义。

