土壤邻苯二甲酸二丁酯对白菜生长和抗氧化酶系统的影响
徐文君 程江峰


摘要:随着工业的快速发展,邻苯二甲酸酯(PAEs)作为增塑剂被大量使用,导致严重的环境污染,危害人体健康,邻苯二甲酸二丁酯(DBP)是PAEs中的重要成员,在土壤中富集的DBP极易被植株吸收而影响农作物的生长。向土壤中人为添加DBP,并移栽上海青(Brassica rapa L.)幼苗,培养21 d后发现,植株根部及茎叶部分均被检出有DBP存在,其中根部含量较高;与对照组相比,植株生长指标中的根长、生物量因受DBP胁迫而显著减小,叶绿素含量无显著性差异。植物抗氧化系统同样受到影响,与对照组相比,H2O2含量、POD活性、CAT活性显著升高,SOD活性以及MDA含量則无显著性差异。由此说明,DBP胁迫下植株的生长状况及抗氧化酶系统明显被影响。
关键词:邻苯二甲酸酯(PAEs);邻苯二甲酸二丁酯(DBP);生物量;叶绿素含量;抗氧化酶系统;白菜
中图分类号: S634.301;Q945.78文献标志码: A
文章编号:1002-1302(2020)07-0142-05
邻苯二甲酸酯(PAEs)是一类用处广泛的有机化合物,常温情况下为无色黏稠态液体,微溶于水,不易挥发,熔沸点低,具有良好的黏着性、稳定性、增加塑料柔韧与可塑性等特点[1],因此以增塑剂的作用在塑料生产中被大量使用[2],此外也被用于化妆品、胶水、洗车内饰、家具、农药、香料、保鲜膜等塑料制品中[3-4]。但由于人们对PAEs的大规模利用,目前已经在大气尘埃、工业废水、河流湖泊、土壤、动植物甚至人体中被普遍检出[5]。它不但具有生殖毒性,还有致癌、致畸、致突变的危害[6-7],目前被美国环保局(EPA)列入129种重点控制污染物名单,也被欧盟委员会和中国环境监测总站列为优先监测污染物[8-10]。
研究发现,我国土壤中PAEs的含量基本在mg/kg 至g/kg数量级[11]。土壤中PAEs的主要来源是农田塑料薄膜、垃圾以及污水灌溉[12-13],其含量与所处地域有极大的关系,越靠近工业区,PAEs的含量越高,其中以邻苯二甲酸二丁酯(DBP)以及邻苯二甲酸二(2-乙基己基)酯(DEHP)的检出率最高[14],这是因为塑料膜的原材料中有大量的PAEs,由于PAEs与聚氯乙烯(PVC)树脂间并不是以共价键这种稳定的方式连接,而是通过范德华力或氢键等不稳定方式连接,所以随时间推移塑料膜中的PAEs被大量释放到土壤及环境中[15],而富集在土壤中的PAEs最终会被作物吸收进入植株体内,进而通过食物链进入动物及人体内[16],严重破坏生态环境,危害人体健康。因此,针对土壤PAEs的污染现状,选择合适的代表污染物以及作物,通过检测分析污染物对作物的胁迫影响显得尤为重要。
本试验选择PAEs中的重要成员DBP为主要研究污染物,叶菜类蔬菜上海青(Brassica rapa L.)为研究作物,向土壤中人为添加高浓度DBP制成污染土,移栽上海青,培养21 d后研究植株的根长、生物量、叶绿素含量、丙二醛(MDA)含量、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、过氧化氢(H2O2)含量、过氧化氢酶(CAT)活性,并利用高效液相色谱(HPLC)检测DBP污染土壤中栽培的上海青茎叶部分、根部以及土壤中的DBP含量,以期能够从一定程度上明确DBP对植株的胁迫影响,为塑化剂污染土地的作物栽培及防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试植株及土壤 以采自江苏省农业科学院试验田的土样为试验土壤,购自南京绿领种业有限公司的上海青种子为供试作物种子。
1.1.2 主要试剂 邻苯二甲酸二丁酯(DBP)(上海安普实验科技股份有限公司,含量>98.5%);色谱纯乙腈、分析纯丙酮(德国Merck KGaA公司);氯化钠(NaCl,上海久亿化学试剂有限公司);无水硫酸镁(MgSO4,成都市科隆化学品有限公司);N-丙基乙二胺(PSA)、石墨化炭黑(GCB)(天津博纳艾杰尔科技有限公司)。将DBP标准品溶解于丙酮溶液中,使用前在-20 ℃下封闭存储。
1.1.3 仪器设备 WH-3微型漩涡混合仪(上海沪西分析仪器厂有限公司);Centrifuge 5804R型离心机(EPPENDORF公司);JJ223BC型电子天平(常熟市双杰测试仪器厂);Agilent Technologies 1200高效液相色谱仪(美国安捷伦科技公司);SPAD502叶绿素含量测定仪、KQ-600E型超声波清洗器(昆山市超声仪器有限公司);IKA型组织匀浆机(广州仪科实验室技术有限公司);T18基本型高速分散机(德国IKA仪器设备有限公司)。
1.1.4 试剂盒 南京建成科技有限公司总蛋白定量测定试剂盒(比色法);南京建成科技有限公司过氧化氢含量测定试剂盒(比色法);南京建成科技有限公司过氧化氢酶活性测定试剂盒(可见光法);南京建成科技有限公司过氧化物酶活性测定试剂盒(测植物)(比色法);南京建成科技有限公司总超氧化物歧化酶(T-SOD)活性测试盒(羟胺法);南京建成科技有限公司植物丙二醛(MDA)含量测定试剂盒(微板法)。
1.2 试验设计
取采自江苏省农业科学院试验田的土壤若干,过10目筛后作为空白土,取其中一部分空白土加入一定浓度的DBP丙酮溶液,晾干后搅拌混匀,作为DBP污染土,将上述2种土壤均匀铺在铁盘中,保持一定的土壤深度以及其他良好的培养条件,待植株移栽。供试植株为温室土壤培养下长势一致(3叶1心)的上海青幼苗。将上海青幼苗移栽到DBP污染土中作为DBP处理组,移栽到空白土中作为对照组,在水分充足光照良好的条件下培养21 d后,分别检测土壤、植株茎叶、根部中的DBP含量,同时测量植株的根长、生物量、叶绿素含量过氧化氢含量以及MDA、SOD、POD、CAT活性。以上所有处理均设5个重复,除土壤不同外,光照时间、光照度、浇水时间、浇水量、温度、湿度等其他培养条件均保持一致。
1.3 试验方法
1.3.1 DBP的提取分析方法 由于土壤及植物中含有极多杂质,本试验采用最近研发的QuEChERS(quick,easy,cheap,effective,rugged,safe)方法[17],利用吸附剂来吸附样品中杂质,从而达到提取、净化的目的。(1)土壤中DBP提取:称取土壤样品2.0 g置于10 mL玻璃具塞离心管中,加入6 mL乙腈,超声30 min 后进行提取;加入1.0 g氯化钠涡旋振荡1 min;取2 mL上清液,加入50 mg无水硫酸镁、50 mg PSA,涡旋振荡1 min以充分净化,静置3 min 后取1 mL上清液经0.22 μm有机滤膜过滤后进HPLC进行检测。(2)植株中DBP提取:将植株的根、茎、叶分别于组织匀浆机中加入液氮均匀打碎后,称取样品1.0 g置于10 mL 玻璃具塞离心管,加入3 mL乙腈,超声30 min 后进行提取;加入1.0 g氯化钠涡旋振荡2 min,取2 mL上清液,加入50 mg无水硫酸镁、50 mg PSA和30 mg GCB,涡旋振荡5 min 以充分净化,静置5 min后取1 mL上清液经0.22 μm有机滤膜过滤后进HPLC进行检测。[JP3]HPLC条件:色谱柱为ZORBA×SB-AQ柱(4.6 mm×250 mm,5 μm);流动相为V(乙腈) ∶V(水)=85 ∶15;流速为0.9 mL/min;检测波长为225 nm;柱温为室温;进样量为20 μL。在上述条件下DBP的保留时间为4.2 min,该方法下土壤中DBP的回收率为83.3%,相对标准偏差(RSD)为4.1%;青菜中DBP的回收率为80.5%,RSD为5.5%。
1.3.2 生物量、根长及叶绿素含量測定方法 将移栽培养21 d后的上海青从土壤中取出,尽量减少根部损伤,将根部用清水清洗干净后,用吸水纸将水分吸干,测量并记录根长,然后对整个植株称质量并记录,利用SPAD502叶绿素含量测定仪测定植株的叶绿素含量,对植株多张叶片进行测量,然后取平均值并记录。
1.3.3 抗氧化酶活性及可溶性蛋白、过氧化氢含量的测定方法 将移栽培养21 d后的上海青从土壤中取出,尽量减少根部损伤,将根部用清水清洗干净后,用吸水纸将水分吸干,加入相应体积提取液,在冰水浴条件下进行机械匀浆,制成一定浓度的组织匀浆,均匀称取1 mL样品,采用对应试剂盒测定酶活性。
可溶性蛋白含量测定:采用BCA法测定植株鲜样中的可溶性蛋白含量,其原理是在碱性条件下,蛋白质可将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的络合物,该络合物在562 nm处有最大吸收峰,依据吸光度与浓度成正比,通过测得的吸光度即可计算出待测蛋白的浓度,具体步骤按试剂盒说明书进行,计算公式为
过氧化氢含量测定:采用分光光度法测定植株鲜样中的过氧化氢含量,其原理是过氧化氢可以与钼酸作用生成一种络合物,该络合物在405 nm处有最大吸收峰,通过测定吸光度可以计算出过氧化氢的量,具体步骤按试剂盒说明书进行,计算公式为
过氧化氢酶(CAT)活性测定:采用分光光度法测定植株鲜样的过氧化氢酶活性,其原理是过氧化氢酶分解过氧化氢的反应可以通过加入钼酸铵而迅速终止,剩余的过氧化氢与钼酸铵作用产生一种淡黄色的络合物,通过测定405 nm处的吸光度变化,可计算出CAT活性,具体步骤按试剂盒说明书进行,计算公式为
过氧化物酶(POD)活性测定:利用过氧化物酶催化过氧化氢反应的原理,通过测定420 nm处吸光度的变化得出酶活性,具体步骤按试剂盒说明书进行,计算公式为
超氧化物歧化酶(SOD)活性测定:采用黄嘌呤氧化酶法测定SOD活性,其原理为SOD是一种重要的抗氧化剂,能够催化植物细胞内O-2· 发生歧化反应,生成H2O,清除细胞内过量的O-2· ,保护细胞膜系统免遭氧化损伤。细胞内O-2· 能氧化经胺生成NO2,发生显色反应,呈现粉红色,当SOD消除O-2· 后,NO2生成量减少,通过测定450 nm处的吸光度变化,即可计算出SOD活性,具体步骤按试剂盒说明书进行,计算公式为
植物丙二醛(MDA)含量测定:采用硫代巴比妥酸(TBA)显色法测定植株鲜样中丙二醛含量,其原理为过氧化脂质降解产物中的丙二醛可与硫代巴比妥酸缩合,形成红色产物,该产物在532 nm处有最大吸收峰,具体步骤按试剂盒说明书进行,计算公式为
MDA含量=[SX(]D532 nm测定值-D532 nm空白值D532 nm标准值-D532 nm空白值[SX)]×标准品浓度÷样本浓度。
2 结果与分析
2.1 上海青对土壤中DBP的吸收情况
将上海青种子置于温室中土培一段时间后,将长势一致的3叶1心上海青幼苗取出,分别检测植株茎叶部分及根部的DBP含量,通过高效液相色谱并没有检测到DBP的存在。植株移栽前为验证处理土壤中是否有DBP存在,测定土壤样品中的DBP含量,结果发现,处理组初始土壤中的DBP含量为(127.6±3.1) mg/kg,植株移栽后分别对茎叶部分和根部的DBP含量进行检测,检测结果(图1)表明,上海青植株能吸收土壤中的DBP,而且根部含量显著高于地上茎叶部分,根部DBP含量为(1.21±0.07) mg/kg,茎叶部分为(0.25±0.01) mg/kg。
2.2 DBP胁迫对植株生长指标的影响
生物量指某一特定时刻生物有机体物质的总量,是反映植物生长情况的最基本指标。在上海青移栽培养21 d后,分别测定DBP处理组和空白对照组植株的根长、生物量及叶绿素含量,这些生理指标可以间接地说明植株的生长情况。试验结果(图2)显示,空白对照组的根长为(18.17±1.26) cm,DBP处理组的根长为(12.83±1.04) cm;空白对照组的生物量为(35.55±2.88) g,DBP处理组的生物量为 (19.29±2.91) g;空白对照组叶绿素含量的对应SPAD值为46.91±1.89,DBP处理组叶绿素含量的对应SPAD值为46.78±1.03。可以看出,DBP处理组的根长及生物量与空白对照组之间存在显著性或极显著性差异,说明空白对照组的植株发育比DBP处理组要好,DBP胁迫使植株生长受到了影响;而2组处理的叶绿素含量则没有显著性差异,说明DBP对植株的胁迫没有对植株的叶绿素含量产生明显影响。
2.3 DBP胁迫对植株抗氧化酶系统的影响
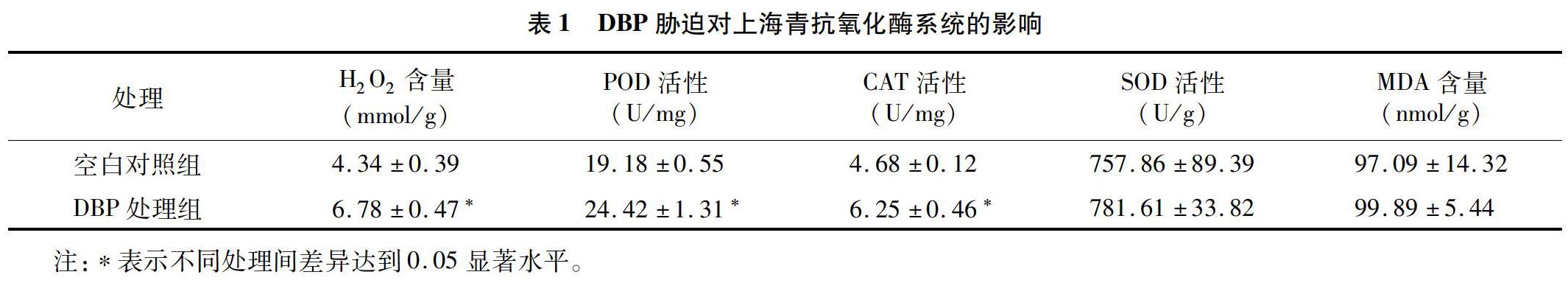
植株体内的活性氧(ROS)在正常的生命活动情况下处于一种动态平衡的状态,而一旦受到外界环境胁迫影响就会产生波动,H2O2、MDA含量可以直观地体现植株的ROS水平,当植株H2O2含量过高时,植株就会产生大量的CAT以减少H2O2,而植株MDA含量则依靠SOD及POD来降解,以保持ROS的动态平衡。由表1可见,DBP处理组的植株H2O2含量为(6.78±0.47) mmol/g,空白对照组为(4.34±0.39) mmol/g;DBP处理组的植株SOD活性为(781.61±33.82) U/g,空白对照组为(757.86±89.39) U/g;DBP处理组的植株MDA含量为(99.89±5.44) nmol/g,空白对照组为(97.09±14.32) nmol/g;DBP处理组的植株CAT活性为(6.25±0.46) U/mg,空白对照组为(4.68±0.12) U/mg;DBP处理组的植株POD活性为(24.42±1.31) U/mg,空白对照组为(19.18±0.55) U/mg。相对于空白对照组,DBP处理组植株的H2O2含量、POD活性、CAT活性都显著升高(P<0.05),而SOD活性、MDA活性的升高未达到显著水平。
3 讨论
近年来随着社会工业化的迅速发展,PAEs在全球的消费量已经达到了每年约600万t[18],由于其化学性质稳定,在环境中的自然降解十分缓慢,水解半衰期少则3年,多则高达两千多年[19],且通常即便降解也无法彻底矿化,依然会产生有害的中间代谢产物[20-21],其中的类激素有毒物质会通过各种[LL]渠道散播到周圍的环境中造成环境污染,且对人类毒害。
就目前来讲,PAEs作为土壤中最严重的有机污染物之一,已经在我国不同区域的农田土壤中被广泛检出,且个别地区超标严重[22]。这些富集在土壤中的PAEs会被土壤中种植的作物吸收,但不同作物对土壤中PAEs的吸收情况不尽相同,有些作物对PAEs的吸收极其明显,有的则吸收很少。如在珠江三角洲的蔬菜基地中蔬菜样品中的PAEs总含量为0.46~12.02 mg/kg[23],而尹睿等则发现,番茄、胡萝卜和萝卜对DEHP的吸收量很少[24-25]。造成这种现象的原因很复杂,包括作物种类、土壤类型、PAEs污染浓度和生长条件等原因[26]。而在本试验中可以明显看到,上海青对DBP的吸收很明显,且根部含量大于茎叶部分。
作物吸收PAEs后不仅会严重影响产量及质量,也会对最终食用的动物及人类产生难以想象的毒害作用。有研究表明,当土壤中的DBP及邻苯二甲酸二异丁酯(DIBP)含量超过20 mg/kg时,会对其上生长的辣椒产生显著的抑制作用[27]。宋广宇通过研究发现,红壤中的PAEs检出率高,并且在含PAEs的红壤中生长的上海青成活率很低,对上海青有显著的抑制生长作用[12],其研究结果与本试验得到的结果一致。
植物体内的抗氧化酶系统由SOD、POD及CAT组成,对因受到环境胁迫而产生过量ROS的调控是极其重要的[28]。当植株受到外界胁迫时,会产生大量的ROS使植物膜脂过氧化而产生MDA,而当植株体内的ROS含量超过一定水平一段时间以后,会对植株造成永久性损伤,甚至导致植株死亡。刘春晓等发现,高浓度的DBP不仅会抑制藻类生长,还会降低其SOD和CAT的活性[29]。从本试验结果可以看出,与对照相比,DBP胁迫处理下的植株H2O2含量、CAT活性显著提高,说明植株确实会因受到DBP胁迫而过氧化,体内的大量H2O2会使植株启动抗氧化酶系统,产生大量CAT以降解过量的H2O2;而植株的MDA含量、SOD活性无显著性变化,结合植株体内的DBP含量来看,这可能是因为植株体内的DBP含量并不高,无法产生过量ROS使植物发生膜脂过氧化,也有可能是因为在培养过程中大量的MDA刺激抗氧化酶系统,从而产生大量POD将其降解。综合来看,DBP确实对上海青的抗氧化酶系统有一定影响。
研究PAEs污染土壤对作物的危害及修复是十分重要的,不但有助于制定治理修复措施,而且对环境保护和人类健康具有重要的意义。本研究从植株生长指标和抗氧化酶系统2个方面来阐述DBP对上海青的胁迫影响,可对PAEs污染土壤的作物种植及植物修复模型的构建提供理论依据。
参考文献:
[1]纪 秀. 邻苯二甲酸二丁酯降解菌株的筛选及相关降解特性的研究[D]. 镇江:江苏大学,2017.
[2]黄 艳,卞战强,田向红,等. 环境中邻苯二甲酸酯类化合物降解技术研究进展[J]. 环境与健康杂志,2010,27(7):654-657.
[3]Erythropel H C,Maric M,Nicell J A,et al. Leaching of the plasticizer di (2-ethylhexyl) phthalate (DEHP) from plastic containers and the question of human exposure[J]. Applied Microbiology and Biotechnology,2014,98(24):9967-9981.
[4]Zolfaghari M,Drogui P,Seyhi B,et al. Occurrence,fate and effects of Di (2-ethylhexyl) phthalate in wastewater treatment plants:a review[J]. Environmental Pollution,2014,194:281-293.
[5]Gao D W,Wen Z D. Phthalate esters in the environment:a critical review of their occurrence,biodegradation,and removal during wastewater treatment processes[J]. The Science of the Total Environment,2016,541(15):986-1001.
[6]Kapanen A,Stephen J R,Brüggemann J,et al. Diethyl phthalate in compost:ecotoxicological effects and response of the microbial community[J]. Chemosphere,2007,67(11):2201-2209.
[7]Voss C,Zerban H,Bannasch P,et al. Lifelong exposure to di-(2-ethylhexyl)-phthalate induces tumors in liver and testes ofSprague-Dawley rats[J]. Toxicology,2005,206(3):359-371.
[8]Wang J H,Liu P,Qian Y. Microbial degradation of di-n butyl phthalate[J]. Chemosphere,1995,31(9):4051-4056.
[9]骆祝华,黄翔玲,叶德赞. 环境内分泌干扰物——邻苯二甲酸酯的生物降解研究进展[J]. 应用与环境生物学报,2008,14(6):890-897.
[10]鄂 勇,张晓琳,宋秋霞. 环境内分泌干扰物及其潜在威胁[J]. 东北农业大学学报,2008,39(11):135-139.
[11]崔学慧,李炳华,陈鸿汉,等. 中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J]. 生态环境学报,2010,19(2):472-479.
[12]宋广宇. 邻苯二甲酸酯在土壤-植物系统中的生物有效性研究[D]. 南京:南京农业大学,2010.
[13]Xu G,Li F S,Wang Q H.Occurrence and degradation characteristics of dibutyl phthalate (DBP) and di-(2-ethylhexyl) phthalate (DEHP) in typical agricultural soils of China[J]. The Science of the Total Environment,2008,393(2/3):333-340.
[14]Zeng F,Cui K,Esters X P. Phthalate esters (PAEs):emerging organic contaminants in agricultural soils in peri-urban areas around Guangzhou,China[J]. Environmental Pollution,2008,156(2):425-434.
[15]Blount B C,Milgram K E,Silva M J,et al. Quantitative detection of eight phthalate metabolites in human urine using HPLC-APCI-MS/MS[J]. Analytical Chemistry,2000,72(17):4127-4134.
[16]Wang J,Luo Y M,Teng Y,et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution,2013,180:265-273.
[17]严煌倩,李 勇,翟丽菲,等. 气相色谱-质谱法结合QuEChERS法快速检测青椒中15种邻苯二甲酸酯[J]. 江苏农业学报,2018,34(2):459-465.
[18]Xie Z,Ebinghaus R,Temme C,et al. Occurrence and air-sea exchange of phthalates in the Arctic[J]. Environmental Science & Technology,2007,41(13):4555-4560.
[19]陈 波,林建国,陈 清. 水环境中的邻苯二甲酸酯类污染物及其环境行为研究[J]. 环境科学与管理,2009,34(2):71-75.
[20]李海涛,黄岁樑. 水环境中邻苯二甲酸酯的迁移转化研究[J]. 环境污染与防治,2006,28(11):853-858.
[21]Stales C A,Peterson D R,Parkerton T F,et al. The environmental fate of phthalate esters:a literature review[J]. Chemosphere,1997,35(4):667-749.
[22]Cai Q Y,Mo C H,Wu Q T,et al. The status of soil contamination by semivolatile organic chemicals (SVOCs) in China:a review[J]. The Science of the Total Environment,2008,389(2/3):209-224.
[23]肖凯恩,莫测辉,蔡全英. 珠江三角洲蔬菜基地蔬菜中邻苯二甲酸酯的含量特征[J]. 四川环境,2012,31(3):49-55.
[24]尹 睿,林先贵,王曙光,等. 土壤中DBP/DEHP污染对几种蔬菜品质的影响[J]. 农业环境科学学报,2004,23(1):1-5.
[25]曾巧云,莫测辉,蔡全英,等. 邻苯二甲酸二丁酯在不同品种菜心-土壤系统的累积[J]. 中国环境科学,2006,26(3):333-336.
[26]鲁磊安. 珠三角地区水稻邻苯二甲酸酯污染特征研究[D]. 广州:暨南大学,2016.
[27][JP3]任旭琴,高 軍,陈伯清,等. 辣椒DBP/DIBP胁迫及其修复剂优化和机理研究[J]. 农业环境科学学报,2015,34(6):1121-1126.
[28]余 东,许家辉,李永裕,等. Cd胁迫对枇杷叶片酶活性及膜透性的影响[J]. 热带作物学报,2008,29(2):154-158.
[29]刘春晓,王 平,李海燕,等. DBP对铜绿微囊藻生长和抗氧化酶的影响[J]. 环境科学与技术,2015,38(2):7-12.

