外源性硫化氢对大鼠脊髓缺血再灌注损伤的影响及机制探讨
李春杰 何远宏 晁志文


[摘要] 目的 探讨外源性硫化氢(H2S)对大鼠脊髓缺血再灌注损伤(spinal cord alchemist-repercussion injury,SCII)的影响及可能的机制。 方法 30只SD大鼠随机分为假手术组、模型组和H2S干预组,制备大鼠SCII模型,H2S干预组于恢复灌流60 s内由大鼠尾静脉按10 mg/kg剂量注射NaHS,假手术组和模型组以同样的方法给予等量的生理盐水,分别于再灌注后3 h、6 h和12 h时,根据大鼠脊髓运动功能评分(Basso-Beattle-Bresnahan,BBB)标准对各组大鼠测定下肢神经运动功能评分,免疫组化观察各组大鼠脊髓组织变化,实时荧光定量PCR技术检测各组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6基因表达,Western blot法检测各组大鼠脊髓组织中p38MAPK、p-p38MAPK、ERK、p-ARK、JNK和p-DINK蛋白表达。 结果 与模型组相比,H2S干预组再灌注后3 h、6 h、12 h时大鼠神经行为学评分均升高,差异均有统计学意义(P<0.05);与模型组相比,H2S干预组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6相对表达量均降低,差异均有统计学意义(P<0.05);H2S干预组与模型组相比,H2S干预组大鼠脊髓组织中细胞出现损伤性改变,但变化程度较模型组大鼠明显减轻;H2S干预组大鼠脊髓组织中p38MAPK、ERK、JNK蛋白相对表达量均升高,而p-p38MAPK、p-ARK、p-DINK蛋白相对表达量均降低,差异均有统计学意义(P<0.05)。 结论 外源性硫化氢可有效减轻大鼠脊髓缺血再灌注损伤,改善脊髓神经功能,其机制可能是通过抑制CONFAB和MAPK中p38MAPK和JNK信号通路而减少炎症反应,同时,通过抑制MAPK中ERK信号激活而抗细胞凋亡,保护神经元。
[关键词] 脊髓;缺血再灌注损伤;硫化氢;机制;大鼠
[中图分类号] R651.2 [文獻标识码] A [文章编号] 1673-9701(2020)10-0029-06
[Abstract] Objective To investigate the effect of exogenous hydrogen sulfide(H2S) on spinal cord alchemist-repercussion injury(SCII) in rats and its possible mechanism. Methods 30 SD rats were randomly divided into sham operation group, model group and H2S intervention group. The rat SCII model was prepared. The H2S intervention group was injected with NaHS at a dose of 10 mg/kg from the tail vein of the rats within 60 seconds after reperfusion. The sham operation group and the model group were administered with the same amount of physiological saline in the same way. At 3 h, 6 h, and 12 h after reperfusion, lower limb neuromotor function scores were performed on each group of rats according to rat spinal cord motor function score(Basso-Beattle-Bresnahan, BBB) criteria. Changes of spinal cord tissue in each group were observed by immunohistochemistry. The CONFAB, VCAM-1, TNF-α and IL-6 gene expression in spinal cord tissue of each group was detected by real-time quantitative PCR technology. The expressions of p38MAPK, p-p38MAPK, ERK, p-ARK, JNK and p-DINK proteins in the spinal cord tissue of each group were detected by Western blot. Results Compared with that of the model group, the neurobehavioral score of rats in the H2S intervention group was higher at 3 h, 6 h, and 12 h after reperfusion, and the difference was statistically significant(P<0.05). Compared with those of the model group, the relative expression levels of CONFAB, VCAM-1, TNF-α, and IL-6 in the spinal cord tissue of the H2S intervention group rats were lower, and the differences were statistically significant(P<0.05). Compared with those of the model group, the cells in the H2S intervention group had damaging changes in the spinal cord tissue, but the degree of change was significantly reduced compared with that of the model group. The relative expressions of p38MAPK, ERK, and JNK proteins in the spinal cord tissue of the H2S intervention group increased, while the relative expression levels of p-p38MAPK, p-ARK, and p-DINK proteins were all reduced, and the differences were statistically significant(P<0.05). Conclusion Exogenous hydrogen sulfide can effectively reduce spinal cord ischemia-reperfusion injury and improve spinal nerve function in rats. The mechanism may be to reduce the inflammatory response by inhibiting p38MAPK and JNK signaling pathways in CONFAB and MAPK, and to resist cell apoptosis and protect neurons by inhibiting the activation of ERK in MAPK.
[Key words] Spinal cord; Ischemia-reperfusion injury; Hydrogen sulfide; Mechanism; Rat
脊髓缺血再灌注损伤(spinal cord alchemist-repercussion injury,SCII)是各种原因引起的脊髓缺血,在一定时间内脊髓组织细胞恢复血流(再灌注)后,脊髓损伤程度又加剧称为脊髓缺血再灌注损伤,其发生机制尚不十分明确,可能是多种因素综合作用结果进而导致脊髓继发性损害[1-2];SCII作为脊柱外科及腹主动脉手术常见且严重的并发症,临床研究统计有21%的脊柱外科和主动脉手术患者术后出现SCII并发症[3],是导致下肢瘫痪的重要因素,严重影响患者生存质量[4],目前,虽已有较多关于SCII的治疗方法,激素(糖皮质激素和地塞米松)减轻脊髓炎症反应、B族维生素营养神经、多种Ca阻滞剂、部分中成药等都对防治缺血、再灌注损害有一定作用[5],但尚无特效的防治药物或手段。研究表明[6-7],炎症反应是SCII发病的重要机制。硫化氢(hydrogen sulfide,H2S)作为体内持续产生的一种主要的气体信号分子,在调控多种信号通路及离子通道中发挥重要作用[8],可通过抑制过度炎症反应而发挥保护作用[9],已有研究表明[10-12],外源性给予H2S可有效保护心、脑、肾缺血再灌注损伤。然而,H2S在SCII中的作用及相关机制鲜有报道。为探索外源性硫化氢对大鼠脊髓缺血再灌注损伤的影响及机制,本研究通过构建大鼠SCII模型[13],外源性给予H2S处理,观察其对SCII的神经功能的影响以及可能的机制,以期为SCII临床防治提供基础资料。
1 资料与方法
1.1 试剂和设备
0.25% NaHS购自美国Sigma公司,Tripoli总RNA提取试剂盒购自Inviting公司,逆转录和PCR试剂盒均购自大连宝生物公司,核因子-AB(CONF-AB)、血管细胞粘附分子-1(VCAM-1)、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)及内参引物均由上海生工生物公司设计合成,兔抗大鼠p38促分裂原活化蛋白激酶(p38MAPK)多克隆抗体和兔抗大鼠p-p38MAPK多克隆抗体均购自美国Santa Cruz公司、兔抗大鼠细胞外信号调节蛋白激酶(ERK)单克隆抗体、兔抗大鼠p-ARK多克隆抗体均购自武汉博士德公司,兔抗小鼠c-Jun蛋白氨基末端激酶(JNK)多克隆抗体和兔抗小鼠p-DINK多克隆抗体均购自美国Cell Signaling公司,实时荧光定量PCR仪购自美国ABI公司,凝胶电泳成像系统购自美国Bio-rad公司。
1.2 方法
1.2.1 实验动物及分组 健康雄性SD大鼠30只,体重(210±20)g,购自河南省实验动物中心[许可证号:SYXK(豫)2016-0002],饲养于标准环境下,自由饮水、进食,实验前禁食12 h。利用随机数字表将大鼠随机分为假手术组、模型组和H2S干预组,每组10只。
1.2.2 制备大鼠SCII模型及处理 大鼠SCII模型组:按照文献[8]中的方法制备:大鼠腹腔注射麻醉后,逐层分离,将肠管小心分离后,打开后腹膜,使左侧肾动脉上腹主动脉充分暴露,用无创动脉夹将腹主动脉夹闭阻断30 min。随后,去除动脉夹恢复灌流。
假手术组:仅充分暴露腹主动脉而不夹闭。
H2S干预组:于恢复灌流60 s内由大鼠尾静脉按10 mg/kg剂量注射NaHS,假手术组和模型组以同样的方法给予等量的生理盐水。模型构建过程中各组均未出现死亡。
1.3 观察指标
1.3.1 各组大鼠神经行为学评分 分别于再灌注后3 h、6 h和12 h时,按照大鼠脊髓运动功能(Basso-Beattle-Bresnahan,BBB)评分[9]标准对各组大鼠进行下肢神经运动功能评分:分为21项,各单项相加即为最后评分,全瘫0分,正常21分。评分均由具有动物实验资质的实验员独立完成,取均值作为最后的BBB评分。
1.3.2 各组大鼠脊髓组织免疫组化染色 各组大鼠于灌注后12 h做完BBB评分后,各组大鼠腹腔注射过量2.5%戊巴比妥钠处死,将腰椎快速取出,取L3节段,用4%多聚甲醛浸泡后,石蜡包埋,连续切片,厚度约10 μm。经脱蜡、洗脱、水洗,苏木素染色5 min,冲洗,0.5%盐酸乙醇分化,清水浸泡15 min后,用伊红染色2 min,乙醇洗脱,二甲苯透明,封片观察。
1.3.3 实时荧光定量PCR技术检测各组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6基因表达 取各组大鼠腰段脊髓组织约0.1 g,4℃下研磨,加入细胞裂解液进行裂解,用Tripoli总RNA提取试剂盒对总RNA进行提取,利用紫外分光光度计对总RNA纯度进行检测,取A260/A280≥1.80作为合格样品。用逆转录试剂盒将总RNA逆转录为模板单链DNA,以DNA为模板进行PCR,各引物序列见表1。PCR反应条件:93℃ 60 s,92℃ 30 s,54℃ 30 s,72℃ 30 s,连续进行40次循环,每个样品均设3个平行反应复孔。用2-△△Ct法对脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6基因相对表达量进行分析。
1.3.4 Western blot法检测各组大鼠脊髓组织中p38MAPK、p-p38MAPK、ERK、p-ARK、JNK和p-DINK蛋白表达 取各组大鼠腰段脊髓组织约0.1 g,研磨后,加入细胞裂解液裂解,用总蛋白提取试剂盒获得总蛋白,利用BCA总蛋白检测试剂盒检测总蛋白纯度。取30 μg总蛋白,进行ADS-PAGE凝胶电泳分离,电转移至PVDF膜,用5%脱脂奶粉封闭120 min,分别将一抗兔抗大鼠p38MAPK、p-p38MAPK多克隆抗體、兔抗大鼠ERK单克隆抗体、兔抗大鼠p-ARK多克隆抗体、兔抗小鼠JNK、p-DINK多克隆抗体加入(稀释比例分别为:1:600、1:1000、1:800、1:1200、1:500、1:1000),4℃过夜孵育,TBST漂洗3次,加入二抗,室温下孵育120 min,TBST漂洗3次,加入ECL化学发光试剂避光反应20 min,拍照,利用Image J图像分析软件对各条带进行分析,获得脊髓组织中p38MAPK、p-p38 MAPK、ERK、p-ARK、JNK和p-DINK蛋白相对表达量。
1.4 统计学分析
利用SPSS 21.0统计分析软件完成对数据整理分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经行为学评分
与假手术组相比,模型组和H2S干预组再灌注后3 h、6 h、12 h时大鼠神经行为学评分均降低,差异均有统计学意义(P<0.05),与模型组相比,H2S干预组再灌注后3 h、6 h、12 h时大鼠神经行为学评分均升高,差异均有统计学意义(P<0.05),见表2。
2.2 各组大鼠脊髓组织免疫组化染色
HE染色结果显示,假手术组大鼠脊髓组织中神经元结构完整、饱满,清晰可见细胞浆中尼氏体,胞核边界清楚,清晰可见核仁;模型组大鼠脊髓组织中神经元细胞数量减少,核固缩、溶解,核仁模糊,尼氏体模糊减少,胞核边界不清,部分神经元周围出现空泡;H2S干预组大鼠脊髓组织中细胞出现损伤性改变,但变化程度较模型组大鼠明显减轻,见封三图1。
2.3 各组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6基因表达
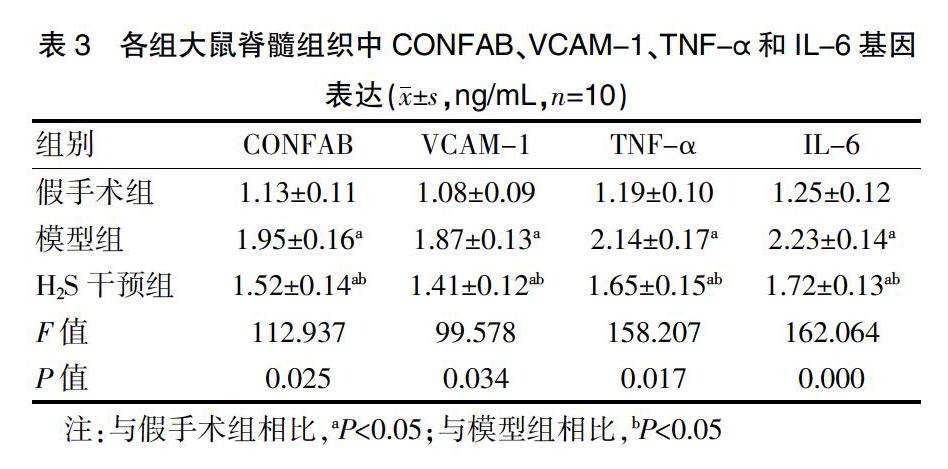
各组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6基因表达与假手术组相比,模型组和H2S干预组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6相对表达量均升高,差异均有统计学意义(P<0.05);与模型组相比,H2S干预组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6相对表达量均降低,差异均有统计学意义(P<0.05),见表3。
2.4 各组大鼠脊髓组织中p38MAPK、p-p38MAPK、ERK、p-ARK、JNK和p-DINK蛋白表达
与假手术组相比,模型组和H2S干预组大鼠脊髓组织中p38MAPK、ERK、JNK蛋白相对表达量均降低,而p-p38MAPK、p-ARK、p-DINK蛋白相对表达量均升高,差异均有统计学意义(P<0.05);与模型组相比,H2S干预组大鼠脊髓组织中p38MAPK、ERK、JNK蛋白相对表达量均升高,而p-p38MAPK、p-ARK、p-DINK蛋白相对表达量均降低,差异均有统计学意义(P<0.05),见表4和图1。
3 讨论
SCII作为一种严重的并发症,是导致脊髓损伤、神经元死亡的重要原因,可导致神经功能障碍甚至引起下肢截瘫、死亡[14-15];然而其损伤机制尚未明确,如何有效预防和治疗SCII发生已成为临床研究重点。研究表明[16],SCII过程中,由于脊髓组织出现缺血、缺氧及能量代谢障碍,使血脊髓屏障遭到破坏,血液循环中的有害代谢产物如炎症因子等进入脊髓组织,加重脊髓组织水肿,造成再灌注损伤[17]。目前硫化氢被认为是中枢神经系统重要的神经保护剂,但其对中枢神经系统保护机制是一个复杂的过程:有生物学者研究硫化氢(H2S)可通过上调SCII大鼠模型中CasC7的表达来保护脊髓[18];Xie L等[19]证实了硫化氢(H2S)通过减少AKT-雷帕霉素的哺乳动物靶标(mTOR)途径在SCIR损伤中的氧化应激,显著抑制自噬细胞死亡,发挥神经保护作用;氧化应激是SCII的主要原因,最近研究显示[20],MLN4924(一种有效的选择性NEDD8活化酶抑制剂)被证明在体外具有抗氧化应激的神经保护作用,为进一步探讨SCII发生机制,本研究采用结扎腹主动脉并恢复血流灌注的方法制备SCII大鼠模型,利用BBB评分标准对各组大鼠进行神经运动功能评分,有研究指出[21],BBB评分在不同损伤组间比较中具有优势,可作为急性脊髓损伤模型对比的标准评分法。本实验结果显示,模型组再灌注后3 h、6 h、12 h时大鼠神经行为学评分均较假手术组降低,说明模型组大鼠出现了神经行为学改变;免疫组化染色结构显示,模型组大鼠脊髓组织中神经元细胞数量减少,核固缩、溶解,核仁模糊,尼氏体模糊减少,胞核边界不清,部分神经元周围出现空泡,说明SCII模型大鼠脊髓组织出现损伤性改变,出现了神经元细胞凋亡坏死,印证了大鼠脊髓组织出现再灌注损伤。
CONFAB信号通路在炎症反应中发挥关键性的调控作用,该信号通路激活可促进炎症因子VCAM-1、TNF-α和IL-6的释放,而这些炎症因子又可以正反馈的进一步激活CONFAB信号通路,从而加剧炎症损伤[22]。本研究显示,模型组大鼠脊髓组织中CONFAB、VCAM-1、TNF-α和IL-6相对表达量均较假手术组升高,说明SCII大鼠模型脊髓组织中发生了炎症反应,炎症反应可能是推动SCII发生的重要机制。H2S作为重要的气体信号分子,在抑制炎症反应、抗细胞凋亡、改善缺血细胞等细胞保护中发挥重要调控功能[23]。研究表明[24],外源性给予NaHS,可在体内分离为Na+和HS-,在与体内H+结合后形成H2S,与NaHS形成动态平衡。本研究显示,H2S干预组大鼠再灌注后3 h、6 h、12 h时大鼠神经行为学评分较模型组增加,且免疫组化结果显示脊髓损伤较模型组轻,说明外源性给予NaHS可有效减少SCII大鼠神经损伤。表3显示H2S干预组大鼠组织中CONFAB、VCAM-1、TNF-α和IL-6相对表达量均较模型组降低,说明H2S可能通过抑制CONFAB信号通路介导的炎症反应而减少SCII对脊髓组织的损伤。研究表明[25],MAPK激酶信号通路在细胞炎症反应中处于与CONFAB信号通路同等的地位,当机体受外界不良刺激时,亦可激活MAPK信号通路而诱导细胞大量产生和释放TNF-α和IL-6等促炎细胞因子。p38MAPK、ERK和JNK是MAPK激酶超家族中重要的细胞外信号调控蛋白,其中,p38MAPK和JNK是主要的应激MAPK,可通过调控其下游的炎症相关因子而参与炎症反应[26],表4显示与假手术组相比,模型组大鼠脊髓组织中p38MAPK、JNK蛋白相对表达量均降低,而p-p38MAPK、p-DINK蛋白相对表达量均升高,说明在SCII模型脊髓组织中p38MAPK和JNK被大量磷酸化活化,而進一步促进炎症反应的发生,而H2S干预组大鼠脊髓组织中p38MAPK和JNK则被显著抑制,提示H2S可能通过抑制p38MAPK和JNK信号通路而对SCII模型发挥保护作用。ERK作为MAPK激酶超家族中重要成员,则在细胞增殖、分化、凋亡中发挥重要作用,在急性炎症反应中,ERK 被大量炎症因子激活而促进细胞凋亡的发生[27],表4显示模型组大鼠脊髓组织中p-ARK蛋白水平升高,ERK信号通路被激活,而H2S干预组大鼠脊髓组织中p-ARK蛋白水平降低,提示H2S可能通过抑制炎症反应而减少了ERK信号激活,从而发挥抗凋亡作用,保护脊髓神经元。
綜上所述,外源性硫化氢可有效减轻大鼠脊髓缺血再灌注损伤,改善脊髓神经功能,其机制可能是通过抑制CONFAB和MAPK中p38MAPK和JNK信号通路而减少炎症反应,同时,通过抑制MAPK中ERK信号激活而抗细胞凋亡,保护神经元。本研究采用扎腹主动脉并恢复血流灌注的方法制备SCII大鼠模型,但目前仍然不能完全复制SCII的发病过程,本项研究样本数较少,没有进一步评价其他机制对评分的影响且主观BBB评分存在一定的误差,但是本研究仍可以为SCII的治疗开启全新的思路。我们是否可以通过吸入H2S或通过静脉内注射NaHS来实现外源性H2S对SCII进行预处理,减轻及预防SCII,然而,硫化氢能否对人体SCII有益处以及安全有效的使用浓度仍需要进一步研究。
[参考文献]
[1] 陈星月,陈栋,陈春慧,等.中国创伤性脊髓损伤流行病学和疾病经济负担的系统评价[J].中国循证医学杂志,2018,18(2):143-150.
[2] Yamanaka K,Eldeiry M,Afta B,et al.Pretreatment with diazoxide attenuates spinal cord ischemia-reperfusion injury th-rough signaling transducer and activator of transcription 3 path-way[J].Ann Thorac Surg,2019,107(3):733-739.
[3] Bicknell C,Riga C,Wolfe J. Prevention of paraplegia during thoracoabdominal aortic aneurysm repair[J]. Eur J Vasc Endovasc Surg,2009,37(6):654-660.
[4] Wynn MM,Acherr CW. A modern theory of spinal cord alchemist/injury in abdominal aortic surgery and its implications for prevention of paralysis[J]. J Cardiograph Canvas Anesthetic,2014,28(4):1088-1099.
[5] 艾琪勇,罗越,刘辉,等. 脊髓缺血再灌注损伤的发病机制与治疗进展[J]. 实用医学杂志,2014,(16):2678-2680.
[6] Gook EC,Achieve R,Gook A,et al. Cumming attenuates inflammation,oxidant stress,and infrastructure damage induced by spinal cord alchemist-repercussion injury in rats[J]. J Stroke Cerebrate Dis,2016,25(5):1196-1207.
[7] Zhou Z,Liu C,Chen S,et al.Activation of the Nrf2/ARE signaling pathway by probucol contributes to inhibiting inflammation and neuronal apoptosis after spinal cord injury[J].Onco-Target,2017,8(32):52078-52093.
[8] Sabot C. Hydrogen sulfide,an enhancer of vascular citric oxide signaling:mechanisms and implications[J]. Am J Physio Cell Physio,2017,312(1):C3-C15.
[9] Heng J,Chao T,Yuan Y,et al. Hydrogen sulfide(H2S)attenuates uranium-induced acute synchronicity through oxidant stress and inflammatory response via Nrf2-NF-KB pathways[J]. Chem Biol Interact,2015,242(11):353-362.
[10] Die H,Bu Q,Ja J,et al. Hydrogen sulfide protects against cardinal alchemist and repercussion injury by activating AMP-activated protein Kinsey to restore autobiographic flux[J]. Bio Chem Bio Phys Res Com Mun,2015, 458(3):632-638.
[11] Hosgood SA,Nicholson ML. Hydrogen sulphide ameliorates ischaemia-reperfusion injury in an experimental model of non-heart-beating donor kidney transplantation[J].Br J Surg,2010,97(2):202-209.
[12] Kang K,Zhao M,Jiang H,et al. Role of hydrogen sulfide in hepatic ischemia-reperfusion-induced injury in rats[J].Liver Transpl,2009,15(10):1306-1314.
[13] Zivin JA,Ddgirolam U. Spinal cord infarction:a highly reproducible stroke model[J]. Stroke,1980,11(4):200-202.
[14] Galvani SP,Walsh JT,Liken JR,et al. Dealing with danger in the CNS:the response of the immune system to injury[J]. Neuron,2015,87(1):47-62.
[15] Awad H,Ramadan ME,et al. Spinal cord injury after thoracic endovascular aortic aneurysm repair[J]. Can J Anaesth,2017,64(12):1218-1235.
[16] Fang H,Bhang JC,Yang M,et al. Perfusion of gastropod in abdominal aorta for alleviating spinal cord alchemist repercussion injury[J]. Asian Ac J Trop Med,2016,9(7):688-693.
[17] 余奇勁,解立杰,胡霁.脊髓缺血再灌注损伤与血脊髓屏障关系的研究进展[J]. 实用医学杂志,2016,32(12):2066-2068.
[18] Liu Y,Pan L,Jiang A,et al. Hydrogen sulfide upregulated lncRNA CasC7 to reduce neuronal cell apoptosis in spinal cord ischemia-reperfusion injuryrat[J]. Biomed Phar-macother,2018,98:856-862.
[19] Xie L,Yu S,Yang K,et al. Hydrogen sulfide inhibits autophagic neuronal cell death by reducing oxidative stress in spinal cord ischemia reperfusion injury[J]. Oxid Med Cell Longev,2017,2017:8640284.
[20] Yu S,Xie L,Liu Z,et al. Exerts a neuroprotective effect against oxidative stress via sirt1 in spinal cord ischemia-reperfusion injury[J]. Oxid Med Cell Longev,2019,(7):283-639.
[21] 殷铭,徐又佳. 大鼠脊髓损伤后CBS和BBB评分比较研究[J]. 中国血液流变学杂志,2012,22(3):398-400.
[22] 谢英花,马燕山,张楠,等. 硫化氢抑制大鼠急性心肌缺血引起的细胞炎症反应[J]. 中国病理生理杂志,2014, 30(9):1698-1702.
[23] Samurai H. Hydrogen poly sulfide(H2Sn)signaling along with hydrogen sulfide(H2S)and citric oxide(NO)[J]. J Neural Trans(Vienna),2016,123(11):1235-1245.
[24] Boo D,Jupiter RC,Pankey EA,et al. Analysis of cardiovascular responses to the H2S donors Na2S and NaHS in the rat[J]. Am J Physio Heart Cir Physio,2015,309(4):H605-614.
[25] 殷为,梅柱中. 双特异性磷酸酶1:炎症反应的负调控因子[J]. 国际免疫学杂志,2012,35(5):338-340.
[26] Dong J,Wang J,He Y,et al. GHIP in Streptococcus pneumatic is involved in antibacterial resistance and elicits a strong innate immune response through TLR2 and JNK/p38MAPK[J]. FEBS J,2014,281(17):3803-3815.
[27] 刘坚,吕海金,安玉玲,等. 间充质干细胞抑制MEK/ERK信号通路改善盲肠结扎穿孔所致急性肺损伤中肺泡Ⅱ型上皮细胞的凋亡[J].中山大学学报(医学科学版),2016,37(3):367-372.
(收稿日期:2020-01-13)

