泛素样含植物同源结构域和环指域1表达水平与肿瘤患者预后关系的Meta分析
陈少兴 王俊毅 代玉娟 王艺辉*
泛素样含植物同源结构域(plant homeo domain,PHD)和环指域1(ubiquitin-like with PHD and ring finger domain 1,UHFR1)是一种核蛋白基因,可与位于拓扑异构酶2启动子的CCA AT盒相结合,进一步调控拓扑异构酶2的表达[1]。UHFR1主要在增殖细胞中表达,而在完全分化的组织中不表达,其表达水平与细胞增殖潜能呈正相关;在肿瘤细胞中,UHFR1过表达可促进细胞增殖和去分化[2]。有研究发现,UHFR1也是一个致癌基因[3];在很多肿瘤中均有表达,如肺癌、结直肠癌、甲状腺癌、胰腺癌以及宫颈癌等[4-8]。近年来,关于UHFR1表达与肿瘤预后关系的研究越来越多,且众多研究发现,UHFR1高表达的肿瘤患者预后较差[9-11]。然而,大多数研究受样本量限制,结果缺乏一定说服性。为此,本研究通过对已发表的有关文献进行Meta分析,探讨UHFR1表达水平在肿瘤患者预后评价中的价值。
1 资料与方法
1.1 文献检索
应用计算机检索Pubmed、Embase、The Cochrane Library、CNKI、维普及万方等数据库发表的英文及中文文献,检索词包括Cancer,carcinoma、Tumor,Neoplasm、Neoplasms、Neoplasia、UHRF1、Prognosis、Prognostic、肿瘤及预后等;检索截止时间为2019年5月。
1.2 文献的纳入及排除标准
(1)纳入标准:①所有肿瘤均明确诊断,且为恶性肿瘤;②研究中报道UHRF1与肿瘤预后指标,如总体生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)及癌症特异存活率(cancer-specific survival,CSS)等的关系;③研究中可获得相应预后指标的危险概率(hazard ratio,HR)及95%置信区间(confidence interval,95%CI)。
(2)排除标准:①综述、个案报告、会议报告及重复发表的文献;②研究中无法获得相应预后指标的HR及95%CI。
1.3 文献筛选
由2名研究员对文献进行筛选,选出符合纳入标准的文献,若两者出现分歧,则由第3名研究员再次阅读文献。按照上述检索词在各个数据库进行检索,初步检索到133篇文献,排除重复发表的和明显不符合纳入标准的,阅读题目及摘要后初步筛选出29篇文献,进一步阅读全文,最终纳入12篇文献,共1467例肿瘤患者[9-20]。对于报道OS的11篇文献,按照部位分为消化道肿瘤组(5篇),非消化道肿瘤组(6篇)两个亚组。
1.4 文献质量评估及数据提取
纳入的文献按照纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)进行质量评估。数据提取的内容包括第一作者、国家、发表年份;各研究的病例数及UHRF1的检测方法研究中报道的预后指标及相应的HR和95%CI。
1.5 统计学方法
采用STATA12.0SE软件进行数据分析,将相同预后指标的HR及95%CI进行合并,以P<0.05提示有统计学意义。同时分别对报道相同预后指标的研究进行异质性检验,若P>0.1,I2<50%提示纳入的各研究无显著异质性,采用固定效应模型进行统计分析;若P≤0.1,I2≥50%提示纳入的各研究有显著异质性,则采用随机效应模型进行统计分析,需要探究异质性来源,必要时可行敏感性分析。对可能存在的发表偏倚通过漏斗图分析进行评估,并进一步行Begg检验及Egger检验。
2 结果
2.1 纳入文献基本情况
纳入的12篇文献中英文文献8篇,中文文献4篇:中国11篇,日本1篇。研究内容中,食管癌2篇,结直肠癌2篇,喉癌2篇,胃癌1篇,膀胱癌1篇,肝癌1篇,乳腺癌1篇,黑色素瘤1篇,髓母细胞瘤1篇。其中,11篇报道了不同表达水平UHRF1与OS的关系,2篇报道了不同表达水平UHRF1与PFS的关系,1篇报道了不同表达水平UHRF1与CSS的关系。纳入文献的基本信息见表1。
2.2 Meta分析结果
纳入的12篇文献中,有11篇文献报道了UHRF1的表达与OS的关系。对其进行异质性检验,提示各研究间无显著异质性(I2=0.0%,P=0.826),故采用固定效应模型进行分析。对各研究的HR及95%CI进行合并,合并后HR=2.30,95%CI:1.93~2.74,P=0.000。提示与UHRF1低表达的患者相比,UHRF1高表达的患者预后更差,OS缩短。亚组分析发现,消化道肿瘤与非消化道肿瘤中,UHRF1高表达的患者预后均较差,OS缩短:①消化道肿瘤,HR=2.18,95%CI为1.77~2.69,P=0.000;②非消化道肿瘤,HR=2.58,95%CI为1.90~3.51,P=0.000。因此,UHRF1高表达的肿瘤患者预后较差,OS较低。见图1。
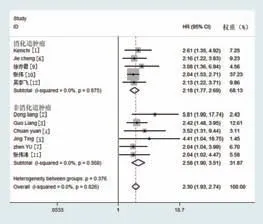
图1 UHRF1表达与肿瘤患者的OS关系森林图
纳入的12篇文献中,有2篇文献报道了UHRF1的表达与PFS的关系。对其进行异质性检验,提示各研究间存在显著异质性(I2=92.7%,P=0.000),故采用随机效应模型进行分析。对各研究的HR及95%CI进行合并,合并后的结果无统计学意义,HR=1.14,95%CI:0.68~1.91,P=0.622,提示肿瘤患者UHRF1高表达可能与PFS缩短无关。见图2。
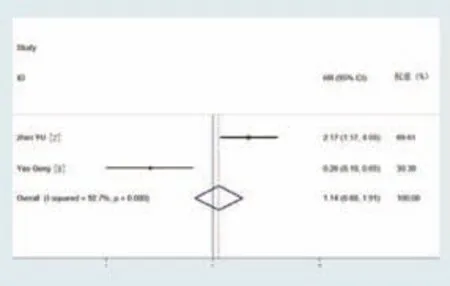
图2 UHRF1表达与肿瘤患者的 PFS关系森林图
2.3 发表偏倚
对12篇文献中的11篇报道了OS的研究进行漏斗图进行分析,漏斗图图形散点左右不对称,并进一步行Begg检验及Egger检验,均提示纳入的各个研究可能存在一定的发表偏倚。见图3。
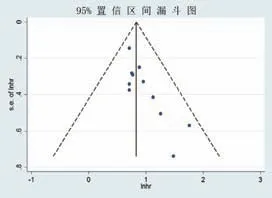
图3 报道OS的11篇论文发表偏倚漏斗图
3 讨论
UHRF1在大多数恶性肿瘤呈高表达状态,参与了肿瘤细胞的生成,肿瘤的发展和演变。Tien等[21]发现,UHRF1丢失可以阻止细胞周期进展,敲除UHRF1可使肿瘤细胞停滞在G2/M期,进一步促进肿瘤细胞凋亡。另一方面,UHRF1能进一步通过抑癌基因甲基化,从而诱导肿瘤细胞增殖和恶性转化[1]。目前研究最多抑癌基因是P16INK4,P16INK4可通过抑制细胞周期素依赖性激酶调节细胞周期,并与细胞凋亡调节蛋白结合进一步调控细胞凋亡[22]。而UHRF1能够通过调控P16INK4的表达,进一步抑制肿瘤细胞凋亡。因此,UHRF1是恶性肿瘤发生发展中的一个重要因素,可作为癌症诊断和预后的生物标志物,监测疾病进展和治疗反应[2]。临床上有大量的研究表明,UHRF1高表达的肿瘤患者预后较差。
本研究通过对11篇报道了UHRF1表达水平与OS关系的文献进行Meta分析,研究结果显示,与UHRF1低表达的肿瘤患者相比,UHRF1高表达的肿瘤患者预后更差,OS更短;异质性检验提示各个研究之间无显著异质性。同时,也按肿瘤类型对其进行亚组分析,结果显示,无论是消化道肿瘤还是非消化道肿瘤,UHRF1高表达的患者,其OS均缩短。但是,在对仅有的2篇文献报道了UHRF1表达水平与PFS的关系进行研究时发现,UHRF1表达水平与肿瘤患者的PFS无明显关系。因此,UHRF1高表达是影响肿瘤预后的危险因素。
本研究尚存在一定的局限性:①纳入的文献较少,且11篇为国内的文献,1篇为日本的文献,造成一定的发表偏倚;②各个研究的文献质量不同,可能会导致一定的偏倚;③仅有2篇文献报道了UHRF1表达水平与PFS的关系,且两者差异无统计学意义,但因报道的文献较少,其最后的分析结果有待商榷;④大多数发表的文献均报道了阳性结果,对于阴性结果很少发表。本研究的结果有可能高估了UHRF1高表达对肿瘤预后的影响。因此,仍需开展多中心,大样本对照试验来进一步证实UHRF1高表达与肿瘤预后的关系。
4 结论
UHRF1高表达的肿瘤患者较UHRF1低表达的患者预后差,UHRF1高表达患者的总生存期更短。对于肿瘤的研究目前已经进入了基因时代,基因检测对肿瘤的发病机制、治疗方式和预后评估均具有重要的指导意义。在临床工作中,对肿瘤的预后判断是一项重要的工作,通过本研究可以发现,UHRF1是影响肿瘤患者预后的一个危险因素,可为未来临床诊治中判断肿瘤预后提供参考。

