血清p2PSA联合细胞因子对PSA灰区前列腺癌患者的诊断价值
毛镭篥 吴 卫 黄 媛 张 丽 李 薇 崔 巍
前列腺癌(prostate cancer,PCa)是男性泌尿系统最常见的恶性肿瘤,在世界范围内,前列腺发病率在男性所有恶性肿瘤中位居第二[1]。目前,PCa的发病率在我国呈逐年上升的趋势[2]。前列腺特异性抗原(prostate-specific antigen,PSA)是目前在临床普遍应用的筛查手段,但仍有部分前列腺癌患者PSA水平并不高或处于灰区(4~10μg/L)临界水平,给诊断带来困难,且位于PSA灰区的患者中约有30%左右病理诊断为PCa[3-4]。
目前,关于良性前列腺增生症(benign prostatic hyperplasia,BPH)以及PCa的发病机制有多种学说或假设,慢性炎症可能在发病进程中起重要作用[5]。细胞炎性反应过程中免疫细胞的激活和募集可导致细胞因子和趋化因子富集的微环境,从而影响癌症的发展[6]。辅助性T细胞17(T helper cell 17,Th17)被认为是一群重要的介导炎性反应的细胞,通过释放细胞因子来维持慢性炎症状态和导致癌变的微环境,与PCa的发生发展有密切关系[7];白细胞介素6(interleukin-6,IL-6)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-ɑ)被发现在PCa组织中高表达[6-8]。近年来的研究发现,血清前列腺特异性抗原同源异构体2(isoform[-2]proprostatespecific antigen,p2PSA)检测,经计算得到的百分比p2PSA(%p2PSA)和前列腺健康指数(prostate health index,PHI)在PCa诊断中具有较好的应用前景[9]。本研究旨在探讨p2PSA、%p2PSA、PHI以及细胞因子IL-6、TNF-ɑ、IL-17A、IL-23和IL-36γ等指标与BPH和PCa的关系,评价各指标对PSA灰区前列腺癌的诊断价值。
1 资料与方法
1.1 一般资料
选择2017年11月至2019年7月在北京协和医院就诊的60例老年男性患者,年龄53~83岁,平均年龄(68.65±7.14)岁。所有病例均行血清总PSA(tPSA)的检测,tPSA水平在4~10μg/L之间。按照病理结果将所有患者分为BPH组(23例)和PCa组(37例)。BPH组中年龄56~83岁,平均年龄(70.26±7.68)岁;PCa组中年龄53~82岁,平均年龄(67.65±6.70)岁。另选同期在医院进行健康体检的30名健康男性纳入健康对照组,年龄35~53岁,平均年龄(41.27±6.08)岁。所有患者一般资料差异无统计学意义,具有可比性。
1.2 纳入与排除标准
(1)纳入标准:①直肠指诊(-)、tPSA水平在4~10μg/L之间;②愿意行经直肠B超检查、血清p2PSA测定以及前列腺穿刺活检。
(2)排除标准:①直肠指诊扪及明显硬结者;②曾行前列腺手术者;③曾服用5a还原酶抑制剂者。
1.3 仪器与试剂
采用Roche Cobas e601型电化学发光免疫分析仪(瑞士罗氏公司);ACCESS2型全自动免疫分析仪(美国贝克曼库尔特公司);IMMULITE1000型全自动化学发光免疫分析仪(德国西门子公司);酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海酶联生物公司)。
1.4 检测方法
(1)标本采集:所有进行前列腺癌筛查的患者均严格要求在行直肠指诊和经尿道等相关器械检查之前采集静脉全血标本4 ml,离心分离血清。在Roche e601系统上完成tPSA初筛,收集tPSA检测结果在4.0~10.0 μg/L的血清样本,置于-80 ℃超低温冰箱冻存。
(2)标本检测:tPSA先在Roche e601型电化学发光免疫分析仪上筛检,tPSA、fPSA和p2PSA检测均采用ACCESS2型全自动免疫分析仪及配套试剂盒、标准品和质控品。采用ELISA试剂盒进行IL-17A、IL-23和IL36γ测定;采用IMMULITE1000型全自动化学发光免疫分析仪进行IL-6和TNF-ɑ测定。
1.5 观察与评价指标
(1)BPH组和PCa组:从采集的标本中筛选出含有前列腺活检病理结果的60例样本,复融至室温后进行血清tPSA、fPSA、p2PSA及细胞因子IL-6、TNF-ɑ、IL-17A、IL-23、IL-36γ的检测。经计算转换得到%p2PSA、PHI结果,计算为公式1和公式2:

(2)健康对照组:完成细胞因子IL-6、TNF-ɑ、IL-17A、IL-23及IL-36γ的检测。
(3)诊断效能:以病理结果作为金标准,各指标的诊断效能由受试者工作特征(receiver operating characteristic,ROC)曲线确定。
1.6 统计学方法
采用SPSS17.0统计软件对数据进行统计分析。患者年龄、罗氏系统的tPSA、贝克曼系统的tPSA的检测结果呈正态分布,数据采用均值±标准差(±s)描述,fPSA、%p2PSA、PHI、p2PSA、IL-6、TNF-ɑ、IL-17A、IL-23和IL36γ呈非正态分布,数据采用中位数(四分位数)进行描述。正态分布组间均值的比较采用t检验,非正态分布采用Mann-Whitney U检验,以P<0.05为差异有统计学意义。
2 结果
2.1 灰区标本在罗氏和贝克曼系统中tPSA的检测
经罗氏和贝克曼两个系统对tPSA检测结果的相关性分析,相关方程及相关系数为y=0.8988x+0.845,r=0.4887,相关性良好,见图1。
BPH组和PCa组在年龄、两种不同系统的tPSA检测结果比较,差异均无统计学意义(t=1.388,t=0.696,t=0.237;P>0.05),见表1。
2.2 入选病例fPSA、p2PSA、%p2PSA以及PHI的检测
tPSA灰区标本中PCa组与BPH组间fPSA比较差异无统计学意义(U=0.661,P>0.05);p2PSA、%p2PSA以及PHI在两组间的差异均具有统计学意义(U=2.410,U=3.491,U=4.213;P<0.05),见表2。

图1 不同系统tPSA结果相关性
表1 tPSA灰区患者基本资料及不同系统tPSA检测结果对比(±s)

表1 tPSA灰区患者基本资料及不同系统tPSA检测结果对比(±s)
注:表中tPSA为总前列腺特异性抗原;患者年龄为正态分布,采用±s描述
2.3 三组细胞因子IL-6、TNF-ɑ、IL-17A、IL-23及IL-36γ检测
BPH组与健康对照组的IL-6及TNF-ɑ比较,差异均有统计学意义(U=3.943,U=3.513,P<0.05);PCa组与健康对照组相比,IL-6、TNF-ɑ、IL-17及IL-36γ差异均有统计学意义(U=4.363,U=3.152,U=2.210,U=3.077;P<0.05);PCa组与BPH组比较差异均无统计学意义,见表3和表4。
2.4 血清生物标志物在前列腺癌诊断中的效能比较
对于tPSA处于灰区的标本中,只有p2PSA、%p2PSA以及PHI等三项指标在BPH组和PCA组存在统计学差异。p2PSA、%p2PSA以及PHI指标对前列腺癌的诊断具有较高的准确性,ROC曲线下面积(area under curve,AUC)分别为0.691、0.834及0.777。而IL-6、TNF-ɑ、IL-17A、IL-23、IL-36γ、tPSA及fPSA的AUC分别为0.533、0.506、0.624、0.577、
0.541、0.431和0.494,诊断效能不高,见图2。
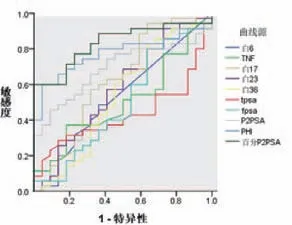
图2 p2PSA、%p2PSA和PHI指标ROC曲线

表2 tPSA灰区患者fPSA、p2PSA、%p2PSA和PHI血清指标结果

表3 三组细胞因子IL-6、TNF-ɑ和IL-17A检测比较(pg/ml)
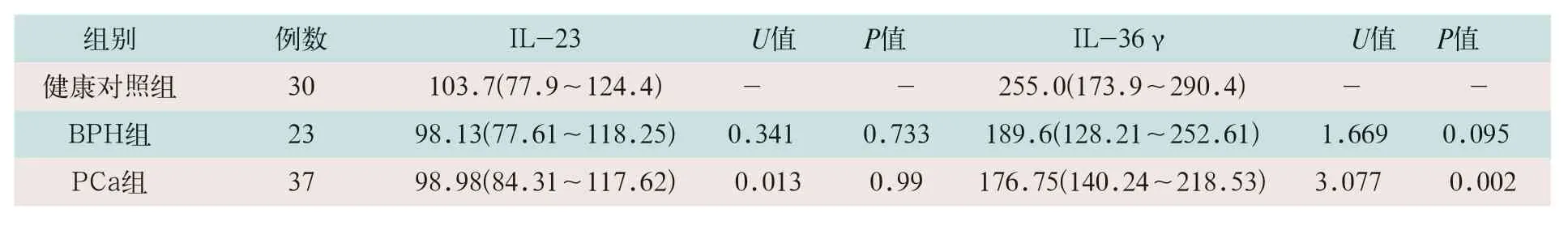
表4 三组细胞因子IL-23和IL-36检测比较(pg/ml)
p2PSA、%p2PSA以及PHI的最佳截断值分别为20.26ng/ml、1.733%和43.89,此时的诊断灵敏度和特异度分别为:①p2PSA为45.7%和90.9%;②%p2PSA为60.0%和100%;③PHI为60.0%和95.5%。三项指标的AUC差异有统计学意义,其中%p2PSA和PHI两项指标的AUC>0.7,诊断效能较高,见表5。

表5 p2PSA、%p2PSA和PHI指标的效能评价
3 讨论
PSA检测联合直肠指检是较早期发现前列腺癌的初筛方法。但血清PSA的水平升高除由前列腺癌引起外,还可由前列腺增生、前列腺炎、急性尿滁留等良性前列腺疾病及有关前列腺的各种检查所致[10]。当患者总PSA(tPSA)在4.0~10.0 μg/L即传统观点的灰区,是难以用PSA进行明确的鉴别诊断。且若单以tPSA>4 μg/L为穿刺指征,会导致许多不必要的穿刺[11]。
血清p2PSA是PSA前体(proPSA)的截短形式[-2]proPSA,于1997年在前列腺癌患者血清中发现[9]。PHI对前列腺癌患者初次活检结果的预测能力高于血清PSA和直肠指检,可以显著提高对前列腺癌发生率及恶性程度的准确性,在临床诊断中有重要的应用价值[12-13]。在本研究中p2PSA、%p2PSA以及PHI等3项指标在BPH组和PCa组存在统计学差异,与文献[14]报道一致。
炎性细胞因子作为炎症和免疫反应的中介物质,对免疫和炎症反应的过程和转归具有重要的意义。TNF-ɑ主要由巨噬细胞产生,具有抗病毒、抗感染、炎性介质、免疫调节等作用[15]。有研究发现,前列腺增生患者前列腺组织、精浆和血清中促炎症细胞因子TNF-ɑ、IL-6及IL-8的水平高于健康对照组[16-17]。IL-6由多种细胞产生,包括巨噬细胞、内皮细胞和T淋巴细胞。多种证据表明,IL-6在癌症的发生和发展中起重要作用:①前列腺细胞可以产生IL-6和IL-6R,并且在恶性上皮和高级别前列腺上皮内瘤中发现IL-6和IL-6R上调[18];②转移性前列腺癌和激素难治性前列腺癌患者IL-6水平升高[19];③IL-6水平与前列腺癌的发病率有关[20];④IL-6可能在激活雄激素受体中起作用[21]。Th17细胞是产生IL-17的T辅助细胞,参与自身免疫疾病及炎症性疾病的过程。Th17细胞对IL-6、TGFβ、CCL20、IL-23、IL-1β等多种刺激反应,尤其是在肿瘤微环境下,可介导肿瘤的消退或促进[22]。在前列腺癌中,更多的Th17细胞及其分泌的细胞因子IL-17A水平较高,与患者的预后较差有关[23]。本研究中BPH组与健康对照组相比,IL-6及TNF-ɑ差异均有统计学意义。PCa组与健康对照组相比,IL-6、TNF-ɑ、IL-17及IL36γ差异均有统计学意义,与文献报道相符,提示炎症反应参与了前列腺增生和前列腺癌疾病的发生及发展。
4 结论
血清tPSA在4.0~10.0 μg/L灰区时,引入p2PSA、%p2PSA、PHI、IL-6、TNF-ɑ和IL-17时,可为临床医生提供更丰富的数据资料,提高对前列腺癌的检出能力,不仅有助于前列腺穿刺活检时机的把握,还能减少不必要的穿刺活检带来的伤害。目前,国内外p2PSA研究尚不充分,且需更多大样本、多中心的研究数据进一步加以验证,以推动其在前列腺癌诊断中的作用。由于前列腺癌疾病细胞因子网络错综复杂,影响因素极多,其血清表达水平是否能够直接而准确反映前列腺癌病情,尚需通过病理分期、治疗前后对照、扩大样本量以及丰富检测方法等手段进行更深入的研究。

