利用SUT 技术助推细胞与基因疗法商业化
文/ Derek Pendlebury
本文由CPC-Colder Products 公司提供。
自美国食品药品监督管理局(FDA)批准了首个细胞与基因疗法 (CGT)— —人们的注意力就迅速转向了如何克服因这些前景广阔的疗法进行商业化量产而面临的挑战。目前,大多数用于临床试验的 CGT 制造工艺都不足以进行商业化量产。但幸运的是,我们可以从有类似需求的工艺——生物工艺中借鉴经验。
CGT 制造的需求
CGT 产品线十分庞大。除了最近获得FDA 批准的疗法以外,在全球,有400 多种疗法[1]处于临床前到3 期开发阶段,并且有大约1700 项临床研究正在进行中。
FDA 批准以 CAR-T 细胞(嵌合抗原受体-T 细胞)为基础的疗法后,人们对CGT 给予了更多的关注和投入。自体细胞疗法(即供体和受体为同一人)在2016 ~2017 年增加了65%[2]。现在,是时候攻克可持续性地、有成本效益地商业化制造这些新兴疗法所面临的挑战了。
一次性使用技术(SUT)预计将在CGT 商业化中发挥巨大作用。在生物制药生产中,已证实 SUT可以有效地满足商业化量产的需求,而CGT 与生物制药生产的需求十分类似。
两种制造工艺的对比
生物制品与CGT 的制造工艺既有相似之处,也有不同之处。
生物制品——为使用转基因生物制造生物制品,对细胞进行修饰来生产具有生物活性的分子。这些细胞即为工艺,活性分子为产品。
CGT——为生产CGT,细胞既是原材料和工艺,也是产品。
因此,用来生产这些不同疗法的生产工具和技术会有一些相似和不同之处。我们可以从这些相似之处中借鉴经验。
从实验室规模研究一直到临床试验的各个阶段再到投入商业化制造,SUT 应用于生物制药产品研发和制造的所有阶段。采用SUT 可为商业运作提供许多有据可查的优势[3,4,5],包括:
●成本——避免清洗和杀菌步骤,降低制造成本;
●速度——在安装过程以及运行周期之间可节省时间和劳动力;
●无菌性——避免各批之间发生交叉污染。
同样地,在细胞治疗和个性化医疗领域,SUT 也被广泛应用于研发和制造并得到了普遍认可——采用的理由都惊人地相似。
在生物工艺中的使用规模要大于在自体细胞疗法产品的开发和生产中使用的规模。更小的自体产品规模对设备的规模需求更少。
第二大重要差异是使用的SUT 类型。对于生物制药,SUT包括过滤器、细胞培养系统、混合系统、贮存容器、管路、传感器、阀、取样系统和接头。
对于细胞疗法,一次性系统传统上用于移液管、采血袋和T型烧瓶等设备的临床与研发。这些产品将继续使用,但也会补充一些扩展的SUT,加入收集装置、液体输送装置、小容量细胞培养系统,特别是还会广泛利用一次性袋子和袋子组件用于培养基,以及进行洗涤、冲洗、细胞收集、废物收集甚至是冷冻保存。
SUT 在细胞制造领域的前景
如今,我们可以使用各种工艺来开发细胞疗法。此类工艺取决于许多因素,包括细胞来源、工艺要求、细胞收集方法、细胞选择、细胞冲洗、细胞扩增、基因修饰和基因转移。CAR-T 开发的工艺步骤见图1 中的外圈。可用于各工艺步骤的技术示例见图1中的内圈。列出的某些技术与大规模生物工艺制造应用中使用的技术非常相似。
随着更多的细胞疗法产品进入临床试验产品线和商业化生产,必须确定SUT 能为细胞疗法开发商和制造商带来哪些优势,并且必须在适当情况下实施SUT[6]。同样重要的是,本行业需要明确知识缺口、SUT 的潜在缺陷以及通过什么途径来获得信息以便做出决策。
未提前规划的后果很严重。想象一下,当进入后期临床试验时,却发现必须要对某种一次性制造部件做出改变。这可能是由产品停产、缺乏可扩展性、供应链问题或验证问题导致的。必须改变某种流程产生的影响可能的原因有上市时间明显延迟,再验证成本增加,以及制造过程中使用的其他技术面临其他可能的监管调查。
细胞疗法制造商应知晓各种可用的SUT。即使在一种部件类型(如存储袋、接头或细胞培养系统)中,SUT 的绝对数量都是惊人的。由于本文篇幅有限,无法探索所有SUT 产品,所以着重关注开发一次性工艺(即合适的连接技术)时最重要但通常被忽视的决策。其有助于实现一次性到非一次性步骤的无菌连接,同时保持一个完全封闭的系统。错误的连接技术会对工艺的可扩展性、可重复性和安全性产生严重影响。
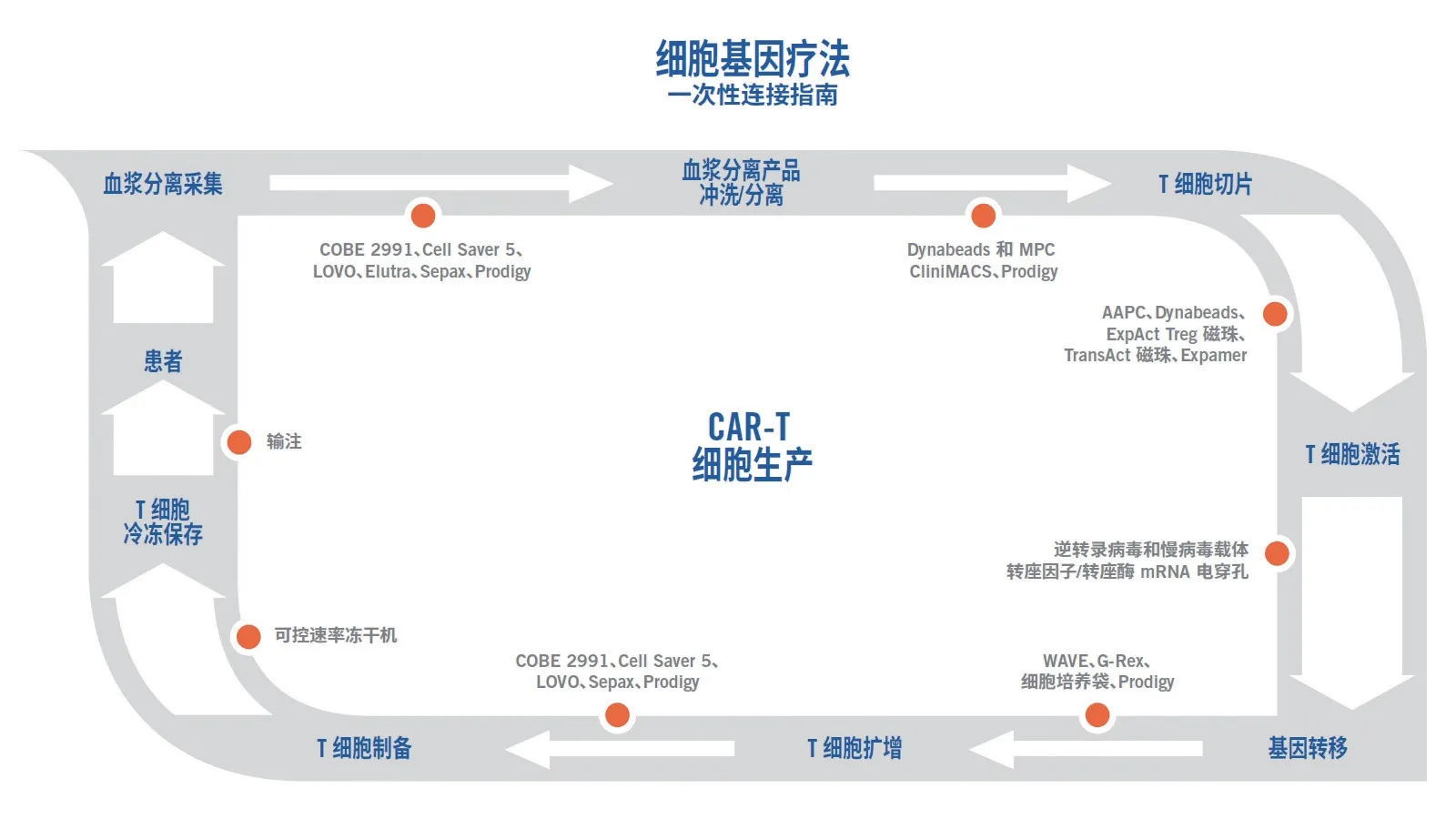
图1 CAR-T 工艺
一次性液体通路连接
液体连接技术根据实现连接的方式,分为两种基本类型:通过焊接或熔合两个液体通路来连接,以及通过“连接器”机械耦合两个安装在液体通路中的部件。
如需要为某种应用选择合适的连接技术,必须了解主要技术类型中以及每个技术组中亚组之间的关键技术差异,以及这些差异可能对工艺产生的操作性影响和每种技术的优势。
一个细胞疗法工艺中需要多少次连接?答案完全取决于工艺、产品的使用和可扩展性,图2 展示了基于图1 中CAR-T 工艺的一个细胞疗法工艺。它由柔软薄膜基材的SUT 组成。在这个拟定系统中,流程中每个袋子的尺寸都是50 mL ~5 L,具体取决于应用和每个步骤处理的液体体积。图2阐明了作为此流程一部分所需的连接次数和位置。

图3 不分公母连接器有助于实现无菌的闭合系统
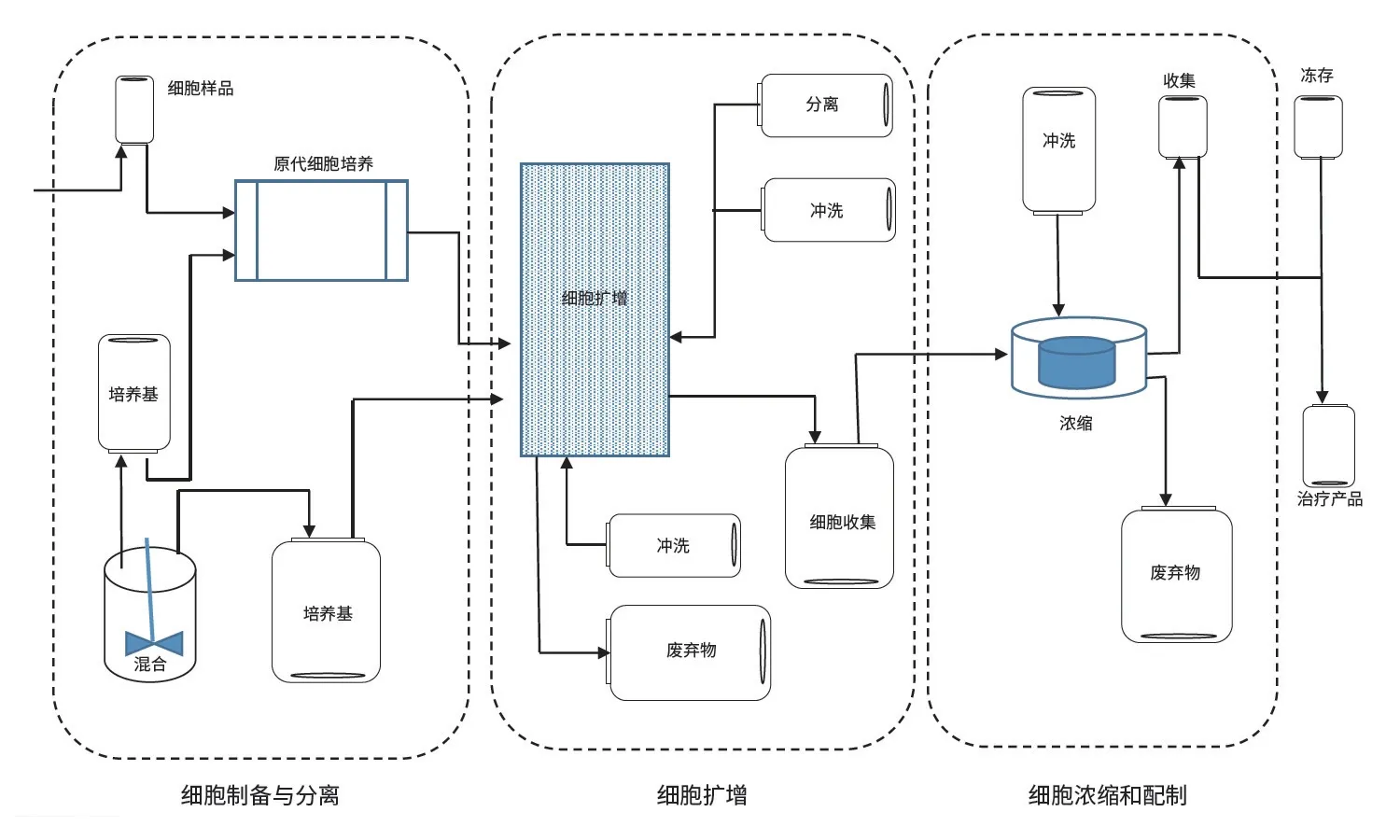
图 2 基于图 1 中 CAR-T 工艺的一个细胞疗法工艺
确定连接技术类型
确定合适连接技术的一个重要因素是工艺系统的设计。它是开放还是闭合系统?通常,工艺开发阶段的位置会对某个工艺系统的设计和使用的部件产生很大影响。
临床或学术实验室中的产品开发与在生物制药公司中非常不同。不仅技术不同,长期目标也不同。完成工艺开发后,生物制药公司通常会从长远角度做出决策,最终目标是将工艺商业化,因此更偏向于高度自动化的完全封闭式系统。
SUT(包括易于使用的无菌式接头)能满足对更稳健、更可靠工艺的需求[7]。随着SUT 越来越多地被用于重组产品制造工艺中,出于无菌性考虑,在细胞疗法生物工艺中使用它们是必然的[8]。重组疗法生产中使用的是完善确立的自动化工艺,而与之相反的是,自动化程度低、劳动密集型、开放性细胞疗法制造导致更容易受到操作员变化性的影响,并且更容易造成污染风险[9]。
在其2025 年的技术路线图中[10],美国国家细胞制造协会在有关规范化和监管支持的章节中明确指出,需要与相应监管机构对开放和闭合系统制定标准。需要的系统类型,以及实施每个流程步骤和每个步骤进行连接的环境决定了应使用的连接技术类型。

