QuEChERS-HPLC-Q-TOF/MS快速筛查蔬菜中32种农药残留
杨明,涂凤琴,王冬梅,伊鋆,江小明*,宫智勇
1. 武汉食品化妆品检验所(武汉 430012);2. 武汉轻工大学食品科学与工程学院(武汉 430023)
随着经济水平的提升,人们对蔬菜的质量要求也不断增加。然而,农业生产中普遍存在的农药残留问题势必给人们的身体健康造成较大威胁[1],引起了各国政府和国际组织对农药残留问题的重视。加强农药管理离不开对农药残留的监督和筛查,故建立农药多残留的快速筛查方法对于保障农产品的质量安全具有重要意义。目前,蔬菜农药残留的测定方法主要有气相色谱(Gas chromatography,GC)法[2]、气相色谱-质谱联用(Gas chromatography-mass spectrometry,GCMS)法[3]、液相色谱(Liquid chromatography,LC)法[4]和液相色谱-质谱联用(Liquid chromatographmass spectrometery,LC-MS)法[5]等。由于检测农药种类较多、基质复杂,单一的GC和LC的定性能力较弱,很难满足农药多残留的检测需求,而GC-MS和LC-MS均为低分辨质谱,在分析复杂基质样品时也易出现假阳性的情况,造成结果误判[6]。四极杆-飞行时间质谱(Quadrupole-time of flight mass spectrometry,Q-TOF/MS)等高分辨质谱技术因其具有高分辨率、高精度、全质量数据采集和无需标准物质定性等优势[7],被越来越多地应用于农药筛查领域,为农药合理科学的使用提供了良好的检测手段[8]。在前处理技术方面,传统的前处理方法主要有液液萃取、固液萃取等。这些方法存在溶剂耗量大、操作较为繁琐等缺点。QuEChERS前处理技术由于其具有操作简单、便捷高效、溶剂用量小等特点,已被广泛应用于食品中农药残留的分析检测[9-10]
试验建立了QuEChERS-高效液相色谱-四极杆-飞行时间质谱(QuEChERS-HPLC-Q/TOF MS)快速筛查与确证蔬菜中32种农药残留的分析方法。该方法仅需一次数据采集、建立谱库,通过检索即可同时完成目标物的定性筛查和确证分析,缩减了前处理和检测时间,实现了无标准品情况下对蔬菜样品中32种农药的快速筛查和确认,同时可对检测到的目标物进行准确定量,有效提升了农药多残留的检测效率。
1 材料与方法
1.1 材料与试剂
32种农药标准品均为First Standard品牌标准品,且均购于天津阿尔塔科技有限公司,纯度均≥98.0%;乙酸乙酯、丙酮、乙腈、乙酸铵(色谱纯,德国Merck公司);甲酸(色谱纯,美国Sigma-Aldrich公司);十八烷基键合硅胶吸附剂(C18)、N-丙基乙二胺吸附剂(PSA):上海安谱科学仪器公司;氯化钠(国药集团化学试剂有限公司);超纯水(18.2 MΩ·cm,由Milli-Q超纯水系统制得)。蔬菜样品从市场上随机抽取。
1.2 仪器与设备
SCIEX X500R四极杆飞行时间质谱仪(配有可用于电喷雾电离的Turbo V离子源,美国AB SCIEX公司);LC 30A液相色谱仪(日本岛津公司);Allegra X-15R Centrifuge离心机(美国贝克曼库尔特公司);Vortex-Genie2涡旋振荡器(美国Scientific Industries公司);PM5-2000TL超声波清洗器(普律玛仪器公司);Milli-Q超纯水系统(美国Millipore公司);ME204/02电子天平(梅特勒-托利多仪器有限公司);旋转蒸发仪(英国Genevac公司)。
1.3 方法
1.3.1 标准溶液配制
分别准确称取适量各农药标准品,根据农药分子的溶解度和测定需要选择甲醇、乙腈等溶剂溶解,配制质量浓度约为10 μg/mL的标准储备液,于-18℃保存。根据需要,移取适量的标准储备液,用空白样品基质提取液配制系列浓度的基质匹配标准工作溶液,基质匹配标准溶液现用现配。
1.3.2 样品处理
称取5.0 g匀浆后的样品于50 mL具塞离心管中,加入10 mL乙腈,涡旋混匀,超声提取30 min,加入3 g氯化钠,以4 500 r/min离心5 min,上清液待净化。取全部上清液置于含200 mg PSA、100 mg C18吸附剂的15 mL具塞离心管中,涡旋振荡2 min,以4 500 r/min离心5 min,取5 mL上清液于试管中,于40℃旋转浓缩至近干,用1.0 mL乙腈-0.1%甲酸水(9+1,V/V)复溶,经0.22 μm滤膜过滤后,供HPLC-Q-TOF/MS检测。
1.3.3 仪器条件
1.3.3.1 色谱条件
色谱柱:Waters XBridge C18(150 mm×2.1 mm,5 μm)。柱温:40℃。进样量:5 μL。流速:0.3 mL/min。流动相A:5 mmol/L乙酸铵-0.1%甲酸水。流动相B:5 mmol/L乙酸铵-甲醇。梯度洗脱程序:0~0.5 min,5.0% B;0.5~3.0 min,70% B;3.0~6.0 min,90.0% B;6.0~9.0 min,90.0% B;9.0~9.5 min,90.0%~5.0% B;9.5~12 min,5.0% B。
1.3.3.2 质谱条件
离子源:Turbo V ESI源。扫描方式:正离子扫描。检测方式:TOF MS-IDA-MS/MS。离子源温度:550℃。电喷雾电压(IS):4 500 V。雾化气压力(GS1):50 psi。辅助气压力(GS2):55 psi。气帘气压力(CUR):35 psi。碰撞气(CAD):7 psi。TOF-MS参数为采集范围:m/z100~1 000。去簇电压(DP):60 V。累计时间:0.25 s。TOF-MS/MS参数采集范围:m/z50~1 000。碰撞能量(CE):35 V。累计时间:0.05 s。碰撞能量波动范围(CES):15 V。
2 结果与讨论
2.1 色谱条件优化
试验选择Waters XBridge C18(150 mm×2.1 mm,5 μm)色谱柱对32种目标化合物进行分离分析,并比较32种农药在乙腈-水与甲醇-水流动相体系中的色谱分离效果。结果表明,目标化合物在甲醇-水流动相体系中分离度较好。进一步考察在水相和有机相中添加不同含量的甲酸、乙酸铵对分离效果的影响。结果显示,目标化合物在5 mmol/L乙酸铵/0.1%甲酸水-5 mmol/L乙酸铵/甲醇流动相体系下的分离度高、保留较好且质谱响应高,因此采用5 mmol/L乙酸铵/ 0.1%甲酸水-5 mmol/L乙酸铵/甲醇作为流动相。
2.2 质谱数据库的建立
32种目标化合物的母离子在正离子模式下的加合形式均为 [M+H]+。在优化的色谱-质谱条件下,对32种农药混合标准溶液进行TOF MS-IDA-MS/MS扫描。在采集一级质谱信息的同时,当化合物响应值超过设定的阈值,信息相关扫描(Information Dependent Acquistion,IDA)自动触发TOF MS/MS扫描采集目标物的二级碎片离子信息。TOF MS-IDA-MS/MS扫描模式仅需一次数据采集,即可获得目标物的精确质量母离子、保留时间等一级质谱信息以及在三个碰撞能量(20,35和50 V)下采集并叠加的二级碎片离子信息。通过SCIEX OS软件输入每种农药分子的名称、分子式、精确相对分子质量、保留时间,建立32种农药的一级精确质量数据库,并将相应的二级碎片离子质谱图导入谱库,建立32种农药分子的二级质谱信息库。32种农药的分子式、保留时间、理论分子量和实际测得分子量等质谱信息见表1。
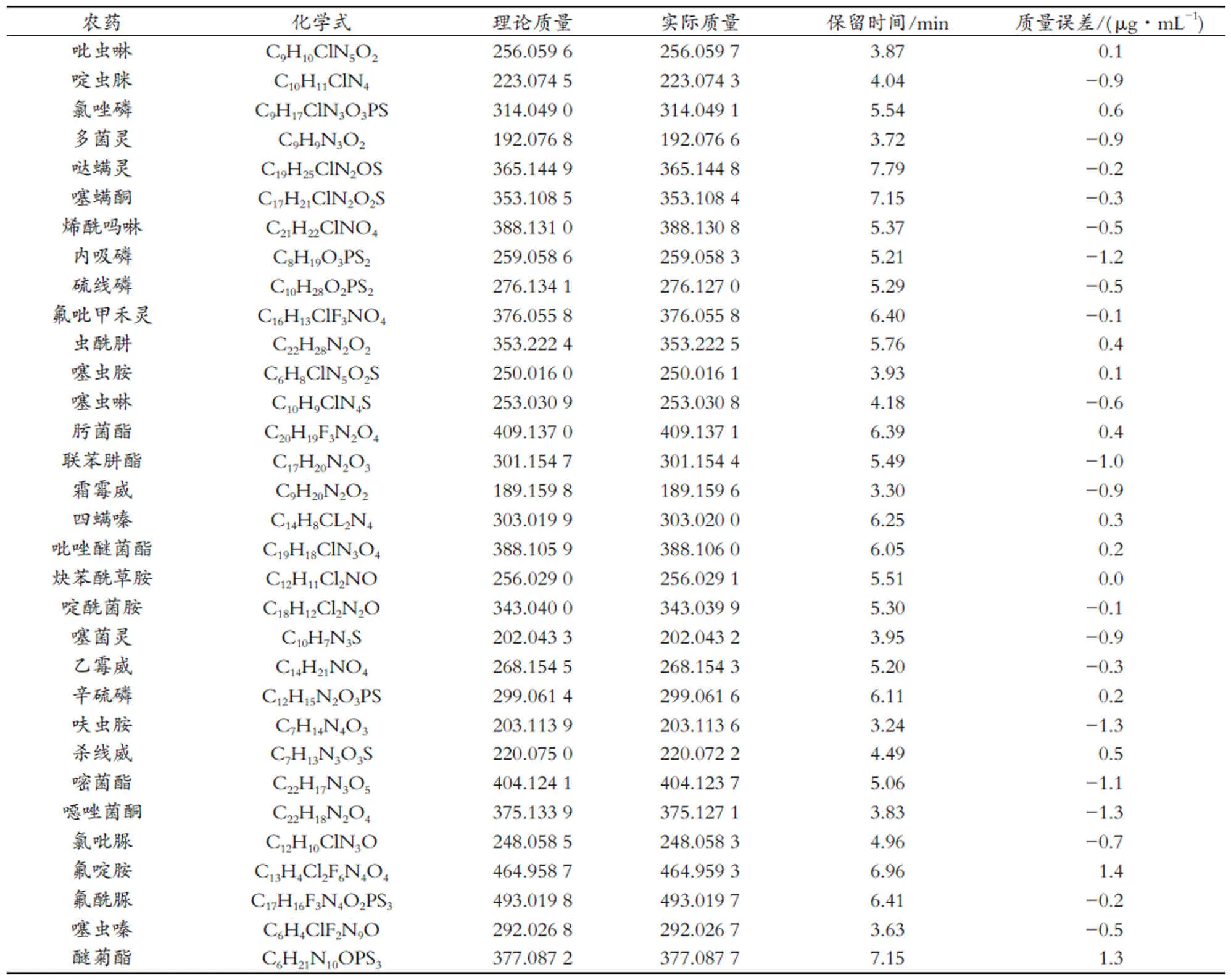
表1 32种农药的分子式、保留时间、理论分子量、实际测得分子量和其他质谱参数
2.3 提取试剂优化
试验以50 ng/mL标准添加样品对提取溶剂的种类进行考察。根据32种农药化学性质,选用乙酸乙酯、丙酮、乙腈作为提取溶剂并比较其提取效率。结果发现,乙酸乙酯和丙酮提取液的水分较多且颜色较深,会干扰目标物的分析、损害色谱柱、污染质谱离子源,且乙酸乙酯和丙酮对32种农药的提取平均回收率分别为62.82%和67.79%,其中乙酸乙酯中氯唑磷、噻螨酮、硫线磷、氟吡甲禾灵、虫酰肼、肟菌酯、霜霉威、四螨嗪、炔苯酰草胺、啶酰菌胺、乙霉威、辛硫磷、嘧菌酯、噁唑菌酮、氯吡脲和氟酰脲等16种的回收率均低于59.24%,丙酮中吡虫啉、啶虫脒、噻虫胺、噻虫啉、呋虫胺、杀线威、噁唑菌酮和氟酰脲等8种农药的回收率均低于59.19%。总体来看,乙腈的提取效果最好,提取液颜色较浅,32种农药平均回收率为88.54%,均在70%~110%之间,满足试验要求,因此选择乙腈作为提取试剂。在50 ng/mL标准添加样品条件下,不同提取溶剂对蔬菜中32种农药的提取回收率如图1所示。
2.4 吸附剂的选择
蔬菜样品基质中含有较多的糖类、有机酸、色素、维生素、芳香物质等,这些物质可能会和目标农药一起被提取出来,若不进行净化除杂,不仅会干扰目标物的分析,而且会损害色谱柱,污染质谱离子源。QuEChERS法经常使用的吸附剂有PSA、C18和GCB等,可有效去除基质中的有机酸、糖类和色素等多种组分。GCB对多菌灵和噻菌灵等平面农药具有很强的吸附作用,回收率低[11],因此不使用该吸附剂。试验研究了100 mg PSA+50 mg C18,150 mg PSA+75 mg C18,200 mg PSA+100 mg C18和250 mg PSA+125 mg C18四种不同净化剂组合对农药回收的影响。结果表明(图2):在50 ng/mL标准添加样品条件下,200 mg PSA+100 mg C18吸附剂组合的净化效果最好,对32种农药的平均回收率为88.47%,且各农药的回收率均在73.55%~102.67%之间。因此,选择200 mg PSA+100 mg C18吸附剂组合作为最佳纯化方案。
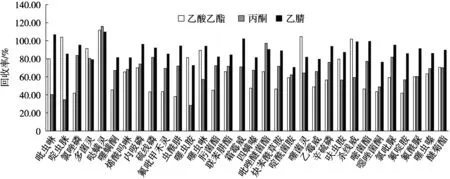
图1 不同提取溶剂对蔬菜中32种农药的提取效率
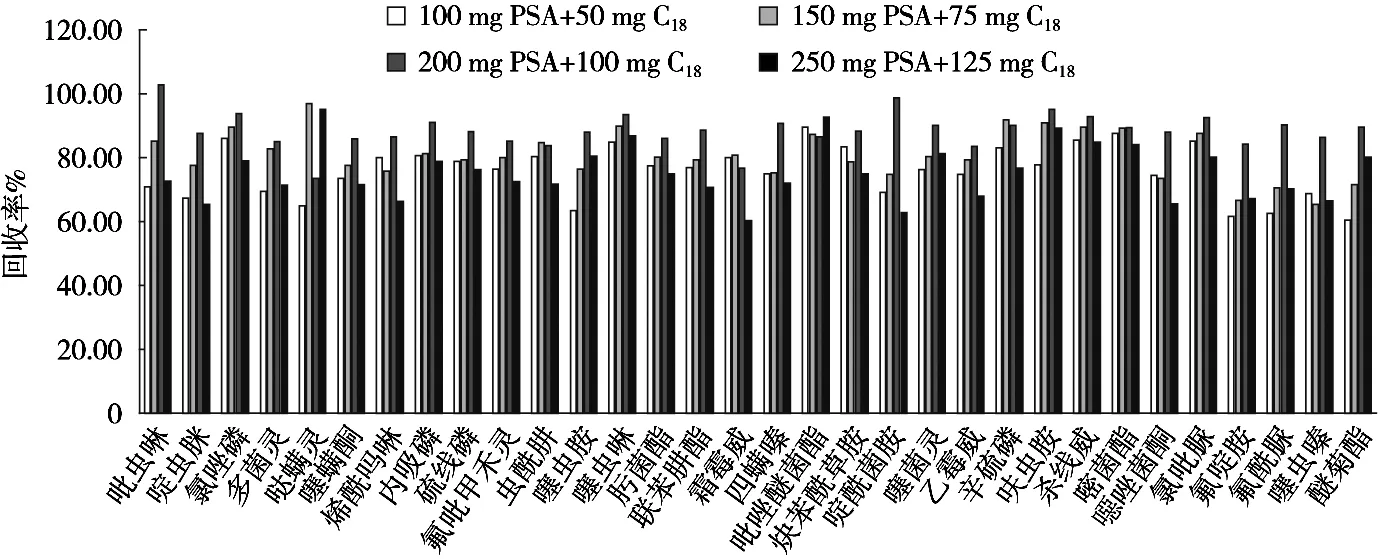
图2 不同吸附剂对蔬菜中32种农药回收率的影响
2.5 基质效应
基质效应(Matrix Effect,ME)是指目标分析物以外的其他组分对分析信号引起的增强或抑制现象[12]。试验用不同蔬菜的空白基质提取液与纯溶剂分别配制系列浓度的混合标准工作溶液,通过比较标准曲线的斜率来评价基质效应。计算公式:ME=基质标准曲线斜率/溶剂标准曲线斜率[13]。当ME为0.80~1.20时,基质效应不明显;当ME>1.20时,存在基质增强效应;当ME<0.80时,存在基质抑制效应。结果表明:以韭菜为例,32种农药中21种农药的ME在0.80~1.20范围内,11种农药的ME在0.70~0.80之间,存在一定的基质抑制效应。因此,采用基质匹配标准工作溶液作校准曲线来降低基质效应对测定结果的影响。
2.6 方法学考察
用空白基质提取液配制系列浓度的32种农药混合标准工作溶液,纵坐标以峰面积(y)计,横坐标以质量浓度(x)计,绘制基质标准工作曲线。结果表明,32种目标化合物浓度与对应的峰面积呈现良好的线性关系,线性相关系数(r)均大于0.999 0。检出限(LOD)和定量限(LOQ)分别以3×和10×信噪比(S/N)计,该方法32种农药的检出限在0.3~1.3 μg/kg之间,定量限在1.0~4.0 μg/kg之间。在阴性样品中添加3个浓度水平(n=6)的混合标准溶液以检查该方法的回收率和精确度。32种目标化合物的平均回收率为70.41%~103.1%,相对标准偏差为1.2%~11.2%,该方法回收率高、精密度高,满足蔬菜中农药残留监测的要求。
2.7 实际样品分析
采用所建立的方法对市售的20批次蔬菜样品进行分析,其中4批次样品中检出啶虫脒、多菌灵、烯酰吗啉、啶酰菌胺和嘧菌酯等5种农药残留。通过检索质谱信息数据库进行定性筛查,当可疑阳性化合物的一级精确质量数、同位素分布、保留时间等信息与数据库中目标农药分子匹配时,再通过二级全扫描质谱图的匹配度进行确证。以某一阳性样品中检出的啶虫脒为例,疑似化合物的保留时间与数据库信息一致,一级精确质量数偏差<5 μg/mL二级全扫描质谱图与数据库中啶虫脒二级碎片质谱图的镜像比对匹配度>80%,该化合物被确证为啶虫脒。样品中啶虫脒的提取离子色谱图、TOF-MS和TOF-MS/MS质谱图如图3所示。
对筛查出的目标物通过采用基质匹配外表法进行准确定量,4批次阳性样品中检出的5种农药残留,均未超过GB 2763—2016《食品安全国家标准食品中农药最大残留限量》规定的最大残留限量。同时,采用相对应国家标准对上述阳性样品进行了测试,验证了该方法的准确性,结果与该方法测定的结果一致。具体结果见表2。
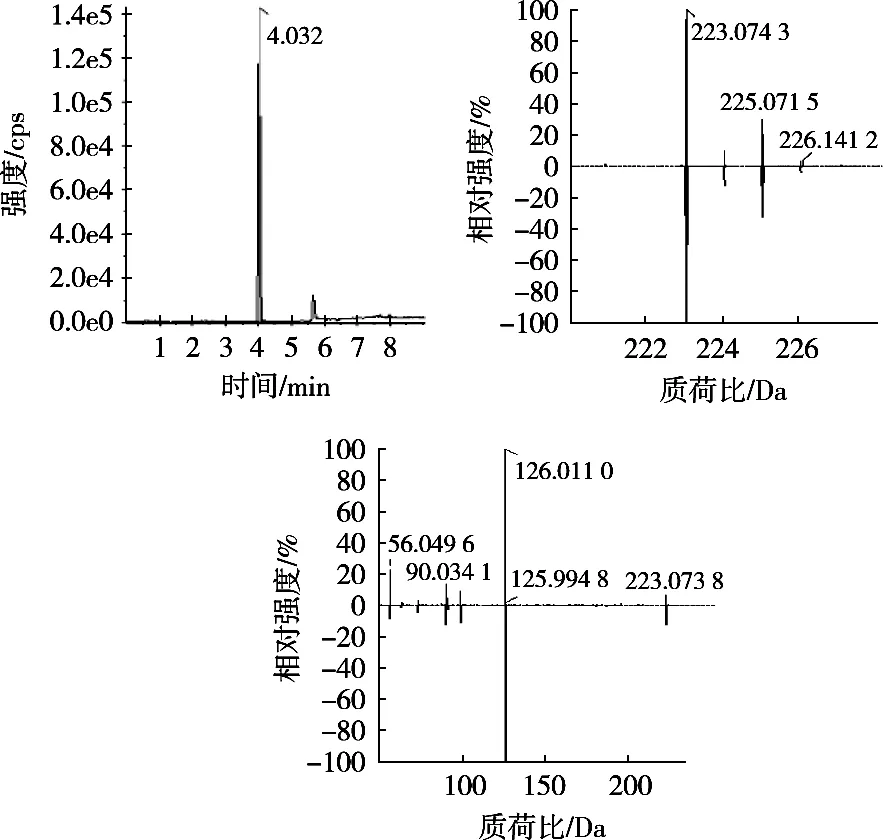
图3 某阳性样品中啶虫脒的提取离子色谱图、TOF-MS和TOF-MS/MS质谱图
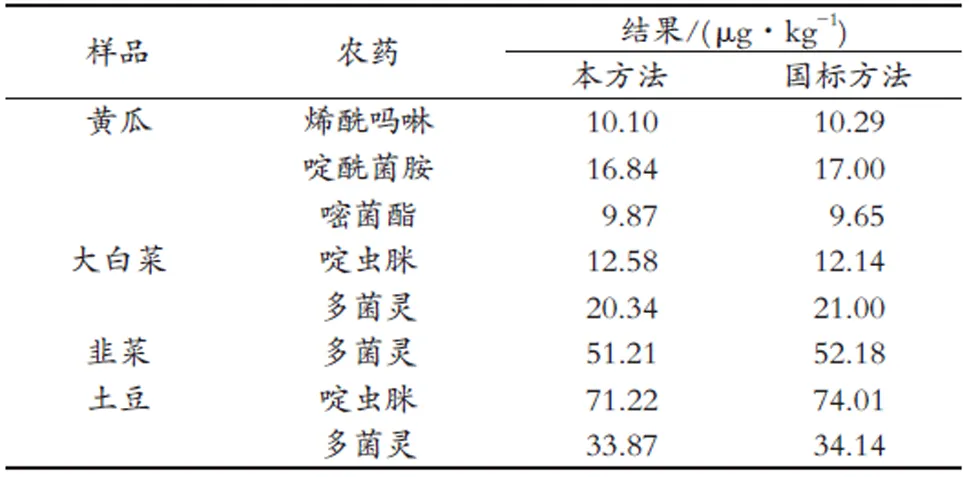
表2 实际阳性样品检测结果
3 结论
试验以QuEChERS前处理技术结合高效液相色谱-四极杆-飞行时间质谱检测技术,建立了快速筛查蔬菜中32种农药残留的分析方法。利用该方法建立的一级精确质量数据库和二级全扫描质谱信息库,无需标准品即可实现蔬菜中32种农药残留的快速筛选和准确测定。实际样品检验中进一步证明该方法简便、快速、高效、准确可靠,可用于蔬菜质量安全风险评估中多种类农药残留的快速筛查分析,同时也对蔬菜农药残留的监测具有较高的实用价值。

