微凹槽内液滴流场特性的Micro-PIV实验研究
申 峰, 闫成金, 李梦麒, 姬德茹, 刘赵淼,2,*
(1. 北京工业大学 机械工程与应用电子技术学院, 北京 100124; 2. 北京工业大学 现代工程力学研究所, 北京 100124; 3. 北京工业大学 先进制造技术北京市重点实验室, 北京 100124)
0 引 言
微液滴能够为细胞培养提供独特的微环境,具有流体剪应力低、避免细胞间交叉污染、可精确操控微环境等优点[1-3]。近年来,液滴微流控技术已成为细胞培养和生化特性分析的新平台,在医疗诊断、新药物开发和肿瘤细胞分析等领域显示了广泛的应用前景[4-6]。Brouzes等[7]利用液滴微流控技术实现了细胞高通量筛选。Lee等[8]进行了液滴的生成、捕获与操控研究,并利用液滴包裹和培养细胞。Pan等[9]观测了微液滴包裹的微藻类细胞随时间变化的增殖情况。Liu等[10]开发了一种基于微凹槽结构的微流控芯片装置,具有低的流体剪应力环境,可用于细胞的长时间培养。Yu等[11]将包裹细胞的液滴捕获于微通道特定位置,观测了多霉素对乳腺癌细胞增殖的影响。
目前,微凹槽内的流场特性对捕获的液滴内部微环境有重要影响,已引起了学者关注[12-13]。Shen等[12]开展了显微粒子图像测速(Micro-Particle Image Velocimetry,Micro-PIV)实验,根据结果定义了微凹槽内部的3种流动形式,即附着流、过渡流和分离流。Yew等[13]利用数值模拟和实验,研究了低雷诺数(Re)下,矩形长凹槽内部流场剪应力和营养物质输运对凹槽底部细胞培养的影响。研究发现,凹槽内为附着流时,营养物质能够到达凹槽底部和细胞进行充分的物质交换,此方法可以模拟细胞在体外培养液中的生存环境,为细胞培养技术提供参考[14]。Liu等[15]利用Micro-PIV实验研究了弯曲通道中液滴内部流场,发现液滴内部存在复杂的涡胞结构,涡胞对液滴内部的剪切变形率有明显影响。
然而,上述文献报道的方法需要液滴生成、捕获、固定等操作步骤,操控过程复杂,且生成的液滴尺寸较小,也不利于长时间的细胞培养。此外,实现液滴内部微环境的精确调控,尚需深入的流体力学研究,比如,液滴内部的涡胞特性、剪应力分布、流场中培养液流动及输运特性等。为了精确调控液滴内的微环境,本文提出了一种基于微通道矩形凹槽生成并封裹液滴的新方法,利用高速显微摄像系统和Micro-PIV系统,研究了Re对微凹槽内液滴形貌及内部流场速度矢量场特性、剪应力分布的影响。
1 实验系统及方法
实验中的微流控芯片如图1(a)所示,包括直的微通道和位于一侧的矩形微凹槽。芯片包含2个入口(1为水相,2为油相)和一个出口。微通道横截面为矩形,宽度W=200 μm,深度H=100 μm。凹槽宽度固定为Wc=600 μm,长度分别为Lc=600、1200、1800和3000 μm等4种,长宽比分别为e=Lc/Wc=1、2、3和5,深度均为H=100 μm。类似的矩形微凹槽结构在文献中已有报道[16-18],而本文中凹槽长宽比更大。芯片材料为聚二甲基硅氧烷(PDMS),利用软光刻技术制作[12]。实验发现,e=1和2时,凹槽内无法生成稳定的液滴;e=5时,液滴内部剪应力不均匀;e=3时,凹槽内更容易封裹生成液滴,实验效果最佳,故本文采用e=3的凹槽。此芯片可在凹槽内部简便地生成、捕获、固定液滴。通过调节微通道入口流量,可精确调控液滴内部微环境,并且微环境内剪应力平均值极低,可实现长时间观测。
实验中采用高速摄像动态显微系统(Keyence,VW-9000)实时观察液滴形貌变化,利用Micro-PIV系统(Dantec Dynamics)测量液滴内部流场速度矢量场。Micro-PIV系统基本包括:双脉冲激光器(Nd:YAG,单脉冲最大值135 mJ,波长532 nm)、高灵敏度CCD相机(HiSense MKII,12 bit,1344 pixel×1024 pixel)、同步控制器、Leica倒置显微镜、图像采集处理系统(Dynamic Studio)和三维电动控制平台(精度为2 μm)等,实物图如图1(c)所示。Micro-PIV是一种整场、瞬态、定量的微流场可视化测量技术,能够在2个脉冲的瞬间记录大量示踪粒子在流场内的分布信息,形成2幅粒子图像,然后对粒子图像进行空间相关性分析,最终得到空间流场的速度分布,并可进一步处理得到流线、涡量以及剪应力分布等[12,15]。实验中观测液滴的z方向中心平面(z=0~50 μm),采用的物镜大倍数为10×,数值孔径NA为0.25,景深约为18.4 μm。根据拍摄的粒子图像亮度,设置的激光器的单脉冲强度为75 mJ,CCD帧率为12帧/s,曝光时间根据入口流速不同其调节范围为80~800 μs。采用自适应互相关算法(Adaptive Cross-Correlation,ACC)进行图像处理,判读区大小设置为32 pixel×32 pixel (50%叠加)。
采用葵花油(密度ρ=0.918 g/cm3,黏度μ=46 mPa·s,表面张力γ=26.3 mN/m)作为连续相,去离子水(密度ρ=0.998 g/cm3,黏度μw=1 mPa·s,表面张力γw=72.8 mN/m)作为离散相。连续相和离散相在PDMS表面的接触角分别为50.5°和98.7°,两相界面张力为25.7 mN/m。实验温度为20 ℃,实验过程中,首先在微通道中充满离散相,然后再以一定的流量通入连续相,使连续相对离散相施加一个大于其界面张力的压力,从而将凹槽内的离散相剪断,完成液滴的生成及捕获[16]。采用中性悬浮的聚苯乙烯红色荧光微球作为示踪粒子(平均直径约为0.86 μm、密度约为1.03 g/cm3,激发波长为532 nm,Duke Scientific)。示踪粒子添加在离散相溶液中,并添加表面活性剂(Tween 20,0.2%V/V),以防止示踪粒子聚集及吸附在微通道壁面,5次叠加的示踪粒子图像如图1(d)所示(Re=16.7)。
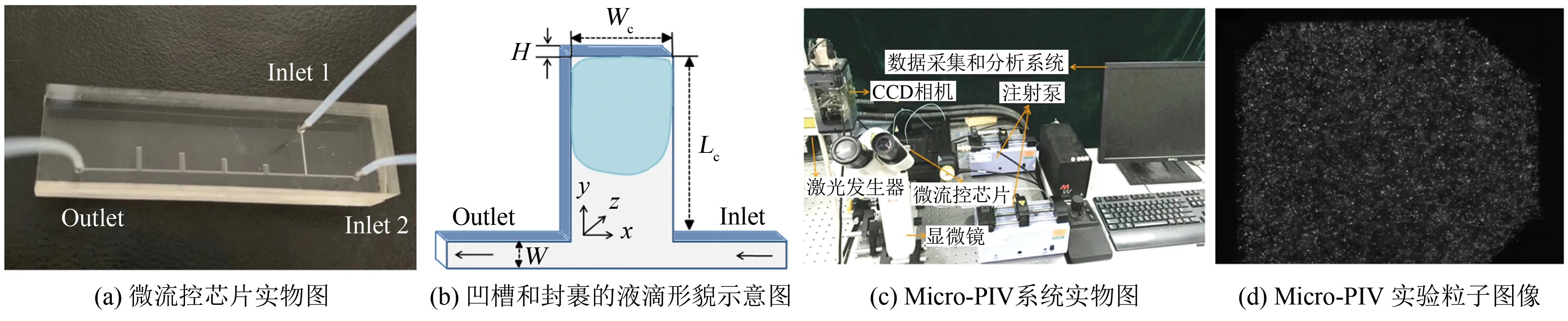
图1 实验系统
入口流量用雷诺数表征为:

(1)
其中,ρ,μ和U分别为连续相流体的密度、黏度和在微通道内的平均流速。微通道的水力直径为:

(2)
液滴内部流场中剪应力计算公式为:

(3)
其中,μw,V和s分别为离散相液滴的黏度、流场速度矢量和相邻速度矢量间的距离,且τ>0。
2 结果与讨论
2.1 雷诺数对微凹槽内液滴形貌的影响
利用高速摄影动态显微系统观察了Re(5.6~55.5)对微凹槽内液滴形貌的影响。随Re增大,凹槽内液滴面积逐渐减小,液滴形状也从最初的长条状开始向圆形转变,如图2所示。当Re=11.1时,液滴总长度为1.6 cm,液滴上侧与凹槽底部边缘接触面积较大,液滴下侧两相界面倾角较大。当Re=22.2时,液滴的长度减小为1.16 mm,液滴上侧与凹槽边缘接触面积明显减少,液滴下侧两相界面变为左右对称状态。当Re=33.3时,液滴长度减小为0.8 mm,为Re=11.1时液滴长度的一半,且液滴形状更加趋于圆形。Re继续增大时液滴面积减小趋势减弱。此外,微凹槽内生成的液滴形貌长时间保持稳定。
推测上述现象的产生是由于PDMS芯片的可变形性所导致的[19]。当Re较大时,微通道内部压力升高,导致微凹槽在深度方向发生扩张。从图2中还可以发现,随着Re从11.1增大到33.3,液滴轮廓线形貌逐渐变宽,颜色变深,证明了液滴在深度z方向尺寸逐渐增加。此外,液滴下侧界面形貌是由连续相流动、两相接触角和液滴界面张力作用共同决定的。当Re=11.1时,由于微通道内的连续相流动方向为从右向左,液滴在压力作用下有被连续相向左上角挤压的趋势,故出现液滴下界面左侧明显大于右侧的现象。随着Re增大,液滴下界面位置上移,连续相流动作用减弱。同时,随液滴z方向深度的增加,液滴界面张力和两相接触角作用逐渐增强,导致液滴更趋于圆形,液滴更加呈现出三维空间形貌特性。此外,随Re增大,液滴上侧界面与凹槽底部2个角所围成的区域内连续相流体体积不断增大。

图2 不同Re下长凹槽内液滴的形貌变化
2.2 雷诺数对微凹槽内液滴流场特性的影响
液滴内部流场特性对细胞培养和营养物质输运有重要影响,利用Micro-PIV测量了不同Re(5.6~55.5)下微凹槽内液滴内部的速度矢量场特性,结果如图3所示。Re=5.6时,液滴内部未观测到涡胞结构,液滴速度最大处位置在液滴下侧界面的右侧区域附近,这是因为液滴内部流动是由连续相流动剪切作用引起的,故两相界面附近区域流速值较高,如图3(a)所示;Re=11.1和33.3时,如图3(b)和(c)所示,液滴内部有明显的涡胞结构出现,且Re=11.1时的涡胞尺寸面积较Re=33.3时大,这是由于Re=33.3时的液滴长度减小所致。Re=44.4时,由于液滴面积减小并向微凹槽底部移动,导致液滴内部涡胞结构消失,液滴内部速度分布相对较为均匀,如图3(d)所示。随着Re从11.1增大到44.4,液滴内部速度最大值位置向液滴下侧中心处移动,且最大速度区域作用面积减小。此外,根据文献[15]报道和图3(d)的流线结果推测,液滴内部流场存在复杂的三维空间涡胞结构。
为得到液滴内部流场在x和y方向的速度分布变化情况,提取了液滴内部x和y方向的速度云图,分别如图4(a)和(b)所示。图4(a)结果表明,除了液滴与连续相接触界面位置附近,液滴内部流场在x方向的速度分布与图3中总速度分布趋势大致相似,但x方向速度梯度比总速度梯度小,x方向速度相对更加均匀。然而,在y方向上,速度分布变化较明显,如图4(b)所示。在Re=11.1和33.3时,液滴内部形成涡胞,涡胞左侧y方向相对高速流场区域较大,可以驱动液滴内部流动形成涡胞。而在Re=5.6和44.4时,涡胞左侧y方向高速区域较小,不足以驱动液滴内部流动形成涡胞。以上结果表明,液滴内部涡胞结构的形成是由于流场y方向速度梯度较大所致。

图3 Micro-PIV测量的不同Re下液滴内部流线图及速度云图
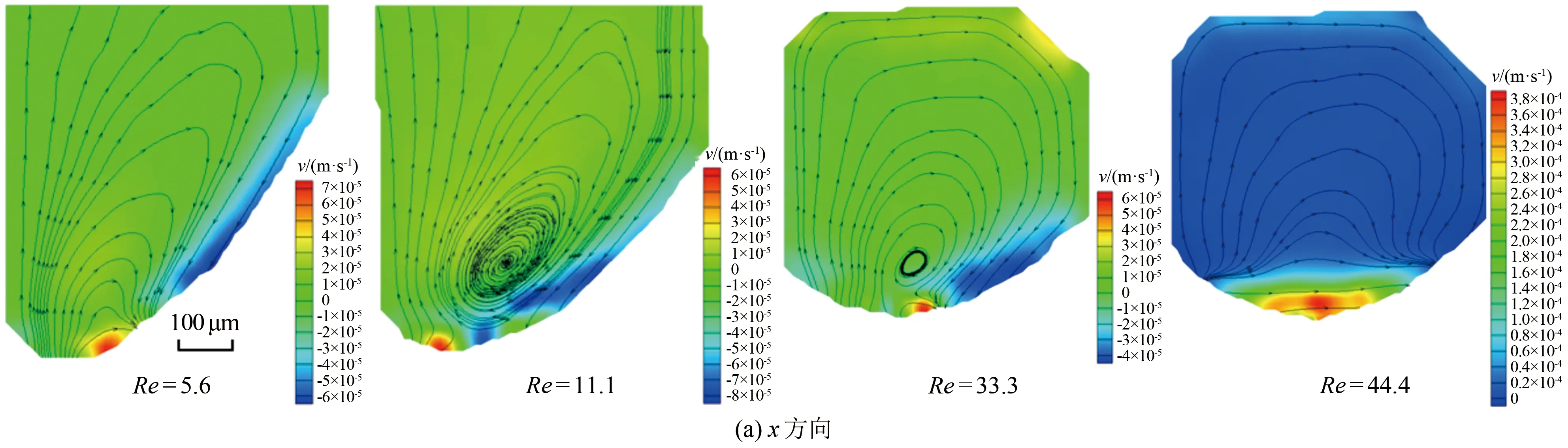

图4 Micro-PIV测量的不同Re下液滴内部x和y方向的流场及速度云图
提取了液滴内部涡心竖线位置的速度值,如图5所示。当Re=16.7和22.2时,液滴内部平均流速随Re的增大而增大;Re=33.3时,液滴内部平均流速达到最大值,约为10 μm/s;Re=44.4和55.5时,液滴内部平均流速随Re的增大而减小。结果表明,涡胞产生时,液滴内部平均速度增大,加快了液滴内部的物质输运。
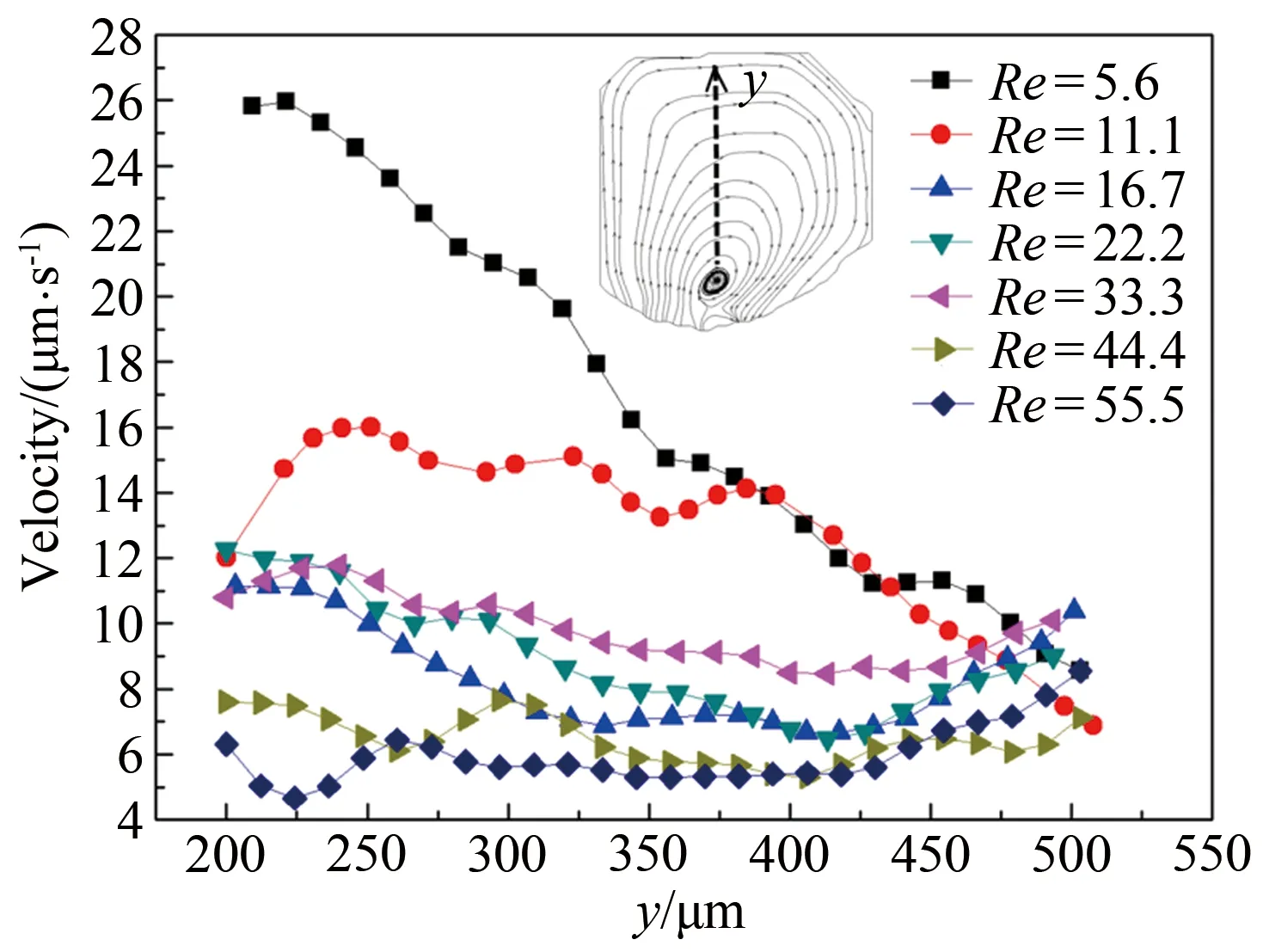
图5 提取的不同Re下长凹槽液滴内竖线位置的流速分布
Fig.5 The velocity distributions along the line across the droplet in the long microcavity for differentRe
2.3 雷诺数对液滴内部剪应力分布的影响
剪应力(τ)是影响细胞活性和微环境的重要因素之一,根据实验结果提取了不同Re下液滴内部流场剪应力分布云图,如图6所示。Re=16.7时,剪应力较大的位置在涡心下侧及液滴与连续相接触界面附近;随Re的增大,液滴内部的剪应力分布趋于均匀;当Re=44.4和55.5时,液滴内部涡胞消失,液滴下侧出现低剪应力区。
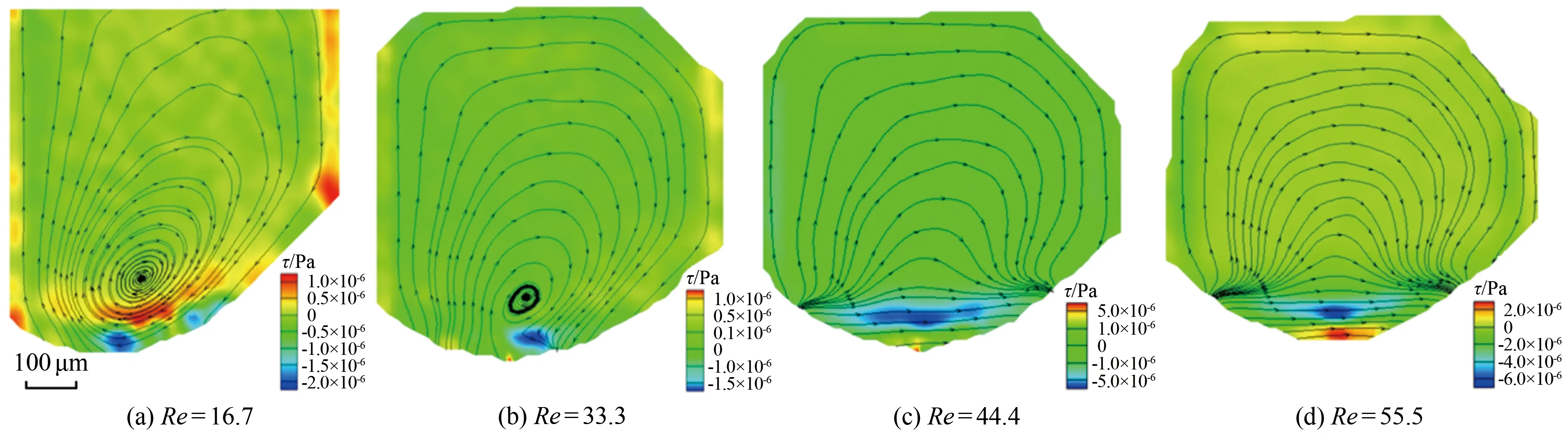
图6 不同Re下的长微凹槽液滴内部流场结构及剪应力分布云图
为了进一步的量化分析,提取了液滴内部涡心竖线位置的剪应力值,如图7所示。结果表明,液滴内部剪应力值分布整体较为均匀且变化微小,入口Re对液滴内部平均剪应力无明显影响。同时,液滴内部整体剪应力τ平均值小于1.5×10-4Pa,远低于细胞活性的剪应力承受值(1.0 Pa)[20]。研究结果表明液滴内部存在较低的剪切力环境,利于长时间的细胞培养与分析。
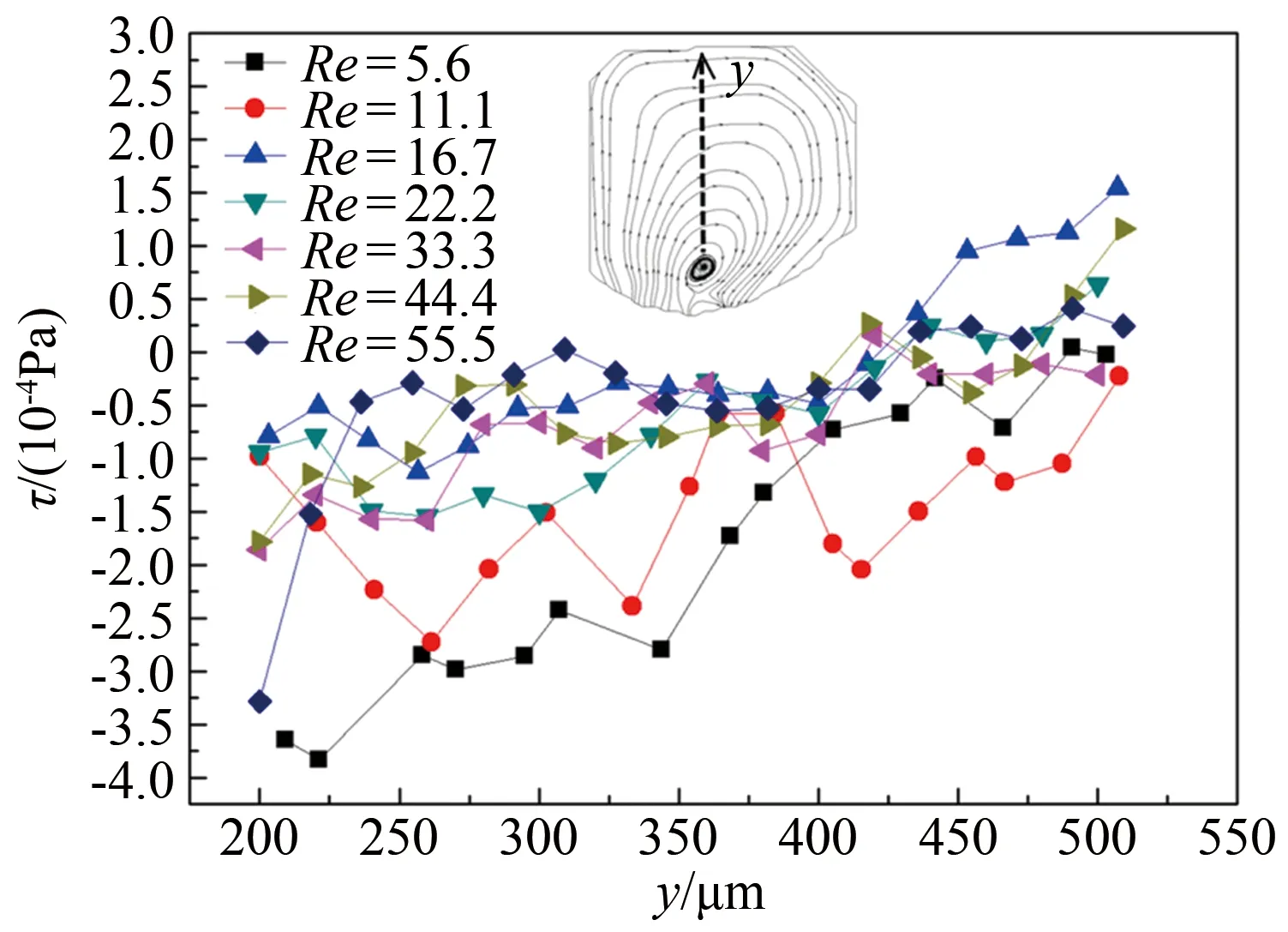
图7 Micro-PIV测量的不同Re下长凹槽内部压力
3 结 论
本文利用微流控技术在微通道矩形长凹槽内生成固定的液滴,并对其内部流场进行了Micro-PIV测量,研究了不同Re(5.6~55.5)下的液滴形貌特性、内部速度矢量场和剪应力分布的变化。结果表明,长微凹槽可以容易地生成并固定液滴,且随着Re的增大,液滴面积逐渐减小;同时,在连续相流动剪切作用下,液滴内部流场出现涡胞结构,涡胞随Re的增大呈现从无到有再到无的变化规律;此外,液滴内部剪应力τ较小(平均值<1.5×10-4Pa),且Re对τ无明显影响。以上结果表明微凹槽液滴可提供稳定、均匀、可精确调控的微环境,为长时间的细胞培养及分析提供新思路。

