特异性GTP酶YchF及其在蛋白质生物合成中的功能研究进展
巴巧瑞,王弋博,焦成瑾
(天水师范学院 生物工程与技术学院,甘肃 天水 741001)
YchF是E.coli中的一种普遍保守的ATP酶,由ychF基因编码。[1]比较基因组研究发现,YchF同源物存在于所有测序的基因组中,且广泛分布于原核生物、真核生物以及古菌中。这表明活细胞中YchF样蛋白可能具有基本且重要的功能。[2]大肠杆菌基因组中,ychF与Pth(肽酰tRNA水解酶)共转录,Pth是水解肽酰tRNA的酶,它可催化释放tRNA。[3]实验证明YchF水解ATP的效率远高于GTP。但根据结构,其被归为TRAFAC(翻译因子相关)家族,这一家族成员为普遍保守的GTP酶,功能均与核糖体合成蛋白质相关,表明YchF可能也参与蛋白质生物合成过程,且由于特殊的水解活性,很可能在一些特殊的情况下行使自身功能,例如氧化应激等。在人体中,核糖体异常通常可导致多种疾病的发生,且ATP酶是非常具有吸引力的药物靶点。[4]因此,揭示YchF与核糖体的相互作用能补充核糖体生物学相关研究,并有助于开发治疗因核糖体异常所导致疾病的药物。
YchF同源物之间的序列十分相似,例如,大肠杆菌YchF与人源类似Obg家族G蛋白的ATP水解酶1(human Obg-like ATPase 1,hOLA1)蛋白在组成上,45%的氨基酸完全相同并且一半以上的氨基酸具有相似性,强烈暗示了这两种蛋白质在功能上具有保守性。[5]据报道敲除hOLA1能抑制乳腺癌细胞迁移与增殖,[6]同时细胞对活性氧(ROS)的抵抗力更强。此外,在许多肿瘤细胞中发现hOLA1表达上调,这也表明靶向YchF/OLA1可能对肿瘤有潜在的治疗作用。然而,YchF/OLA1在细胞内的生物学作用仍待进一步研究。[7]
YchF/OLA1的普遍保守性表明了该蛋白质在细胞中可能具有非常基础且重要的功能,[2]但ychF的缺失对人类、枯草芽孢杆菌或大肠杆菌都有一定但并不致命的影响。[6,8]Fernebro发现肺炎链球菌ychF缺失株表现出一定的生长缺陷,[9]在大肠杆菌中,∆ychF菌株则为冷敏感表型。[10]这些观察结果表明,至少在标准实验条件下,YchF/OLA1不参与细胞的基础生命活动。那么YchF作为广泛保守的ATP酶,究竟参与细胞生命的哪些作用呢?
1 YchF的蛋白质结构
YchF的第一个晶体结构来自裂殖酵母(Schizosaccharomycespombe),于2003年发表。[11]随后,流感嗜血杆菌(Haemophilusinfluenza)YchF、嗜热菌(Thermusthermophiles)YchF和hOLA1晶体结构相继被解析。[11-12]在这些来自不同生物体的蛋白质中,不仅在保守的G结构域(G-domain)内,而且在其他两个结构域内都观察到了结构的高度相似性。[13]YchF由三个不同的结构域组成。N-端的G结构域是P-环ATP/GTP酶的典型结构域,其后是一个假定的α-螺旋-螺旋结构域(A-domain),最后是C-端TGS结构域(ThrRS,GTP酶,SpoT)(图1)。这三个结构域通过松散的多肽链连接,形成一个蟹钳状结构,在A结构域和TGS结构域之间有20Å的间隙。这种特殊的结构对于YchF/OLA1蛋白质家族来说似乎是独一无二的。[12]一般来说,蛋白质是由有限数量的结构域构成,新结构域的出现可以很好地预测蛋白质功能。[14]因此,研究单个结构域的特征和包含这些结构域的蛋白质功能将为预测可能的YchF功能提供有用信息。
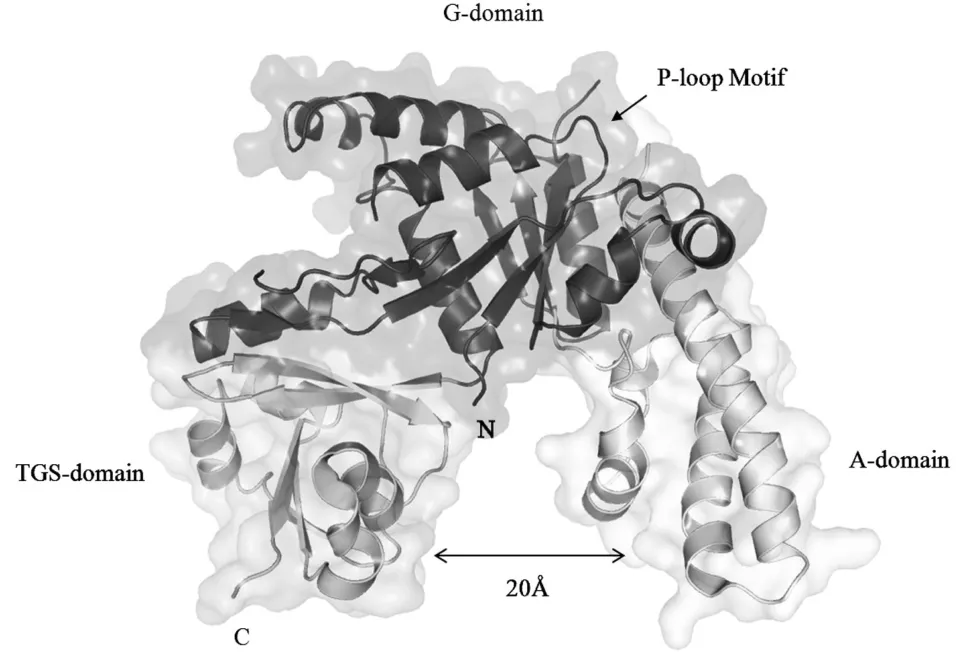
图1 流感嗜血杆菌YchF的晶体结构
1.1 P-环GTP酶
由于在N端具有GTP结合域(G结构域),因此YchF首先被归类为P-环GTP酶,是一组能够结合并水解鸟苷三磷酸(GTP),生成鸟苷二磷酸(GDP)的蛋白质。[15]它们在细胞中通常充当分子开关,触发下游蛋白质的作用,进而调节各种重要的细胞过程,如信号转导、蛋白质合成和转运以及核糖体生物合成。[14]结构保守的G结构域由六个平行的β折叠片组成,被α螺旋包围,在许多核苷酸结合蛋白中都可以发现这样的结构。[16]在序列水平上,G结构域具有几个保守的序列模体(G1-G5),并存在于所有的P环GTP酶中。G1模体(GXXXXGKS)也被称为Walker A或P-loop模体,它的作用是在催化中心内定位核苷酸三磷酸。G2〔X(T/S)X〕和G3(DXXG)模体(Walker B)协调Mg2+结合。这两个模体也被称为开关I和II,可以通过构象变化激活下游蛋白质;在GTP酶的同一个亚家族中两个模体都很保守。[17]基于G结构域中保守的序列模体和结构模体,P环GTP酶可分为两大类:TRAFAC(翻译因子)类和SIMIBI(信号识别颗粒)类。[18]除了保守的P-环G-结构域外,P-环GTP酶还包含一个或多个额外的结构域。根据这些额外结构域的序列和结构特征,P-环GTP酶又被细分为4个超家族、8个家族和13个子家族。YchF亚家族属于TRAFAC类Obg(spo0B相关GTP结合蛋白)家族。YchF亚家族成员不同于其他GTP酶,因为它们倾向于水解ATP而不是GTP。[17-18]据报道,hOLA1(人)、YchF(大肠杆菌、流感嗜血杆菌)、OLA1p(酿酒酵母)和TcYchF(T.cruzi)都具有更高的水解ATP效率而不是GTP。[19-21]有人认为这种核苷酸特异性的改变可能是由于YchF的G4模体中保守的赖氨酸和天冬氨酸残基的变化。然而,将hOLA1G4模体(NLSE)回复到之前的GTP酶模体(NKXD)并不会改变易于水解ATP的特异性。[13]另有报道YchF样蛋白在G3模体下游缺乏催化性的组氨酸/谷氨酸,而这两个氨基酸的存在也是蛋白质具有GTP酶活性的关键。[22]因此,YchF类蛋白易于水解ATP的特异性还可能来自G3模体后组氨酸/谷氨酸的缺失而不仅仅是G4模体序列的改变。
1.2 具有G结构域的YchF归属于GTP酶家族
在真核生物、细菌和古细菌中存在一组普遍保守的GTP酶,包括IF-2、EF-Tu、EF-G、Ffh、Ft-sY、YihA、HflX和YchF,其中IF-2、EF-Tu和EF-G是翻译因子超家族成员。[23-25]Ffh和FtsY分别是细菌信号识别粒子蛋白及其受体,参与蛋白质靶向调节。[26]YihA参与细胞周期调节,并被证明在核糖体生物合成过程中对50S亚基的成熟起重要作用。[27]据报道,HflX与肺炎支原体和大肠杆菌50S核糖体亚基相互作用,被认为在核糖体组装中具有特定功能。[28]这些普遍保守的GTP酶既是翻译所必需的(IF-2,EF-Tu,EF-G),也是核糖体生物发生过程中需要的(YihA,HflX),更是靶向共翻译蛋白所必需的(Ffh,FtsY)。因此推测:YchF/OLA1也具有与核糖体相关的功能。
1.3 YchF的卷曲螺旋结构域(A结构域)和TGS结构域
YchF/OLA1的晶体结构揭示了蛋白质还具有一个由两个长α-螺旋构成的α-卷曲螺旋结构域。该结构域与转录延伸因子(GreA)、RNA聚合酶(DksA)和seryl-tRNA合成酶(SerRS)中发现的卷曲螺旋结构域具有高度相似性。[29-32]GreA诱导停滞转录复合物中新生转录物的3'-端断裂,以重新释放被抑制的复合物,因此其作用在概念上类似于Pth在失速核糖体中的挽救作用。[32]DksA是转录调控的重要组成部分,作为对细胞中ppGpp积累的响应,它抑制rRNA、部分核糖体蛋白和tRNA的转录。GreA和DksA都直接与RNA聚合酶(RNAP)相互作用,将其卷曲的螺旋结构域插入RNAP的二级通道,使结构域的顶端接触转录物的3'端并诱导链的断裂。[30]与GreA和DksA不同,SerRS的卷曲螺旋结构域与SertRNA的可变臂和TΨC环接触,从而介导受体茎环的定位。[31]总之,结构上相关的卷曲螺旋结构域似乎与RNA的结合和质量控制有关。
TGS结构域(ThrRS、GTP酶和SpoT)是一个由约50个氨基酸组成的小结构域,可折叠成5条β-链和2到3条α-螺旋。[33]YchF和ThrRS(苏氨酸-tRNA合成酶)TGS结构域具有高度的相似性,但ThrRS的TGS结构域不参与tRNA结合。[34]流感嗜血杆菌YchF的TGS结构域显示出保守的氨基酸残基序列,这些保守序列形成一个连续的带电荷的区域,理论上易于结合RNA。[12]但是目前还缺乏RNA结合的实验证据。总之,YchF中卷曲螺旋结构域和TGS结构域的存在,表明此蛋白质可能在RNA和蛋白质相互作用中起特定作用。
2 YchF/OLA1在核糖体蛋白质合成中的潜在功能
有研究发现YchF可能在核糖体组装或核糖体功能中具有一定的作用。YchF表达会因DNA损伤而下调,这意味着YchF蛋白可能在蛋白质生物合成过程中有一定的作用。[35]在许多大肠杆菌中,ychF与Pth共同转录,Pth编码Pth(肽酰tRNA水解酶),它水解肽酰tRNA释放游离的tRNA,从而维持细胞内tRNA水平的稳定。[36]在大肠杆菌中,Pth的mRNA在没有ychF的情况下不能稳定存在。[1]表明这两种蛋白之间可能存在关联,并暗示了YchF在翻译中的作用。在水稻上的研究显示OsY-chF1的TGS结构域在体外与26S rRNA结合,间接支持OsYchF1和核糖体相互作用,说明YchF参与蛋白质的翻译过程。[37]最近,在大肠杆菌体内发现了YchF能够与50S和70S核糖体亚基分别结合,并且YchF的ATP酶活性在体外受到70S核糖体的激活。[19-20]Feng提出了一个解释YchF参与核糖体活性的机理模型:首先,YchF需要和ATP结合形成二元复合物YchF·ATP,然后才能与70S核糖体结合,而70S核糖体作为一种激活剂,刺激YchF的ATP酶活性,使得ATP水解为ADP,之后YchF·ADP离开70S核糖体重新循环生成YchF·ATP,以进行下一轮核糖体结合(图2)。该模型说明了YchF以ATP介导的方式调节70S核糖体的功能。[16,19]然而,YchF与核糖体结合的生理学机理还不明确。在细胞中,许多GTP酶直接与核糖体亚单位结合,并作为核糖体生物合成启动因子在核糖体组装过程中招募核糖体蛋白质。[8,38]或许,隶属于GTP酶家族的YchF也具有相似的功能?
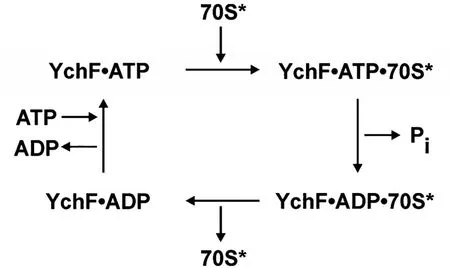
图2 YchF参与核糖体生物学功能的模型
3 蛋白生物合成的影响因素
核糖体是一种高度复杂的细胞机器,根据mRNA上编码的遗传信息合成蛋白质。而蛋白质是完成多种细胞功能所必需的重要大分子。因此,翻译精度是细胞适应环境的一个基本因素,关乎细胞的存亡大事,所以细胞会对蛋白质合成这一重要生命活动所必需的控制体系进行精确地调控。[39]例如,细胞往往在几个点上控制蛋白质翻译的准确性,在源头上通过相应的氨基酰tRNA合成酶对tRNA和氨基酸进行特异性连接,从而减少错误氨基酸的引入;[40]在合成过程中,成功识别释放因子和终止密码子减少过早终止和过晚终止。[41]然而,生物个体不可避免地暴露在不利的环境条件下,如氧化应激。当细胞受到压力时,由于RNA和蛋白质关键翻译元素的氧化和不可逆修饰,蛋白质合成不能像正常情况下那样精确。氧化的mRNAs不能正确翻译,导致蛋白质产量下降和蛋白质正常功能丧失。[42-43]有研究表明,真核细胞mRNAs的氧化可导致核糖体失速加剧和蛋白质翻译速度降低。在氧化应激下,Glu-tRNA可被氧化,Phe-tRNA的结合亲和力显著降低。[44]另一方面,与mRNA和rRNA相比,tRNA受氧化应激的影响较小,因为tRNA与ROS的结合比rRNA低,氧化应激对tRNAs的有害影响更多的是通过相应的tRNA合成酶,有些tRNA合成酶可能部分或完全失活,导致蛋白质误译。[45]
在整个生命周期中,细胞需要对环境变化做出灵活的应激反应,因此,细胞需要复杂的传感和信号转导系统。这些系统通过调节细胞生理反应以响应环境信息和内部信号,保证细胞在变化多端的环境中生存下去。应激反应涉及基因表达的调控、代谢调控和酶活性的改变。通常温度发生变化时,细胞选择性诱导热休克蛋白,而面对氧化应激时则表达抗氧化酶。[46-47]此外,除了上调应激蛋白之外,还可以下调其他蛋白质从而增加细胞在应激时的适应能力,保证细胞的存活。综上所述,在大肠杆菌中,当细胞遇到氧化应激时,YchF被下调,而敲除YchF则促进氧化应激条件下的细胞存活。[21,48]在YchF的真核同源物中,OLA1的敲除导致细胞对氧化应激的抵抗力增强;在人类细胞中,hOLA1通过将延伸起始因子eIF2转化为GDP结合状态从而抑制蛋白质合成,促进细胞在应激状态下的生存。[49-50]hOLA1在应激条件下的特异反应使它成为肿瘤或癌症治疗中的潜在药物靶点。然而,有关YchF及其同源蛋白在细胞内蛋白质生物合成调控方面的分子机制还有待进一步研究。真核生物相较于原核生物具有庞大的基因组和复杂的调控网络,因此,首先在相对简单的模式生物——大肠杆菌中确定YchF在蛋白翻译和应激反应中的确切分子功能。再将结果转移到哺乳动物细胞中,有助于更好地揭示YchF/OLA1与癌症以及由核糖体导致的疾病之间的联系。
4 展望
结合YchF的结构以及目前的研究结果,建议未来对YchF的研究从以下几个方面进行:(1)YchF是TRFAC家族GTP酶中的一员,其中许多蛋白参与核糖体的生物发生和组装。因此,首先分析野生型和ychF缺失菌株中核糖体浓度、核糖体组装情况是必要的。可利用蛋白免疫沉淀检测核糖体大、小亚基蛋白来检测细胞内核糖体浓度。通过绘制YchF表达或者缺失菌株中核糖体的分布曲线,并与野生型菌株进行比较,可明确YchF对核糖体组装是否有显著影响。(2)ychF缺失菌株虽然可以存活但表现出一定生长缺陷,这可能是蛋白质合成障碍所导致的生长迟缓。因此建议测定不同YchF浓度下,活体细菌体内蛋白质合成水平。

