藻蓝蛋白的性质和提取技术研究进展
俞丽燕
(福建师范大学生命科学学院,福建 福州 350108)
藻蓝蛋白(Phycocyanin, PC)是一种重要的藻胆蛋白,具有吸收和传递光能的性质,呈亮蓝色,属于胞内蛋白,易溶于水,具有抗肿瘤、增强免疫力、抗炎等功能[1]。在食品工业可作为天然着色剂和营养保健品开发;在化妆品行业作为添加剂开发;在制药工业也具有巨大潜力待挖掘开发[2]。随着科学技术的进步,藻蓝蛋白分离纯化技术不断更新迭代,其产品质量和经济性提升迅速,使开发应用领域渐受各方产业和学者关注。为此,本文将综述微藻藻蓝蛋白的分子结构与生物学功能以及提取分离纯化工艺的最新进展,以期为加快藻蓝蛋白在食品、保健品、化妆品、制药等领域产业化进程提供依据。
1 微藻藻蓝蛋白的分子结构与生物学功能
1.1 微藻藻蓝蛋白的分子结构
藻胆体(Phycobilisome, PBS)存在于微藻细胞内,是重要的光收集复合体(Light harvesting complex,LHC),主要吸收黄绿光区的光源,由多种不同颜色水溶藻胆蛋白(85%~90%)和连接多肽(15%~10%)链接而成,主要分为2部分:核心复合物位于中心,棒状复合物则在中心周围[3]。藻胆体(PBS)是由不同的藻胆蛋白(Phycobiliproteins, PBP)按特定的排列顺序组装而成,吸收的光能依次通过藻红蛋白(Phycoerythrin, PE)、藻蓝蛋白(Phycocyanin,PC)和别藻蓝蛋白(Allophycocyanin, APC)传递,最后传递到反应中心光系统I(光系统I, PS I)和II(光系统II, PS II)(图1[4])。
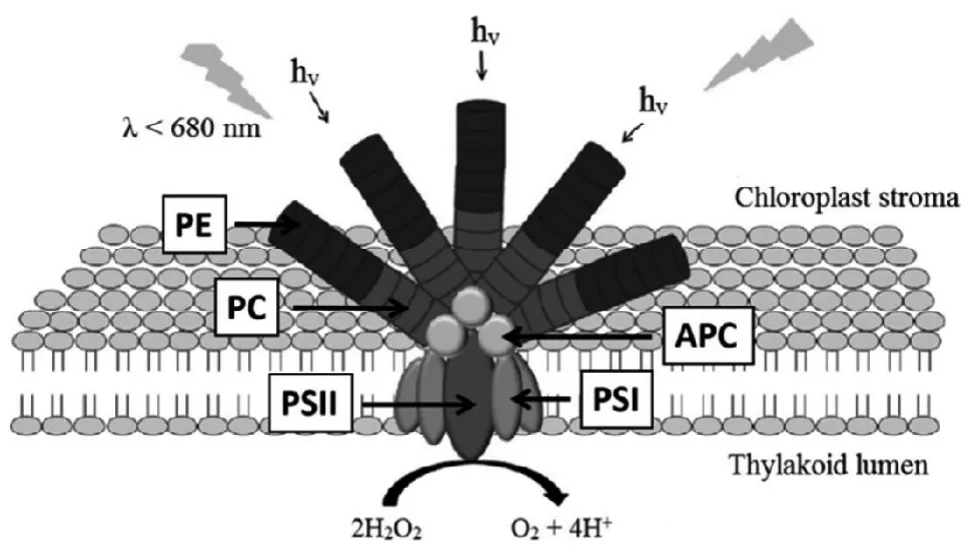
图1 微藻藻胆体(PBS)结构和生物功能模型[4]
C-藻蓝蛋白(C-Phycocyanin, C-PC)来源于蓝藻,R-藻蓝蛋白(R-Phycocyanin, R-PC)来源于红藻以及R-藻蓝蛋白2(R-Phycocyanin II, R-PC 2)来源于聚球藻是藻蓝蛋白(PC)的主要类型[5]。α-亚基,含两个半胱氨酸和两个甲硫氨酸残基,分子量约为12~19 kDa;β-亚基,含三个半胱氨酸和五个甲硫氨酸残基,分子量约为14~21 kDa,是构成藻蓝蛋白(PC)的两种基本单元,每种亚基含有160~180个氨基酸序列[6,7]。αβ单体(图2a[8])是由α,β两个亚基自行组装形成,α3β3环状三聚体(由αβ单体组装形成)(图2b[8])和α6β6六聚体(两个α3β3三聚体堆积而成)(图2c[8])是藻蓝蛋白的存在主要形式,直径约11 nm[8]。藻蓝蛋白的发色团是藻蓝素(图3[4])—一种线性四吡咯化合物,通过硫醚键与载体蛋白连接[9]。
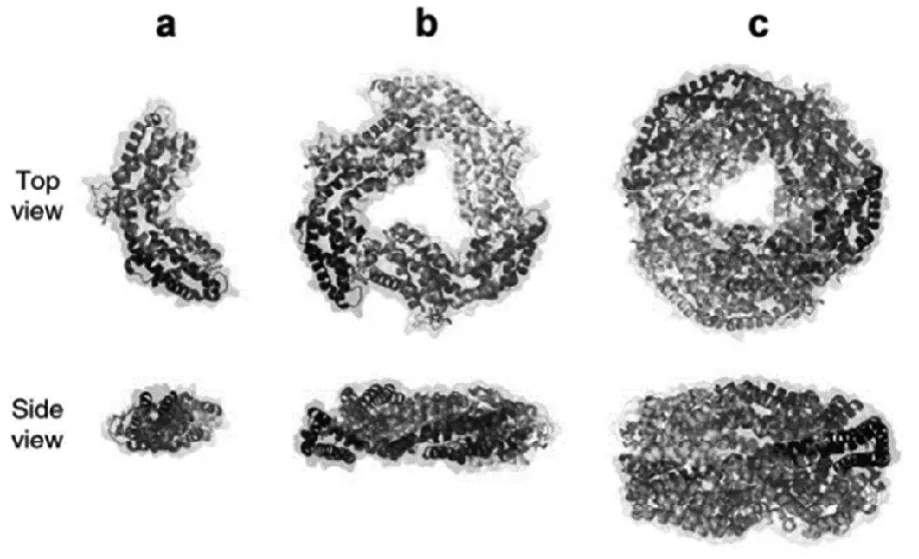
图2 PC的组成单位及基本结构[8]

图3 藻蓝素的分子结构式[4]
1.2 微藻藻蓝蛋白的生物学功能
藻蓝蛋白具有抗氧化活性,有研究表明,藻蓝蛋白能够调节由自由基的清除和产生引起的代谢紊乱,而自由基是许多疾病的发生有直接或间接的联系。藻蓝蛋白的抗氧化活性与抗炎、保护肝脏、清除白内障、保护血管、神经保护以及预防肿瘤等有关[10]。梅邢等[11]使用ABTS+·法、铁离子还原/抗氧化能力法(FRAP法)、邻苯三酚自氧化法以及氧自由基吸收能力法(ORAC法)比较了市场上5种不同藻蓝蛋白的抗氧化活性,结果表明,在不同测定方法不同体系中,藻蓝蛋白抗氧化活性与其纯度、色基含量、蛋白质含量三者有一定相关性。
藻蓝蛋白具有抗肿瘤功能,能够抑制人结肠癌SW480细胞增殖[12]、诱导人喉癌HEP-2细胞凋亡[13]、抑制肺癌A549细胞[14]、抑制肺癌LTEP-a-2细胞生长[15]、诱导非小细胞肺癌H1299细胞凋亡且抑制该细胞生长和迁移[16]等。藻蓝蛋白在抗肿瘤中的应用,通常具有单独作用和联合其他药物的作用,其可联合光动力疗法、联合全反式维甲酸以及联合药物等用于癌症治疗[17]。
藻蓝蛋白具有抗炎活性,余佳等[18]通过实验研究发现100μg/mL藻蓝蛋白能显著抑制小鼠巨噬细胞RAW 264.7细胞增殖,一定剂量的藻蓝蛋白能抑制脂多糖诱导RAW 264.7细胞分泌NO和TNF-α。
藻蓝蛋白除了具有抗氧化、抗肿瘤和抗炎生物功能外,还具有免疫调节活性[1]、抗辐射、促进细胞生长以及神经保护等生物学功能[19]。
2 藻蓝蛋白的提取与纯化
2.1 细胞破碎工艺
细胞破碎工艺的选择直接影响藻蓝蛋白提取效率、空间构象、稳定性等,选择成本低、效率高、损失少的细胞破碎工艺是提取分离纯化至关重要的环节。选择适宜的方法破碎细胞壁后,使用水或盐缓冲液作为提取液,提取液的选择需确保大部分藻蓝蛋白能溶解在提取液中且尽可能减少杂质的溶解,既得藻蓝蛋白粗提液[2]。目前细胞破碎主要采用:反复冻融、超声波、微波、化学试剂处理、酶解、溶胀、匀浆、超细剪切和研磨等方法[20-22]。Yu[22]以C-藻蓝蛋白的提取率为评价标准,比较不同工艺的效用,结果显示溶胀-超细剪切-超声波处理的藻细胞藻蓝蛋白提取效率最高。
2.2 色素蛋白提取工艺
色素蛋白的提取是为了提高藻蓝蛋白回收率,为分离纯化做铺垫,提取剂对回收率、活性有直接影响,选择适宜的提取剂对藻蓝蛋白产业化开发具有重要的意义。Silveira等[23]研究蒸馏水、10 mmol/L磷酸钠缓冲液(pH 7.0)、10 mmol/L醋酸钠缓冲液(pH 5.0)、0.15 mol/L的NaCl、10 g/L的CaCl2溶液5种提取剂提取藻蓝蛋白,评价提取效率。结果显示,蒸馏水是一种有效的提取剂,因其成本低,且最优条件下藻蓝蛋白提取浓度达3.68 g/L。Moraes等[24]以蒸馏水为提取剂,使用干燥、冷冻、研磨等方法控制细胞生物质颗粒直径大小0.106~0.125 mm,料液比为0.16∶1,无搅拌,25 ℃,提取时间为1 h,该工艺操作简单、成本低可用于C-藻蓝蛋白规模化提取。
2.3 分离纯化工艺
藻蓝蛋白分离纯化工艺包括盐析、色谱分离和萃取等,依据不同的用途,选择合适的分离纯化工艺,以确保藻蓝蛋白的纯度适用于应用开发。其中纯度根据A620/A280的比值划分为以下几种等级:食品级(A620/A280≥0.7)、反应级(A620/A280≥3.9)、分析级(A620/A280≥4.0)。
2.3.1 盐析法
盐析是在藻蓝蛋白粗提液中加入一定浓度的无机盐溶液(如硫酸铵、柠檬酸三铵盐、磷酸钠、柠檬酸钾和氯化铵溶液)[25,26],使水化层或者电荷遭到破坏,藻蓝蛋白凝聚析出,其中硫酸铵盐析沉淀常被用于藻蓝蛋白分离纯化。Maria Kissoudi等[27]使用不同饱和度的硫酸铵盐溶液,对螺旋藻藻蓝蛋白粗提液进行一步盐析和两步盐析,发现硫酸铵饱和度为50%一步盐析处理螺旋藻藻蓝蛋白粗提液后,获得食品级藻蓝蛋白,其纯度为1.28;硫酸铵饱和度为70%一步盐析处理螺旋藻藻蓝蛋白粗提液后,获得食品级藻蓝蛋白,其纯度为1.36。硫酸铵饱和度为25%~50%两步盐析处理螺旋藻藻蓝蛋白粗提液,获得食品级藻蓝蛋白,其纯度为1.48;硫酸铵饱和度为25%~70%两步盐析处理螺旋藻藻蓝蛋白粗提液,获得食品级藻蓝蛋白,其纯度为1.81。结果表明:硫酸铵饱和度为25%~70%两步盐析处理螺旋藻藻蓝蛋白粗提液后获得的藻蓝蛋白纯度最高。
2.3.2 色谱法
色谱法是一种操作方便,易于藻蓝蛋白工业化应用的分离纯化工艺,其原理是藻蓝蛋白在固定相和流动相之间分配平衡的过程。
⑴ 羟基磷灰石柱层析法(Hydroxyapatite column chromatography, HA柱层析)
羟基磷灰石(Hydroxyapatite, HAP)是骨骼的成分,分为天然或人工合成2种,微溶水,弱碱性,分子式为(Ca5(PO4)3OH)2,是一种磷酸钙晶体,用于分离纯化藻蓝蛋白具有良好的选择性[28]。Serena Benedetti等[29]在硫酸铵饱和度为50%下对水华束丝藻藻蓝蛋白粗提液中的藻蓝蛋白进行沉淀后,置于2.5cm×25cm的羟基磷灰石柱中,用pH 7.0钠磷酸盐缓冲液洗脱,离子强度从5 mmol/L增加到150 mmol/L,纯化后得到分析级藻蓝蛋白,其纯度为4.7。于淑坤等[30]将硫酸铵溶液沉淀后获得的钝顶螺旋藻藻蓝蛋白经过1.6 cm×20 cm羟基磷灰石柱分离纯化,经不同离子强度的磷酸盐缓冲液梯度洗脱,纯化后得到食品级藻蓝蛋白,其纯度最高可达到2.1。
⑵ 膨胀床吸附色谱法(Expanded bed adsorption chromatography, EBAC)
膨胀床吸收色谱法是一种能同时对藻蓝蛋白粗提液进行澄清、浓缩和提纯的理想分离技术。Niu等[31]通过该方法获得了纯度为2.87的食品级藻蓝蛋白,工艺流程:先通过0.5 mol/L的硫酸铵溶液沉淀藻蓝蛋白,再利用膨胀床(含苯基-Sepharose吸附剂)进一步纯化。膨胀床吸收色谱法既可以不损失材料,同时还能保持高C-藻蓝蛋白回收,降低了处理成本和时间,可以产业化开发。
⑶ 离子交换色谱法(Ion exchange chromatography,IEC)
阴离子交换色谱法进行纯化藻蓝蛋白,是因为其在弱酸性介质中带有负电荷。Kuei-Hsiang Chen等[32]使用搅拌流化床离子交换色谱法直接从料液比为1∶10高浊度螺旋藻细胞匀浆液中提取C-藻蓝蛋白,经搅拌流化床纯化后得到的食品级藻蓝蛋白,其纯度为3.0、回收率为64.25%。于淑坤[30]经羟基磷灰石柱层析收集到的钝顶螺旋藻藻蓝蛋白样品再经DEAE-Sephadex-A-25柱层析后,纯化得到的分析级藻蓝蛋白,其纯度最大可达5.4。
⑷ 疏水相互作用层析法(Hydrophobic interaction chromatography, HIC)
疏水相互作用色谱是依据藻蓝蛋白粗提液与具有适度疏水性的填料之间的疏水相互作用而纯化藻蓝蛋白。Lauceri Rosaria等[33]将藻蓝蛋白粗提液加入适量的硫酸铵后,装在硫酸铵响应的商用亲水聚偏氟乙烯(PVDF)膜上进行HIC纯化,采用两步HIC法纯化藻蓝蛋白,获得纯度为4.20的分析级藻蓝蛋白,收率为67.0%。
⑸ 凝胶过滤层析法(Gel filtration, GF)
藻蓝蛋白分子大小与其他蛋白间存在差异,因此网状结构的凝胶分子筛可以使藻蓝蛋白与其他物质分离开来,物质在凝胶分子筛中保留时间可以推断出物质的相对分子质量[34,35]。Pinaki Hazra等[36]从红树林分离的蓝藻AP24,用硫酸铵对藻蓝蛋白粗提物进行连续沉淀后,经离子交换层析柱(DEAE-纤维素DE 52)和凝胶过滤层析柱(Sephadex G-100)纯化,提高了藻蓝蛋白的纯度。
2.3.3 萃取法
双水相萃取(Aqueous two-phase extraction,ATPE)是因为藻蓝蛋白在2个水相中溶解度存在差异,因此,在双水相体系中利用藻蓝蛋白在2相中的分配差异将其与其他物质进行分离[37,38]。聚乙二醇-硫酸铵、PEG1450-磷酸盐、PEG2000-酒石酸钾钠等双水相体系常用于藻蓝蛋白的分离纯化[39-41]。
3 展望
虽然近年来藻蓝蛋白的分离纯化已经取得了一定的进展,但适用于大规模的工业生产的关键技术仍有待解决。藻蓝蛋白在食品工业、功能保健品、化妆品、制药工业等领域发展具有较高的应用研究价值,但是在开发过程中,微藻细胞破碎方法、提取分离纯化所用的试剂等都可能影响藻蓝蛋白产品纯度。另外,藻蓝蛋白的稳定性易受温度、pH值、光照强度、离子浓度等因素的影响,如何确保藻蓝蛋白在提取过程中的稳定性也是藻蓝蛋白广泛应用开发的关键。
——以渤海S油田为例

