黄芪甲苷保护嘌呤霉素氨基核苷诱导的足细胞损伤及机制探讨
龚建光 詹慧芳 金娟 赵黎 李一文 何强
310014 杭州,浙江省人民医院/杭州医学院附属人民医院肾脏病科(龚建光,金娟,赵黎,李一文,何强);310058 杭州,浙江大学校医院紫金港校区(詹慧芳)
足细胞是肾小球主要的固有细胞之一,起到维持肾小球基底膜的正常结构、调节肾小球滤过的作用。既往认为,多种以蛋白尿为主要表现的肾小球疾病包括肾小球微小病变、局灶节段肾小球硬化症、膜性肾病、糖尿病肾病等与足细胞的损伤密切相关[1]。尽管很多学者试图寻求足细胞和肾单元再生的技术和方法[2-3],但如何保护足细胞,减少凋亡和丢失仍是众多肾小球疾病的重要治疗策略。黄芪甲苷(astragaloside IV,AS-IV)是黄芪的主要活性成分之一,现代药理研究证明,黄芪甲苷具有抗氧化、抑制心肌细胞凋亡或免疫调节等多重药理学作用,是目前国内外热点研究的免疫调节药,被广泛使用于心脏及肾脏疾病的治疗。研究表明黄芪甲苷可通过下调(transient receptor potential channel 6,TRPC6)来抑制高糖诱导的足细胞凋亡[4],改善肾脏功能。黄芪甲苷还可通过调节TGF-β/Smad信号通路抑制肾小管间质纤维化[5]。最近的研究显示,黄芪甲苷可以通过抑制活性氧的产生来保护棕榈酸诱导的近端肾小管上皮细胞的凋亡[6]。然而,黄芪甲苷对足细胞损伤的影响研究甚少,特别是缺乏关于以肾病综合征为主要表现的原发性肾小球肾炎足细胞损伤研究。因此,本研究利用经典的嘌呤霉素氨基核苷(puromycin aminonucleoside,PAN)诱导的足细胞损伤模型,探讨黄芪甲苷对其的影响及可能的机制,为黄芪甲苷治疗足细胞凋亡相关的肾小球疾病提供理论依据。
材料和方法
一、实验材料和试剂
黄芪甲苷(No.A111275)购于上海阿拉丁生化科技股份有限公司;永生化小鼠足细胞MPC5购自上海复祥生物科技有限公司;RPMI1640培养基(No.SH30027.01)购于美国Hyclone公司;10% FBS(No.10437-028)购自Gibco公司;CCK8(20150520)试剂盒购于上海七海复泰生物科技有限公司;Annexin V-APC Apoptosis Detection Kit试剂盒购于美国eBioscience公司;抗nephrin(No.DF7159)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)(No.AF6281)、p-VEGFR2(No.AF8022)、GIV(No.P51970)、p-GIV(No.GP5801)、Akt(No.AF6259)、p-Akt(No.AF0016)以及β-actin(No.BF0198)抗体均购于Affnity公司;抗podocin(No.ab50339)抗体购于Abcam公司;抗caspase-3和cleaved caspase-3(No.66470-2-Ig)抗体购于Proteintech公司;Cy3标记的羊抗兔IgG二抗(No.BA1032)购于Boster公司;HRP标记的羊抗兔二抗购自上海碧云天生物技术有限公司。
二、方法
1.细胞培养和分组 MPC5细胞于33 ℃扩增性培养:用含γ-IFN的10% FBS RPMI-1640培养基培养细胞,传代比例1∶4。足细胞37 ℃成熟性培养:传代前在培养瓶内铺Ⅳ型胶原1.5 mL/25 cm2,培养箱中孵育1 h后用PBS 3 mL/25 cm2洗瓶底后吸出,正常传代细胞,传代比例1∶2。在37 ℃培养10天足细胞分化成熟后,对MPC5进行同步处理24 h(无血清RPMI-1640 培养24 h),进行后续实验分组和操作。细胞根据不同处理分成:Control组、PAN组(50 μg/mL嘌呤霉素氨基核苷处理24 h)、AS-IV组(分别用5 μg/mL、15 μg/mL、30 μg/mL黄芪甲苷处理24 h)、AS-IV+PAN组(先用黄芪甲苷预处理30 min,再行50 μg/mL嘌呤霉素氨基核苷处理24 h)。
2.CCK-8检测足细胞生长活力 实验严格按照操作说明书进行,取对数生长期MPC5细胞,胰蛋白酶消化,稀释细胞使其浓度为1~5×105个细胞/mL,分别取100 μL至96孔板,33 ℃,5% CO2饱和湿度培养分别接种,待细胞贴壁后,分组处理,按1∶10体积比混合Cell Counting Kit-8和无血清的RPMI1640,酶标仪测定450 nm处吸光度(optical delnsity,OD)。以MPC5细胞OD值为参考,计算各组的OD值/ODMPC5×100%的均值为各组的细胞相对存活率。
3.流式细胞术检测细胞凋亡 足细胞凋亡采用annexin V-APC凋亡检测试剂盒检测。用不含EDTA的0.25%胰酶消化细胞,终止消化后收集,1 500 r/min离心5 min,弃去上清,收集细胞;用预冷PBS重悬细胞2次,1 500 r/min离心5 min,洗涤细胞;加入300 μL的binding buffer悬浮细胞;加入5 μL的annexin V-FITC混匀后,避光,室温孵育15 min;再加入10 μL的PI染色,轻轻混匀细胞,于避光条件下室温孵育10 min;流式细胞仪检测分析。
4.免疫荧光法检测足细胞标记蛋白 足细胞用4%多聚甲醛(ProSciTech,No.C004)室温固定15 min,用PBS洗2遍。细胞用50 mM NH4Cl处理10 min,再用含0.3% Triton X-100(Sigma no.T8787)的PBS处理细胞15 min,然后用固定液(含0.2%牛血清白蛋白、0.2%鱼皮明胶、0.1% Triton X-100)固定细胞。细胞加入nephrin(1∶500)、podocin(1∶1000)抗体的固定液,4 ℃共同孵育过夜。接着,样品用PBS冲洗5分钟×2次。然后用Cy3标记的羊抗兔IgG(H+L)二抗(1∶1000)室温孵育2 h。细胞爬片用PBS冲洗后封片。最后用荧光显微镜进行图像的采集。采用image j(v 1.8.0)软件分析荧光强度。
5.Western blot检测VEGFR2/GIV通路及凋亡蛋白 收集各组细胞,PBS洗净,加含PMSF的裂解液(碧云天公司,P0013B),于冰上裂解30 min,充分裂解、离心后取上清,收集蛋白。40 μg蛋白样品和Marker加入SDS-PAGE凝胶上样孔内,先恒压80 V电泳后恒压120 V,用时1.5 h。使用Tanon VE-186转移电泳槽进行转膜。5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。加caspase-3(1∶2000)、cleaved caspase-3(1∶2000)、VEGFR2(1∶1000)、p-VEGFR2(1∶1000)、GIV(1∶1000)、p-GIV(1∶1000)、Akt(1:1000)、p-AKT(1∶1000)、β-actin(1∶1000)一抗4 ℃孵育过夜。TBST充分洗涤,HRP标记二抗(1∶3000)37 ℃摇床孵育1 h,TBST充分洗涤。将ECL试剂中增强液与稳定的过氧化物酶溶液按1∶1比例混匀,滴加工作液于PVDF膜上,凝胶成像仪扫描成像。
三、统计学处理

结 果
一、各组足细胞存活率比较
采用CCK-8法检测各组小鼠肾足细胞药物处理24 h后的存活情况见图1。结果显示与Control组比较,PAN组的细胞存活率显著下降(P<0.05);与PAN组比较,AS-IV(5 μg/mL)+PAN组的细胞存活率的差异无统计学意义(P=0.162);而AS-IV(15 μg/mL)+PAN组、AS-IV(30 μg/mL)+PAN组的足细胞存活率均显著高于PAN组(P<0.05)。说明细胞的存活率随着黄芪甲苷浓度的增加呈增加趋势。但AS-IV(15 μg/mL)+PAN组与AS-IV(30 μg/mL)+PAN组比较,差异无统计学意义(P=0.074)。因此,我们后续的实验采用15 μg/mL黄芪甲苷进行预处理。

注:与Control组比较,aP<0.05;与PAN组比较,bP<0.05图1 CCK8法检测各组足细胞相对存活率的情况
二、各组足细胞凋亡情况比较
我们采用annexin V/PI双染法检测各组小鼠足细胞凋亡情况,Western blot检测各组细胞凋亡标记蛋白caspase-3及cleaved caspase-3变化。流式细胞术的分析结果显示,与Control组比较,PAN组细胞凋亡率显著增加(P<0.05);与PAN组比较,AS-IV组以及AS-IV+PAN组的足细胞凋亡率显著降低(P<0.05);AS-IV+PAN组的足细胞凋亡率显著高于AS-IV组(P<0.05)。在不同的处理组间,足细胞早期凋亡略高于晚期凋亡,详见图2A和图2B。Western blot结果发现,与Control组比较,PAN组的cleaved caspase-3蛋白水平显著增加;与PAN组比较,AS-IV组以及AS-IV+PAN组的cleaved caspase-3蛋白水平明显下降(P<0.05),详见图2C和图2D。
三、各组足细胞标记物表达情况比较
我们采用免疫荧光染色的方法观察各组间足细胞标记物nephrin和podocin的表达情况。nephrin和podocin染色的结果均显示,PAN组的荧光强度显著低于Control组(P<0.05);经黄芪甲苷预处理以后,再行嘌呤霉素氨基核苷处理24 h,nephrin和podocin的荧光强度均出现明显的增强(P<0.05)。而AS-IV组与Control组的nephrin和podocin的荧光强度比较,差异无统计学意义,结果见图3。
四、各组VEGFR2/GIV信号通路蛋白表达情况比较
Western blot检测不同处理组VEGFR2/GIV信号通路蛋白及AKT蛋白水平的变化,结果如图4所示。PAN处理MPC5细胞24 h后,VEGFR2及GIV蛋白的磷酸化水平有所升高,AKT蛋白的磷酸化水平被抑制;与PAN组比较,PAN+AS-IV组VEGFR2及GIV蛋白的磷酸化水平进一步上调,而p-AKT水平显著升高;AS-IV组与Control组比较,VEGFR2、GIV及AKT的蛋白水平的差异均无统计学意义。
讨 论
足细胞是一种高度分化的上皮细胞,一旦丢失很难再生。除了作为肾小球滤过屏障和机械屏障的重要组成部分,足细胞还可以合成并分泌Ⅳ型胶原、纤维连接蛋白以及血管内皮生长因子(vascular endothelial growth factor,VEGF)等,在维持肾小球基底膜功能和结构平衡中发挥重要作用[7]。对足细胞损伤机制及保护措施的深入探讨,有利于推动肾小球疾病特别是表现为肾病综合征的肾脏疾病的防治和研究。我们的研究发现黄芪甲苷可以抑制PAN诱导的足细胞凋亡,减少足细胞标记物丢失,具有保护足细胞损伤的作用。

注:与Control组比较,aP<0.05;与PAN组比较,bP<0.05;与AS-IV组比较,cP<0.05图2 流式细胞术及Western blot法检测各组足细胞的凋亡率及凋亡相关蛋白的表达 A.流式细胞术检测各组细胞凋亡情况;B.各组细胞正常细胞及不同阶段凋亡细胞比较;C.Western blot检测各组caspase-3和cleaved caspase-3蛋白表达情况;D.各组caspase-3和cleaved caspase-3蛋白相对表达量比较
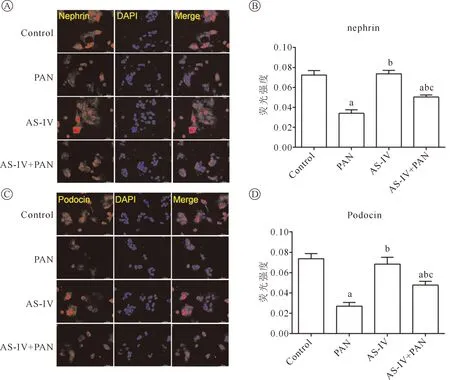
注:与Control组比较,aP<0.05;与PAN组比较,bP<0.05;与AS-IV组比较,cP<0.05图3 免疫荧光法检测各组足细胞nephrin和podocin表达情况 A.免疫荧光染色法测定各组nephrin表达(Bar=50 μm);B.各组nephrin荧光强度比较;C.免疫荧光染色法测定各组podocin表达(Bar=50 μm);D.各组podocin荧光强度比较

注:与Control组比较,aP<0.05;与PAN组比较,bP<0.05;与AS-IV组比较,cP<0.05图4 Western blot检测各组VEGFR2/GIV信号通路蛋白及AKT的蛋白水平 A.Western blot检测各组通路蛋白的表达情况;B.各组p-VEGFR2蛋白表达相对量比较;C.各组VEGFR2蛋白表达相对量比较;D.各组p-GIV蛋白表达相对量比较;E.各组GIV蛋白表达相对量比较;F.各组p-AKT蛋白表达相对量比较;G.各组AKT蛋白表达相对量比较
黄芪甲苷是中草药黄芪的主要成分,具有改善心肌缺血、抗炎、抗氧化、保护内皮细胞以及免疫调节等多种功效。近年来大量的研究表明,黄芪甲苷在保护糖尿病肾病足细胞损伤方面起到了重要的作用。黄芪甲苷可以通过缓解内质网应激、恢复自噬活性、抗氧化等途径减轻足细胞的损伤[8-9]。我们发现黄芪甲苷预处理可以显著减少PAN诱导的足细胞凋亡数量,并且抑制caspase-3的剪切。caspase是哺乳动物细胞中程序性死亡的介导者和执行者,caspase-3是细胞凋亡过程中最主要的终末剪切酶,处于凋亡连级反应的下游,被上游成员激活并水解为cleaved caspase-3,介导信号传递,导致细胞凋亡[10]。本实验中发现,PAN可促进caspase-3的活化,而黄芪甲苷虽然没有减少caspase-3的表达,但可以显著抑制cleaved caspase-3的产生,从而抑制凋亡进程。
nephrin和podocin是肾小球足细胞上的重要分子,分别由NPHS1和NPHS2基因编码,nephrin是1 241个氨基酸组成的跨膜蛋白,podocin位于足突细胞的足突膜表面与nephrin分子的胞浆区结合,共同维持足细胞裂孔隔膜的结构完整性[11]。在多种肾脏疾病中nephrin和podocin分子表达出现下调。PAN诱导的肾病综合征模型具有与人类肾病相似的特点,故广泛应用于肾病综合征的研究。研究证实PAN可以引起足突的融合、局部的细胞剥离、破坏肾小球滤过膜的电荷屏障并下调nephrin和podocin分子表达,造成大量蛋白尿的形成[12-13]。目前关于黄芪甲苷对足细胞损伤后nephrin和podocin蛋白的影响鲜有报道。本研究发现,黄芪甲苷预处理可以显著对抗PAN诱导的足细胞nephrin和podocin蛋白的低表达,进一步证实了黄芪甲苷对PAN诱导的足细胞损伤具有保护作用。
VEGF具有促进内皮细胞增殖,新生血管形成的作用。GIV(又名Girdin)是一种信号转导蛋白,能与PI3K及AKT蛋白结合,在多种病理生理过程中发挥重要作用[14]。有研究发现,足细胞自分泌的VEGF可通过受体VEGFR2活化PI3K/AKT通路抑制足细胞凋亡[15]。Wang等[16]研究证实,在嘌呤霉素氨基核苷肾病中,VEGF可通过激活VEGFR2/GIV/Gi3信号复合体以及PI3K/Akt通路来保护足细胞。本研究结果表明,足细胞被PAN处理24 h后,AKT的活化受到了抑制,VEGFR2和GIV的磷酸化水平有所升高;经黄芪甲苷预处理的足细胞,VEGFR2和GIV被进一步激活,并且AKT也被明显的活化。结果提示在PAN诱导的足细胞损伤中,黄芪甲苷可能通过活化VEGFR2/GIV通路,然后进一步活化AKT通路,以实现足细胞的保护机制。本研究还发现,PAN处理的足细胞中,VEGFR2和GIV蛋白被活化,而AKT的活化却被抑制了,这可能是由于代偿性作用的结果,由于作用时间不长,还不足以活化AKT通路。这还有待于进一步研究证实。
综上所述,本研究发现黄芪甲苷可以有效抑制嘌呤霉素氨基核苷诱导的足细胞凋亡、保护足细胞免受损伤,这种保护作用可能与激活VEGFR2/GIV信号通路、继而活化AKT通路有关。这一发现为黄芪甲苷治疗慢性肾脏病提供理论支持,也有助于传统中医药的临床研究和开发应用。但本研究仅限于体外实验;而且在观察信号蛋白的变化时,未经阻断或上调信号蛋白以进一步验证其差异,所以本研究结果仍有待更多、更深入的研究来明确。

