磷酸甘油酸变位酶1(PGAM1)在胃癌组织中的表达及其临床意义
宋宜朋 高 超
胃癌是最常见的恶性肿瘤之一,发生率位于全球恶性肿瘤发生率第5位,病死率也高居第2位[1]。但胃癌起病较为隐匿,早期缺乏典型的临床表现,因此胃癌的早期诊治率较低。我国的早期诊治率仅10%左右,由此可见,早诊断、早治疗是目前改善胃癌患者预后的关键。研究表明,糖代谢异常是肿瘤细胞代谢的重要特征,无论氧气是否充足,肿瘤细胞均选择糖酵解途径获取能量,而糖酵解过程通常存在酶表达异常[2]。研究表明,该过程中的相关酶类可用于肿瘤的早期诊断及预后判断。磷酸甘油酸变位酶 1(phosphoglycerate mutase 1,PGAM1)是糖酵解途径重要的催化酶,在多种肿瘤组织中均存在高表达。本研究通过免疫组化法检测 PGAM1在胃癌及癌旁正常组织中的表达水平,分析其与临床病理特征的关系,初步探讨PGAM1与胃癌的发生、发展及患者预后之间的关系。
材料与方法
1.组织材料:选取2019年2~5月于徐州医科大学附属医院胃肠外科接受胃癌手术治疗的患者55例,其中男性39例,女性16例,患者平均年龄60.5±11.2岁,所有患者术前均未行放疗、化疗及其他抗肿瘤治疗,术前均经病理证实为胃恶性肿瘤,且不合并其他原发恶性肿瘤,均有完整的手术记录资料及临床资料,术后标本送检。其中高分化肿瘤11例,中低分化肿瘤44例;临床病理分期:Ⅰ~Ⅱ期30例,Ⅲ~Ⅳ期25例。每例患者均切取肿瘤组织及癌旁正常组织(距肿瘤边缘5cm以上,病理证实未见癌组织浸润)作为对照。
2.PGAM1表达水平检测:(1)取材:每例患者均分别取胃癌肿瘤组织、癌旁正常组织。(2)制片:组织经10%甲醛溶液固定,石蜡包埋,行连续切片(4μm厚),脱蜡。免疫组织化学染色采用SP法,DAB显色,光学显微镜观察并拍照;PGAM1抗体、SP试剂盒及DAB显色剂均购自徐州博立达生物技术有限公司。
3.结果判读:组织切片中细胞为淡黄色至棕褐色者为阳性细胞标志。染色强度以多数细胞呈现的染色特性(染色深浅需与背景着色情况对比)计分:无着色(阴性)为0分,淡黄色(弱阳性)为1分,棕黄色(中阳性)为2分,棕褐色(强阳性)为3分。阳性细胞百分比即选取镜下5个视野(×400)的阳性细胞平均数:0~10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。每张切片的评分为染色强度评分与阳性细胞百分比评分的乘积,总分<6分记为低表达,总分≥6分记为高表达。
4.统计学方法:采用SPSS 21.0统计学软件对数据进行统计分析,两样本率的比较采用卡方(χ2)检验确切概率法,PGAM1蛋白表达水平与胃癌患者临床病例关系比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1.PGAM1在不同组织的表达情况:根据免疫组化结果:PGAM1蛋白阳性表达主要分布于细胞质中,胃癌组织中PGAM1高表达为34例(61.8%),癌旁正常组织中PGAM1高表达为18例(32.7%)。肿瘤组织中PGAM1高表达率明显高于癌旁正常组织,差异有统计学意义(P=0.015,图1、表1)。
图1 免疫组化法检测PGAM1在正常胃组织及胃癌组织中的表达(SP法,×400)A.癌旁正常组织PGAM1表达(低表达);B.胃癌组织PGAM1表达(高表达)
2.胃癌组织中PGAM1的表达与患者临床病理特征的关系:临床分期Ⅲ~Ⅳ期患者胃癌组织中的PGAM1表达水平明显高于Ⅰ~Ⅱ期患者(P=0.011),存在淋巴结转移患者的胃癌组织中的PGAM1表达水平显著高于无淋巴结转移的患者(P=0.012);但胃癌组织中的PAGM1表达水平与患者性别、年龄、肿瘤分化程度、肿瘤直径、脉管侵犯及浸润深度均无关(P>0.05),详见表2。
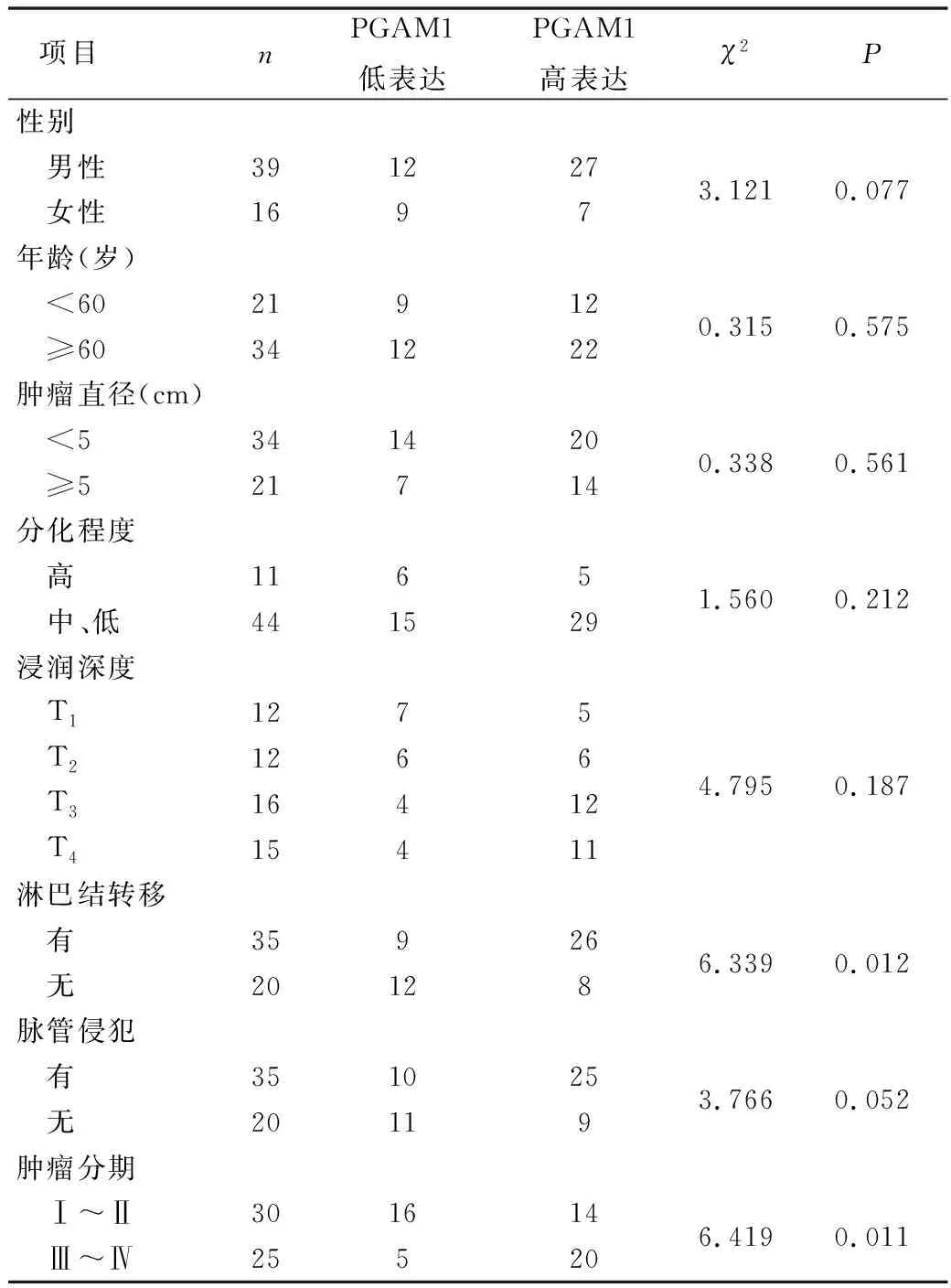
表2 胃癌组织中的PGAM1蛋白的表达与胃癌患者临床病理特征的关系
讨 论
肿瘤细胞的代谢异常成为近年来研究的热点,肿瘤细胞获取能量的主要方式是糖酵解,而正常细胞主要通过葡萄糖有氧氧化[3]。上调糖酵解酶的代谢不仅可以产生能量,还可以产生大分子生物合成的中间体,促进肿瘤存活、生长及增殖[4]。PGAM1是糖酵解途径的重要酶之一,主要参与催化3-磷酸甘油酸转化为2-磷酸甘油酸,是糖酵解途径中唯一在转录水平上受抑癌基因p53调控的酶,PGAM1表达增高为肿瘤细胞生长提供代谢优势,故PGAM1的高表达可能与肿瘤发生相关[5]。已有研究表明PGAM1蛋白在肝细胞癌、口腔鳞状细胞癌、肾透明细胞癌、结直肠癌和胶质瘤组织中的表达均较正常组织增高[3,6~9]。但目前尚无PGAM1蛋白在胃癌组织中表达情况的相关研究。本研究采用免疫组化技术检测胃癌组织以及癌旁正常组织中的PGAM1表达水平,结果表明PGAM1在胃癌组织中表达明显高于其在癌旁正常组织中的表达,提示PGAM1高表达可能与胃癌的形成相关,PGAM1蛋白可以作为潜在的肿瘤标志物。
随着代谢酶非代谢功能研究的深入,同作为蛋白酶的丙酮酸激酶M2被发现可以调控染色体分离、细胞周期、基因转录及肿瘤发生的蛋白-蛋白相互作用[10~13]。PGAM1也有类似功能,Zhang等[14]研究发现PGAM1与α-平滑肌肌动蛋白(ACTA2)存在相互作用,从而促进了乳腺癌细胞的迁移;且PGAM1可能与膜蛋白、结构蛋白及转录因子等上游信号蛋白相互作用,而这些信号蛋白调控着下游的流动性相关蛋白。以上机制均表明PGAM1可能参与调节肿瘤细胞迁移的过程。本研究结果显示存在淋巴结转移的患者胃癌组织中PGAM1表达水平显著高于无淋巴结转移的患者,临床分期Ⅲ~Ⅳ期患者胃癌组织中PGAM1表达水平明显高于Ⅰ~Ⅱ期患者(P均<0.05),结果符合相关机制研究结果,提示PGAM1可能与胃癌的进展和转移相关,PGAM1的高表达可能提示胃癌患者的预后不佳。
抑制PGAM1异常表达可抑制肿瘤生长,Ko等[15]研究发现抑制糖酵解的酶可有效杀死肝癌细胞等癌细胞。Ren等[3]进一步研究发现,在肝细胞癌中下调PGAM1显著抑制了肿瘤细胞生长。Evans等[16]提出化合物EMJ3对乳腺癌细胞中的PGAM1有抑制作用,PGAM1可作为肿瘤治疗靶点。以上均提示降低PGAM1表达可抑制肿瘤进展,PGAM1可能是肿瘤的潜在治疗靶点。
综上所述,本研究表明PGAM1在胃癌组织中表达明显高于其在癌旁正常组织中的表达,PGAM1在胃癌组织中的表达与TNM分期及淋巴转移相关。PGAM1的高表达可能提示胃癌患者的预后不佳,PGAM1在胃癌诊治过程中有望成为一种新的治疗靶点,但其作用机制还需进一步研究。

