褪黑素减轻大鼠颈动脉球囊损伤后炎性细胞浸润
杨根欢 汪 岩 廖鹏志 贾玉龙
随着经济的进步和人群膳食结构的改变,动脉粥样硬化的发生呈现出年轻化的趋势。因而血管相关性疾病的发生率越来越高,尤其是心脑血管疾病已成为重要的致死、致残的原因之一。动脉粥样硬化最基本的病理变化便是炎性细胞浸润[1]。褪黑素在体内分布广泛,相对分子质量较小,可以自由通过细胞膜性结构[2]。已有研究表明,褪黑素具有强大的抗炎和抗氧化功能[3]。本研究表明,褪黑素能够抑制炎性细胞浸润过程中相关炎性因子的表达,进而减轻球囊损伤诱导的实验大鼠颈动脉内炎性细胞的浸润。
材料与方法
1.材料与试剂:SPF级雄性SD大鼠(北京维通利华实验动物技术有限公司),褪黑素(美国Sigma公司),免疫组织化学试剂盒(北京中杉金桥生物技术有限公司),NF-κB抗体(美国CST公司),MCP-1抗体(美国Santa Cruz公司);ICAM-1抗体和VCAM-1抗体(中国博士德生物工程有限公司)。
2.球囊损伤模型的制备及动物实验:20只SPF级的雄性SD大鼠,平均体质量为350g。随机将实验大鼠分为正常对照组、正常并注射褪黑素组、球囊损伤组、球囊损伤并注射褪黑素组,每组5只。将实验大鼠麻醉后行颈部正中切口,解剖出颈总动脉、颈内动脉和颈外动脉并套线备用,将颈外动脉的远端及其分支结扎。将颈总动脉和颈内动脉阻断,将颈外动脉用显微剪刀剪开,将2F的取栓球囊插入颈总动脉内约2cm。将0.05ml的0.9%NaCl注射液注入取栓球囊内,充盈后拖至颈总动脉的远端,如此反复3次,随后行颈外动脉的断端结扎,逐层缝合颈部切口。按照预定实验设计定时对各组实验大鼠分别行腹腔内注射褪黑素(5mg/kg)及同体积的0.9%NaCl注射液,每日1次[4]。14天后取出各组实验大鼠的球囊损伤段颈动脉。0.9%NaCl注射液将颈动脉冲洗干净,将颈动脉一分为二,分别保存于4%的多聚甲醛和液氮中,用于后续实验。
3.免疫组织化学染色:常规方法对石蜡切片进行脱蜡及水化,柠檬酸盐抗原修复液浸泡后行高压、高温修复抗原,室温下用3%过氧化氢溶液孵育10min以灭活内源性的过氧化物酶,然后室温下用5%的山羊血清封闭30min。一抗4℃下孵育过夜(CD45 1∶50),二抗室温下孵育60min。DAB法染色,阳性表达为棕黄色。终止染色后用苏木精复染5min,0.1%盐酸乙醇分化3~5s,自来水冲洗返蓝2min,然后常规进行脱水、透明、封片。将免疫组织化学的切片置于光学显微镜下拍照(×400),用Image-Pro Plus 6.0软件对CD45阳性区域的平均吸光度值进行分析,将相应数值用于统计分析。
4.Western blot法检测:将大鼠的颈动脉标本加入600μl SDS组织裂解液,置于研钵中,研磨成组织匀浆,常规方法提取组织蛋白并测定蛋白浓度。将总量为20μg的蛋白上样,120V的恒压下电泳约90min,320mA的恒流下进行转膜,室温下用5%脱脂牛奶封闭1h,4℃下一抗孵育12h(NF-κB 1∶2000,MCP-1 1∶2000,ICAM-1 1∶500,VCAM-1 1∶500),TBST洗膜3次,在室温下二抗(浓度1∶5000)孵育1h,之后应用辣根过氧化物酶化学发光法检测目标蛋白。用Alpha EaseFC system 软件(美国Alpha Innotech公司)对Western blot法检测结果进行分析,分别测量目标蛋白和相应内参的灰度值,将其比值用于统计学分析。
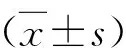
结 果
1.各组实验大鼠的颈动脉壁内炎性细胞的浸润情况:球囊损伤组实验大鼠的颈动脉壁内炎性细胞的浸润程度显著高于正常对照组实验大鼠(P<0.01)。球囊损伤并注射褪黑素组实验大鼠的颈动脉壁内炎性细胞的浸润程度显著低于球囊损伤组实验大鼠(P<0.01,图1)。
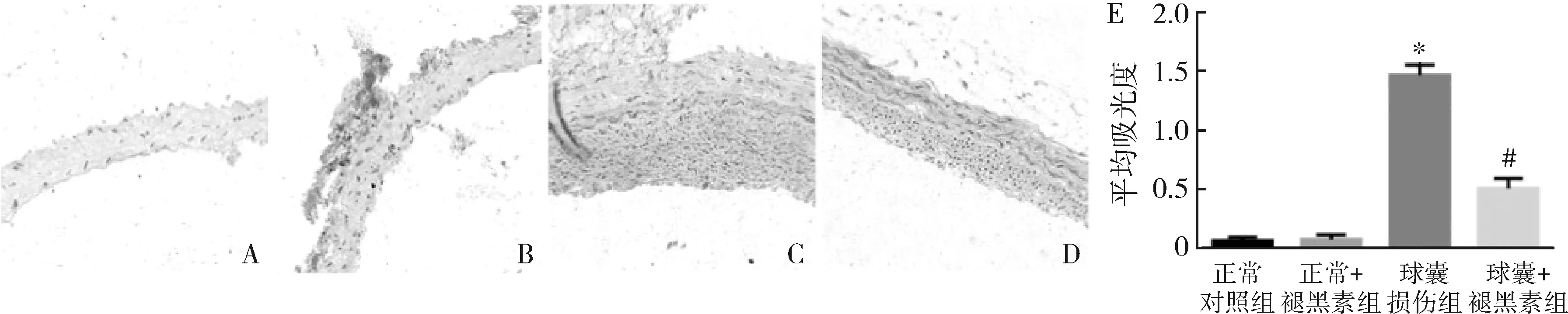
图1 各组实验大鼠的颈动脉壁内炎性细胞浸润情况(CD45免疫组化染色,×400)A.正常对照组;B.正常+褪黑素组;C.球囊损伤组;D.球囊+褪黑素组;E.与正常对照组或正常+褪黑素组比较,*P<0.01;与球囊损伤组比较,#P<0.01
2.各组实验大鼠的颈动脉内NF-κB的表达情况:球囊损伤组实验大鼠的颈动脉内NF-κB的表达显著高于正常对照组实验大鼠(P<0.01)。球囊损伤并注射褪黑素组实验大鼠的颈动脉内NF-κB的表达显著低于球囊损伤组实验大鼠(P<0.01,图2)。
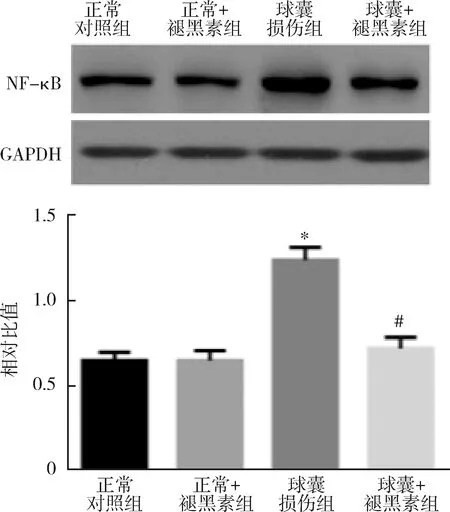
图2 各组实验大鼠的颈动脉内NF-κB的表达与正常对照组或正常+褪黑素组比较,*P<0.01;与球囊损伤组比较,#P<0.01
3.各组实验大鼠的颈动脉内MCP-1、VCAM-1和ICAM-1的表达情况:球囊损伤组实验大鼠的颈动脉内MCP-1、VCAM-1和ICAM-1的表达显著高于正常对照组实验大鼠(P<0.01)。球囊损伤并注射褪黑素组实验大鼠的颈动脉内MCP-1、VCAM-1和ICAM-1的表达显著低于球囊损伤组实验大鼠(P<0.05,图3)。
图3 各组实验大鼠的颈动脉内MCP-1、ICAM-1、VCAM-1的表达与正常对照组或正常+褪黑素组比较,*P<0.01;与球囊损伤组比较,#P<0.05
讨 论
随着人类的疾病谱的改变,社会对血管疾病的认识和重视程度也越来越高。而炎症作为一重要的病理生理过程参与了很多常见血管病的发生,甚至在某些血管病中可以作为最主要的病理改变,如动脉粥样硬化、多发性大动脉炎和白塞病等[5,6]。褪黑素作为体内重要的内分泌物质,能够被体内很多器官合成。褪黑素具有调节人体的生物节律、调节肠道的功能、抑制肿瘤的生长、抗炎性损伤和抗氧化损伤等重要生理功能[7,8]。目前国内外普遍将褪黑素应用于调节人体睡眠及肠道生理功能方面,效果显著且无明显的毒性不良反应。已有研究表明,在很多血管疾病中褪黑素具有重要的血管保护作用,如尼古丁诱导的血管病、低氧所致的血管损害以及高血压相关的血管损伤等[4,9]。
炎症的本质是炎性细胞的浸润,即血管壁内炎性细胞的浸润程度能够反映其炎性损伤的程度[10]。CD45是组织内炎性细胞的重要标志物之一,因此本研究通过检测实验大鼠颈动脉内的CD45阳性细胞数目来反映其炎性细胞的浸润程度及炎性损伤的程度[11]。大鼠颈动脉球囊损伤可引起动脉内膜的增生和动脉壁的炎性反应,因此本研究用此经典动物模型研究褪黑素对动脉壁内炎性细胞浸润的影响。结果表明,球囊损伤能明显诱导实验大鼠颈动脉壁内的炎性细胞的浸润,而褪黑素可以抑制此炎性细胞的浸润。同时本研究尚对褪黑素抑制实验大鼠颈动脉壁内炎性细胞浸润的机制进行了探讨。
MCP-1是组织内炎性细胞的重要趋化因子之一,VCAM-1和ICAM-1是组织细胞间重要的黏附因子[12~14]。因此MCP-1、VCAM-1和ICAM-1均能够参与炎性细胞向血管壁的黏附和浸润。而NF-κB作为重要的炎性因子则能够诱导MCP-1、VCAM-1和ICAM-1的表达[15,16]。结合本研究结果可以推断,褪黑素能够通过抑制NF-κB、MCP-1、VCAM-1和ICAM-1的表达进而减轻球囊损伤诱导的实验大鼠颈动脉壁内的炎性细胞浸润。有研究表明,将大鼠的松果体切除后,发现其主动脉内MCP-1、VCAM-1和ICAM-1的表达显著升高,这与本研究的结果类似[17]。同时本研究也显示,褪黑素在治疗炎症相关的血管病方面具有潜在的临床应用价值。

