龙胆苦苷生物合成候选调控基因GrbHLH1的挖掘、克隆与表达分析
李彩霞,王元忠,王梅媛,梁 芳,张晓东*
(1.玉溪师范学院化学生物与环境学院,中国云南玉溪653100;2.许昌学院食品与生物工程学院,中国河南许昌461000;3.云南省农业科学院药用植物研究所,中国云南昆明650223)
滇龙胆是云南省道地药材,其药用部位为根及根茎,主要药效成分为龙胆苦苷[1]。研究表明龙胆苦苷在龙胆植物绿色器官中合成,经过茎,最后运输到根部储藏[2~4]。龙胆苦苷的生物合成主要分3个阶段:1)前体形成阶段,包括质体2-C-甲基-D-赤藓醇-4-磷酸(2-C-methyl-D-erythritol 4-phosphate,MEP)途径和胞质甲羟戊酸(mevolonate,MVA)途径,生成异戊烯基焦磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)[5];2)碳骨架结构形成阶段,起始于香叶基焦磷酸(geranyl diphosphate,GPP),止于裂环番木鳖苷的合成[6~8];3)萜类化合物的后修饰阶段,主要通过细胞色素P450(cytochrome P450,CYP450)酶和糖基转移酶来完成[8]。目前,滇龙胆在生产上存在的主要问题之一是栽培药材龙胆苦苷含量低,并且不同产地药材的龙胆苦苷含量差异较大[9],导致市场上的滇龙胆药材质量参差不齐,直接影响到临床药效[4]。为提高滇龙胆中的龙胆苦苷含量,金琳等[10]使用不同浓度的茉莉酸甲酯(methyl jasmonate,MeJA)对花期滇龙胆叶片进行喷施,结果表明100 mg/L的MeJA喷施8 d后叶中龙胆苦苷含量达到最高。另有研究报道,通过在植物组织中导入同源或异源结构基因,也能够提高活性物质的产量[11~12]。目前,基于转录组测序技术的龙胆苦苷生物合成途径的第一、二阶段已经清楚[13]。但是,由于该途径中酶的底物或产物含量低,且不能直接商业化购买,所以第三阶段的研究仍然进展缓慢[13~14]。
转录因子能同时诱导一个或多个基因的协同表达,增强转录因子的表达可大幅度提高酶基因的表达及活性产物的产量[14~16]。在长春花中,bHLH转录因子碱性螺旋-环-螺旋环烯醚萜类合成1(bHLH iridoid synthesis 1,CrBIS1)和 CrBIS2均能形成二聚体,反式激活环烯醚萜生物合成途径中从GPP到番木鳖酸之间酶基因的表达,从而促进长春花碱和长春新碱中环烯醚萜部分的生物合成[15,17]。在蒺藜苜蓿中,三萜皂苷生物合成激活调控子1(triterpene saponin biosynthesis activating regulator 1,MtTSAR1)和MtTSAR2能够通过结合靶基因启动子中的N-box[CACG(A/C)G],分别激活非溶血性大豆皂苷和溶血性大豆皂苷的生物合成[18~19]。在青蒿中,转录因子AabHLH1通过结合紫穗槐-4,11-二烯合酶(amorpha-4,11-diene synthase,ADS)、细胞色素P450单加氧酶(cytochrome P450 monooxygenase,CYP71AV1)和 3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)编码基因启动子中的E-box元件来激活这些基因的表达,从而促进青蒿素的生物合成[20]。在甘草中,转录因子GubHLH3能够通过激活香树素合酶基因(βamyrin synthase,bAS)、香树素羟化酶基因CYP93E3和CYP72A566的表达,来促进大豆皂苷Ⅰ、Ⅱ的生物合成[21]。这些结果表明bHLH转录因子能够调控单萜或三萜的生物合成[15,17~19]。
在滇龙胆根和叶的转录组中,转录因子bHLH的数量最多,表明bHLH在滇龙胆生长、发育和代谢等方面起重要作用[13]。本研究首先通过序列比对方法获得滇龙胆GrbHLH1基因;然后通过共表达分析方法,确定GrbHLH1为滇龙胆龙胆苦苷生物合成途径的候选调控基因;再根据滇龙胆转录组中仅有的1条GrbHLH1基因序列,设计一对基因特异性引物,通过RT-PCR技术成功从滇龙胆叶片中扩增到GrbHLH1基因,并对该基因进行了生物信息学分析和组织表达特异性分析,以期为滇龙胆GrbHLH1基因的功能研究及其在龙胆苦苷生物合成中的调控机理研究奠定基础。
1 材料和方法
1.1 材料
滇龙胆于2018年4月30日采自临沧市云县临沧耀阳生物药业科技有限公司后箐种植基地,由云南省农业科学院药用植物研究所王元忠副研究员鉴定为Gentiana rigescens Benth。使用剪刀分别剪取两年生滇龙胆的根、茎、叶和花,用锡箔纸包被后,投入液氮中,带回实验室置于-80℃保存。
RNA提取试剂盒MiniBEST Plant RNA Extraction Kit、逆转录试剂盒PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit、pMD19-T 载体、大肠杆菌感受态细胞DH5α、高保真酶PrimeSTAR Max DNA Polymerase(2× Mix)、Takara Taq 酶、嵌合荧光检测试剂盒TB GreenTMPremix Ex TaqTMⅡ (Tli RNaseH Plus)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl β-D-galactopyranoside,X-gal)、氨苄青霉素、限制性内切酶EcoRⅠ、XhoⅠ均购自宝生物工程(大连)有限公司。原核表达载体pGEX-4T-1购自瑞典Amersham公司;胶回收试剂盒购自北京百泰克生物技术有限公司;LightCycler 480Ⅱ荧光定量PCR仪购自瑞士Roche公司。引物由上海捷瑞生物工程有限公司合成,DNA测序由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 GrbHLH1基因与龙胆苦苷生物合成途径基因的共表达分析
使用长春花中调控环烯醚萜类生物合成的CrBIS1基因(GenBank登录号:KM409646.2)在滇龙胆转录组数据库中进行BLASTn搜索(E-value=10-5),获得一条bHLH基因序列,命名为GrbHLH1。分别取本课题组2013年测序的滇龙胆根和叶转录组中龙胆苦苷生物合成途径上的乙酰辅酶A酰基转移酶(acetoacetyl-CoA acetyltransferase,也称acetoacetyl-CoA C-acetyltransferase或acetoacetyl-CoA thiolase,AACT)、3-羟基-3-甲基戊二酰辅酶A合成酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGR)、甲羟戊酸激酶(mevalonate kinase,MK)、磷酸甲羟戊酸激酶(phosphomevalonate kinase,PMK)、甲羟戊酸-5-二磷酸脱羧酶(diphosphomevalonate decarboxylase,MVD)、1-脱氧-D-核酮糖5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)、1-脱氧-D-木酮糖 5-磷酸还原异构酶(1-deoxy-D-xylulose 5-phosphate reductoisomerase,DXR)、2-C-甲基-D-赤藓醇-4-磷酸胞苷转移酶(2-C-methyl-D-erythritol 4-phosphate cytidyltransferase,CMS)、4-二磷酸胞苷-2-C-甲基-D-赤藓醇激酶(4-diphosphocytidyl-2-C-methyl-D-erythritol kinase,CMK)、2-C-甲基-D-赤藓醇-2,4-环二磷酸合酶(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase,MCS)、1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶(1-hydroxy-2-methyl-2-(E)-butenyl,4-diphosphate synthase,HDS)、1-羟基-2-甲基-2-(E)-丁烯基-4-焦磷酸还原酶 (1-hydroxy-2-methyl-2-(E)-butenyl 4-diphosphate reductase,HDR)、异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)、牻牛儿基焦磷酸合酶(geranyl diphosphate synthase,GPPS)、香叶醇合酶(geraniol synthase,GES)、香叶醇10-羟化酶(geraniol 10-hydroxylase,G10H)、8-羟香叶醇氧化还原酶(8-hydroxygeraniol oxidoreductase,8HGO)、环烯醚萜合酶(iridoid synthase,IS)、环烯醚萜氧化酶(iridoid oxidase,IO)、7-脱氧番木鳖苷酸配基葡萄糖基转移酶(7-deoxyloganetic acid glucosyltransferase,7DLGT)、7-脱氧番木鳖苷-7-羟化酶(7-deoxyloganic acid 7-hydroxylase,DL7H)、裂环番木鳖苷合酶(secologanin synthase,SLS)的编码基因与GrbHLH1基因在根和叶中的FPKM(expected number of fragments per kilobase of transcript sequence per millions base pairs sequenced,每一百万个片段中来自某一基因每一千碱基长度的片段数目)值,将同一基因的不同转录本FPKM总和作为该基因的总表达量,使用pheatmap软件包制图,检测GrbHLH1基因与龙胆苦苷生物合成途径结构基因是否存在共表达现象。
1.2.2 叶片总RNA提取及GrbHLH1基因的克隆
按照植物RNA提取试剂盒说明书提取滇龙胆嫩叶总RNA,随后按照逆转录试剂盒说明书合成cDNA。根据原核表达载体pGEX-4T-1的多克隆酶切位点和滇龙胆转录组中GrbHLH1基因序列comp79308_c1的开放阅读框(open reading frame,ORF),设计一对特异性引物GrbHLH1EcoRⅠ-F:GAATTCATGTCAGGAACTTCATGGATCT(下划线为EcoRⅠ酶切位点),GrbHLH1XhoⅠ-R:CTC-GAGTTATTCAAGCAACAGAGCTGATC(下划线为XhoⅠ酶切位点)。以cDNA为模板进行PCR扩增,反应体系为PrimeSTAR Max DNA Polymerase(2× Mix)25 μL、模板 2 μL、正反向引物(10 μmol/L)各1 μL,加ddH2O补足至50 μL。PCR反应条件:98℃变性10 s,59℃退火15 s,72℃延伸30 s,30循环;72℃延伸7 min。PCR产物加A尾后,经1.0%琼脂糖凝胶电泳分离,然后切胶,使用胶回收试剂盒对目的片段进行回收,将其连接到pMD19-T载体。将连接载体转化大肠杆菌DH5α后进行蓝白筛选,挑取白斑摇菌;使用碱裂解法提取质粒,经酶切检测正确后,将1 mL菌液送公司进行DNA测序,从而获得正确的重组质粒pMD19-GrbHLH1。将含有重组质粒的菌液保存于终浓度为20%的甘油中,置于-80℃冰箱保存。
1.2.3 GrbHLH1基因的生物信息学分析
使用Genetyx version 6.1.8软件将GrbHLH1基因ORF的核苷酸序列翻译成氨基酸序列,随后采用NCBI网站上的BLASTp程序进行序列相似性搜索,获得与GrbHLH1蛋白相似性较高的序列。使用DNAMAN version 7软件进行GrbHLH1蛋白与CrBIS1、CrBIS2蛋白的多序列比对,寻找他们的保守区结构域。选取拟南芥bHLH蛋白[18];长春花 CrBIS1[18]、CrBIS2[18]和 CrMYC2[18];蒺藜苜蓿MtTSAR1[19](GenBank登录号:AJE29377.1)和MtTSAR2[19](GenBank 登录号:ALH07115.1);滇龙胆GrbHLH1(GenBank登录号:AIA82919.2)和Gr-MYC2蛋白(GenBank登录号:AIA82919.2),使用MEGA version 10.0.5软件内置的Clustal W进行多序列比对,然后使用邻接(neighbour-joining,NJ)法构建系统发育树,设置bootstrap=1 000。使用在线软件 ProtParam(https://web.expasy.org/protparam/)进行蛋白质理化性质分析。利用在线软件CAI(http://www.detaibio.com/tools/codon-adaptation-index-calculator.html)进行密码子适应指数分析。使用在线软件 ChloroP version 1.1(http://www.cbs.dtu.dk/services/ChloroP/)进行叶绿体转运肽预测;利用在线软件SignalP version 5.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;使用在线软件 SMART(http://smart.embl-heidelberg.de/)进行保守结构域预测;使用在线软件SSpro(http://scratch.proteomics.ics.uci.edu/)对二级结构进行预测;使用在线软件SWISS-MODEL(http://www.expasy.ch/swissmod/SWISS-MODEL.html)的自动模式进行同源建模;利用在线软件TMHMM version 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质的跨膜螺旋区;利用在线软件WoLF PSORT(https://wolfpsort.hgc.jp/)预测蛋白质的亚细胞定位情况。使用在线软件InterPro version 75.0(http://www.ebi.ac.uk/interpro/)对蛋白质的功能进行预测。
1.2.4 GrbHLH1基因的实时定量分析
选取3株健康和生长势相同的两年生滇龙胆植株,分别剪取根、茎、叶和花,每个器官取3个样品,提取总RNA。使用反转录试剂盒合成第一链cDNA。以滇龙胆转录组中的GrACTIN基因(GenBank登录号:KM061808)为内参设计引物qGrACTIN-F(5′-GCGGATCGTATGAGCAAGGA-3′)和 qGrACTIN-R(5′-GGGGCCGGATTCTTCGTATT-3′),定量聚合酶链反应(quantitative PCR,qPCR)产物长度为174 bp。根据GrbHLH1基因的cDNA序列设计特异性引物qGrbHLH1-F(5′-CAAAGAGGGCGCAACAATCC-3′)和 qGrbHLH1-R(5′-TTGTTGACTGAGCTGCTCCC-3′),qPCR 产物长度119 bp。使用嵌合荧光检测试剂盒进行qPCR,反应条件:95℃15 s,60℃15 s,72℃10 s。扩增反应在LightCycler 480Ⅱ荧光定量PCR仪上进行,扩增曲线、溶解曲线、标准曲线由qPCR仪软件自动生成。使用内参基因GrACTIN表达校准后,采用比较 Ct值的 2-△△Ct方法[22]计算出根、茎、叶和花中GrbHLH1基因的相对表达量。
2 结果
2.1 GrbHLH1基因是滇龙胆龙胆苦苷生物合成途径的候选调控基因
使用长春花CrBIS1基因在滇龙胆转录组数据库中进行BLASTn搜索,结果获得唯一1条bHLH基因序列,命名为GrbHLH1(转录组中基因编号:comp79308_c1)。根据花期滇龙胆中GrbHLH1基因和龙胆苦苷生物合成途径基因的表达量进行作图,结果表明 GrbHLH1 基因与 GES、IS、IO、7DLGT基因的表达模式一致,即均在叶中表达,而在根中不表达;同时,GPPS、DL7H基因在叶中的表达量远高于其在根中的表达(图1)。这些结果表明在叶片中 GrbHLH1 基因与 GES、IS、IO、7DLGT、GPPS、DL7H基因存在共表达现象,暗示着转录因子GrbHLH1可能通过调控这些基因的表达,进而促进龙胆苦苷的生物合成。

图1 滇龙胆GrbHLH1基因与龙胆苦苷生物合成途径基因的共表达分析Fig.1 Co-expression analysis of the GrbHLH1 gene and genes in the gentiopicroside biosynthesis pathway in G.rigescens
2.2 滇龙胆GrbHLH1基因序列的克隆
以滇龙胆幼叶cDNA为模板,使用特异性引物扩增出约1 200 bp的片段(图2)。通过TA克隆获得重组质粒pMD19-GrbHLH1,再通过DNA测序方法获得GrbHLH1基因序列。

图2 滇龙胆GrbHLH1基因的PCR扩增结果M:DNA相对分子质量标准;1:GrbHLH1基因的PCR扩增结果。Fig.2 PCR amplification result of the GrbHLH1 gene from G.rigescensM:MarkerⅢ;1:PCR amplification result of the GrbHLH1 gene.
2.3 GrbHLH1基因的生物信息学分析
利用Genetyx软件对GrbHLH1基因的ORF序列进行分析,结果显示GrbHLH1基因编码框全长1 104 bp,编码367个氨基酸。将该序列上传至NCBI中的GenBank数据库,获得的登录号为KF941186.2。
进一步使用Genetyx软件将GrbHLH1基因的ORF序列翻译成氨基酸序列,然后使用BLASTp软件对GrbHLH1蛋白进行序列相似性搜索,结果表明GrbHLH1与长春花CrBIS1(44.07%)和CrBIS2(39.55%)、苜蓿 MtTSAR2(31.60%)和 MtTSAR1(25.15%)的相似性较高。使用DNAMAN软件将GrbHLH1蛋白与长春花CrBIS1和CrBIS2进行比对,结果表明GrbHLH1蛋白具有bHLH超家族保守结构域(图3)。此外,利用MEGA软件构建Grb-HLH1蛋白的系统发育树,结果显示滇龙胆Grb-HLH1 蛋白与 CrBIS1、CrBIS2、MtTSAR1、MtTSAR2等IVa型bHLH蛋白处于同一进化枝(图4),表明它们亲缘关系较近。
使用ProtParam软件对GrbHLH1蛋白进行理化性质分析,结果表明该蛋白质单体的相对分子质量为40.60 kD,理论pI为4.82;带正电氨基酸残基(Arg+Lys)为33,带负电氨基酸残基(Asp+Glu)为48,化学式为C1757H2856N478O588S16;不稳定指数为55.80,属于不稳定蛋白质;脂肪指数为90.33,总平均疏水性(grand average of hydropathicity,GRAVY)为-0.363,为亲水蛋白质。GrbHLH1蛋白含有20种基本氨基酸,其中亮氨酸和丝氨酸含量最高,均为10.40%;其次是天冬酰胺和苏氨酸,分别为8.70%和7.90%;色氨酸含量最低,为0.50%。
利用SSpro软件对GrbHLH1蛋白进行二级结构分析,结果表明在该蛋白质的二级结构中α-螺旋(helix)占 18.53%,β 折叠(extended strand)占8.17%,环(loop)占73.30%。利用SWISS-MODEL软件预测GrbHLH蛋白的三级结构,结果如图5所示。该模型以拟南芥MYC2蛋白[5gnj.3.B]为模板,在第189~244氨基酸处建模,三维模型覆盖率为15%,序列一致性为57.14%。使用InterPro软件对GrbHLH1蛋白进行功能分析,结果表明该蛋白质的分子功能为蛋白质二聚化活性(GO:0046983)。
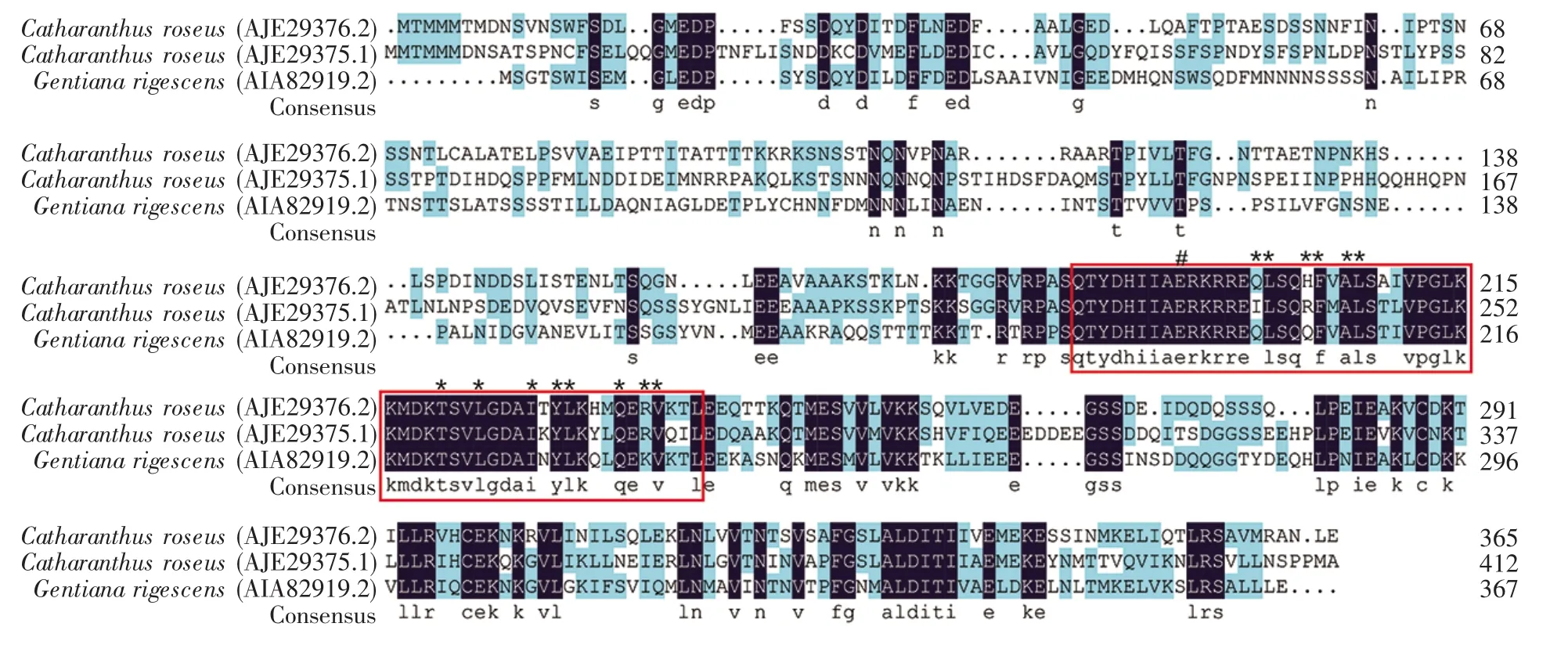
图3 GrbHLH蛋白与长春花bHLH蛋白的多序列比对结果黑色:相似性等于100%;浅蓝色:50%≤相似性<75%;保守bHLH结构域使用红色框标出;#:E盒/N盒特异性结合位点;*:同源二聚体界面的多肽结合位点。Fig.3 Multiple sequence alignment of the GrbHLH protein with bHLHs in Catharanthus roseusBlack:Homology=100%;Light blue:50%≤homology<75%.Conserved bHLH motifs are indicated by red frame.#:E-box/N-box specific binding site;*:Polypeptide binding site of homodimer interface.

图4 GrbHLH1蛋白与其他植物中bHLH蛋白的系统发育分析Fig.4 Phylogenetic tree of the GrbHLH1 protein and bHLHs in some other plants
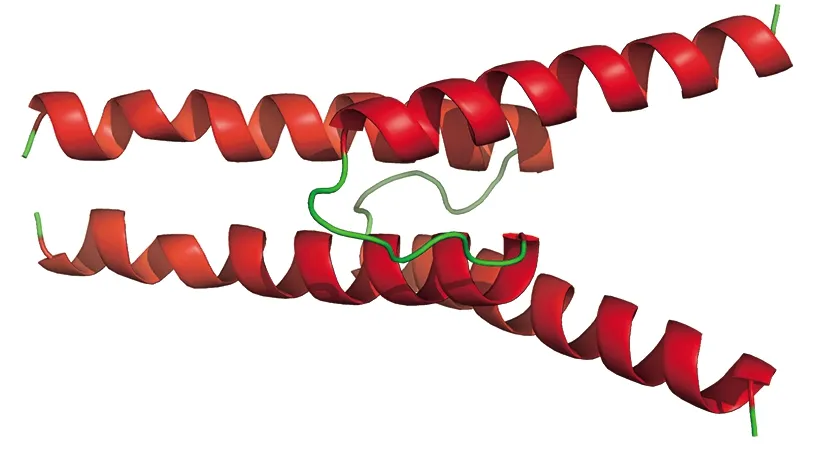
图5 GrbHLH1蛋白同源二聚体的三维结构预测红色:α-螺旋;绿色:环。Fig.5 Prediction of three-dimensional structure of the GrbHLH1 homodimerRed:α-Helix;Green:Loop.
使用SignalP软件对GrbHLH1蛋白进行分析,结果显示未发现信号肽,表明该蛋白质为非分泌型蛋白质。利用TMHMM软件预测GrbHLH1蛋白的跨膜螺旋区,结果表明GrbHLH1蛋白不含跨膜螺旋区域(图6),属于非膜蛋白质。使用WoLF PSORT软件对目标蛋白质进行亚细胞定位分析,结果显示GrbHLH1蛋白在细胞核和细胞质、细胞质、叶绿体、高尔基体、细胞骨架的定位系数分别为 6、3、2、和 1。

图6 GrbHLH1蛋白可能跨膜螺旋的检测Fig.6 Detection of putative transmembrane helixes of the GrbHLH1 protein
使用ChloroP软件对GrbHLH1蛋白的叶绿体转运肽进行预测,结果表明该蛋白质无叶绿体转运肽。使用SMART软件分析GrbHLH1蛋白的结构功能域,结果表明在第191~240位氨基酸之间存在一个高度保守的HLH功能结构域(图7),该结构域共由50个氨基酸组成,具有二聚化活性,位于二聚体界面的氨基酸位点有200~201、204~205、207~208、221、224、228、230~231、235、237~238(图 3)。
对GrbHLH1基因进行密码子分析,结果表明该基因在大肠杆菌、毕氏酵母和酿酒酵母中表达的适应指数分别为0.55、0.73和0.73,因此可选用大肠杆菌表达菌或酵母菌进行蛋白质表达。

图7 GrbHLH1蛋白的保守结构域Fig.7 The conservative domain of GrbHLH1 protein
2.4 GrbHLH1基因的组织特异性表达分析
取两年生滇龙胆的根、茎、叶和花,通过qPCR分析GrbHLH1基因在不同组织中的表达情况。结果表明,该基因在叶中的表达量最高,其次是茎,再次是花;该基因在根中不表达(图8)。

图8 GrbHLH1基因在根茎叶花中的相对表达使用Excel 2016进行统计分析。误差线表示标准偏差,数据来自3次独立重复实验。Fig.8 Relative expression of the GrbHLH1 gene in roots,stems,leaves and flowersExcel 2016 was used for statistical analysis.The standard deviations are represented by the error lines,and the data came from three independent repeated experiments.
3 讨论
随着高通量测序技术的不断发展,转录组测序技术已广泛应用于地黄[23]、胡黄连[24]、川西獐牙菜[25]、滇龙胆[13]等药用植物研究。随之而来的问题就是如何从海量数据中挖掘有用信息。基因共表达分析是挖掘基因转录调控模型的一种方法。Miettinen等[6]利用基因共表达分析方法,从长春花中挖掘出环烯醚萜生物合成途径缺失的8HGO、IO、7DLGT和DL7H等4个基因。Patra等[26]采用基因共表达分析方法,在长春花中发现了应答茉莉酸的bHLH转录因子调控单萜吲哚碱生物合成的网络。已有的对长春花、蒺藜苜蓿、青蒿和甘草的研究结果表明,bHLH转录因子在次生代谢调控中发挥了重要作用[15,17~21]。本研究首先采用序列比对和共表达分析方法,从滇龙胆转录组数据库中获得1条GrbHLH1基因序列。然后对其进行克隆和序列分析,结果显示GrbHLH1蛋白与长春花CrBIS1、CrBIS2蛋白在N末端和C末端相似性较低,在中间bHLH结构域部分相似性较高(图3),总体相似性分别为44.07%和39.55%,这表明GrbHLH1蛋白属于bHLH超家族成员。研究表明bHLH蛋白的碱性区域与DNA结合有关,而HLH区域参与二聚体的形成[27~28]。GrbHLH1蛋白与长春花CrBIS1、CrBIS2蛋白在碱性区域具有相同的N盒或E盒特异性结合位点(图3),表明它们具有相同的DNA结合机制;在HLH区域的高度相似,表明它们具有相似的二聚体形成机制。系统发育分析结果显示滇龙胆GrbHLH1蛋白与长春花Cr-BIS1、长春花 CrBIS2、苜蓿 MtTSAR1、苜蓿 MtTSAR2等IVa类bHLH转录因子处于同一进化枝(图4)。研究表明IVa进化枝的bHLH能够调控植物活性萜类化合物的生物合成[18],因此推测滇龙胆GrbHLH1是龙胆苦苷生物合成途径的候选调控基因。此外,本研究使用WoLF PSORT软件对GrbHLH1蛋白的亚细胞定位进行了分析,结果显示该蛋白质极可能定位于细胞核,与青蒿中调控青蒿素生物合成的AabHLH1蛋白的定位[7]一致,这为GrbHLH1转录因子发挥转录调控作用提供了进一步的证据。
在各物种中,bHLH蛋白常见的活性形式为二聚体。在长春花中,CrBIS2的活性形式为同源二聚体,但也能够与CrBIS1形成异源二聚体发挥调控作用[29~30]。本研究中GrbHLH1蛋白的三维模型预测结果表明,该蛋白质的活性形式也为同源二聚体(图 5)。
在花期滇龙胆转录组测序结果中,GrbHLH1基因(comp79308_c1)在叶和根中的FPKM分别为6.07和0.15,表明该基因主要在叶中表达。在本研究中,针对生长期GrbHLH1基因的组织特异性表达检测结果显示,该基因主要在叶中表达,在茎和花中仅有少量表达,而在根中不表达(图8)。这些结果表明,在滇龙胆生长期和花期,GrbHLH1基因主要在叶中表达,因此推测GrbHLH1基因在生长期和花期的叶片中均可调控龙胆苦苷的生物合成。
综上可知,本研究为滇龙胆GrbHLH1基因的功能研究奠定了基础。下一步将对GrbHLH1基因进行原核表达、蛋白质纯化、抗体制备和DNA结合活性分析,以期为滇龙胆龙胆苦苷生物合成途径调控机理的阐明奠定基础。

