药物控释用丝素蛋白纳微米球的研究进展
吴建兵 张理想 唐麒麟


摘要: 为解决当前慢性疾病治疗过程中给药频繁、药物生物利用度差、毒副作用大等问题,开发性能稳定、释放可控、疗效好、生物安全性高的药物控释体系尤为重要。文章对药物控释体系研究热点之一的纳微米球的材料选择,丝素蛋白纳微米球的成球机理、制备方法及在药物控释体系中的应用等进行综述,重点阐述并比较了丝素蛋白纳微米球制备方法的优缺点与在药物递送中的最新研究进展。结果表明:丝素蛋白纳微米球的研究应着重围绕制备方法、载药性能、释药性能及临床疾病治疗研究等方面充分发挥丝素蛋白纳微米球在药物控释体系中的优势,从而用于慢性疾病的高效治疗。
关键词: 药物控释体系;纳微米球;丝素蛋白;载体;双元药物
中图分类号: TS102.1 文献标志码: A 文章编号: 1001
Abstract: In order to solve the problems of frequent drug administration, poor drug bioavailability, high drug toxicity in the process of chronic disease treatment, it is significant to develop a drug-controlled release system with stable property, controlled release, good curative effect and high biosecurity. This paper summarizes nano-microsphere material selection which is one of research hotspots of drug-controlled release system, formation mechanism and preparation method of silk fibroin nano-microsphere as well as its application in drug-controlled release system. The advantages and disadvantages of silk fibroin nano-microsphere preparation method are expounded and compared. Meanwhile, the latest research progress of silk fibroin nano-microsphere in drug delivery is elaborated. The results indicate that, the research of silk fibroin nano-microsphere should focus on the preparation method, drug loading performance, drug release properties and clinical disease treatment. The strengths of silk fibroin nano-microsphere in drug-controlled release system should be fully utilized to efficiently treat chronic diseases.
Key words: drug-controlled release system; nano-microsphere; silk fibroin; carrier; dual-drug
社会科技进步和生活水平的提升尽管延长了人均寿命,但是依然无法回避人口老龄化所引发的慢性疾病频发的问题。例如糖尿病、高血压、关节炎、眼底黄斑病、牙周疾病等,加剧病人痛苦的同时也增加社会治疗成本,且很多慢性疾病需终身服药。然而,服药过程中存在药物稳定性差、疗效低、毒副作用大等突出问题。药物控释体系是将药物包埋在载体基质上以设定的速率释放,在提高疗效、减少给药次数、降低治疗成本等方面具有显著优势[1]。将药物装载在纳微米级的球状颗粒中是药物控释体系的研究热点。主要原因有:首先,可通过纳微米球的粒径、密度、孔隙等理化性能调控药物的释放速率;其次,可避免部分药物失活、掩味减少药物刺激、降低药物毒性;除此之外,可被人体器官中的网状内皮细胞内吞或融合,以扩散或降解的方式释放药物;最后,可根据临床治疗特点灵活选择给药方式,包括但不限于全身给药和局部给药[2]。
为了充分利用纳微米球在药物控释体系中的优势,解决慢性疾病治疗过程中给药频繁、毒副作用大的问题,本文着重围绕纳微米球的材料选择、丝素蛋白纳微米球的成球机理、制备方法及在药物控释体系中的应用四方面进行综述,并总结目前丝素蛋白纳微米球研究存在的不足及未来努力的方向。
1 药物控释用纳微米球的材料选择
天然、合成及半合成高分子是当前制备纳微米球的主要材料来源。合成高分子制备的聚乳酸(Polylactic acid,PLA)及聚乳酸-羟基乙酸共聚物(Polylactic acid-glycolic acid,PLGA)纳微米球在当前上市制剂中仍是主流,原因在于材料本身具有良好的生物相容性、可控的生物降解性,已被美國FDA批准作为药物控释载体[3]。然而,PLA和PLGA等纳微米球仍存在不足。首先,有机溶剂添加、超声功率输出均会对包埋药物的活性和稳定性有影响,且有机溶剂残留存在潜在风险[4]。其次,不利于亲水性药物的装载。主要原因有两点:一是聚合物分子疏水作用强,与亲水性药物分子间作用力小,药物装载效率低;二是药物难以均匀装载在纳微球载体基质中,更多只能通过物理吸附方式分布在微球表层,直接引起突释,甚至暴释,释放速率难以控制[5]。最后,降解后的酸性物质会引起体内炎症反应[6]。目前,科研学者正尝试利用天然高分子替代,例如明胶[7]、壳聚糖[8]和海藻酸钠[9]等。尽管上述天然高分子在纳微米球的开发和药物控释领域的应用研究中取得进展,但是依然存在许多不足。明胶的提纯工艺复杂;壳聚糖结晶度低,分子排列松散、体内降解过快;海藻酸钠需在制备过程中添加表面活性剂和交联剂才能提高成球性能,生物安全性难以保证。因此,寻找来源广泛、生物相容性好、可塑性优异、降解产物无免疫原性的天然高分子材料,并通过绿色环保、简单高效的方法制备载药率高、释放速率灵活的新型纳微米球,是药物控释体系的重点研究方向。
蚕丝来源简单,享有“人体第二皮肤”的美誉。蚕丝主要由丝素和丝胶两种蛋白构成。丝素蛋白由18种氨基酸组成,能够有效保证材料的生物安全性。丝素蛋白分子主要由重(H)链、轻(L)链和P25糖蛋白构成。其中,交替穿插于结晶区和非结晶区的H链是丝素的主要构成部分。不同于H链、L链由各自C-末端的二硫键相互连接,P25糖蛋白通过疏水作用方式连接到丝素蛋白大分子上[10]。无规卷曲、α螺旋和β折叠是丝素蛋白主要的3种二级结构。无规卷曲最不稳定,一般存在于水溶液中,容易在外界条件刺激下发生结构转变,这也正是丝素蛋白在水溶液中可塑性优异的原因。β折叠结构的分子链段间排列最为规整,能量最低,因而最为稳定。这些独特的分子及二级结构可直接决定丝素蛋白纳微米球的载药、释药及降解性能,从而为药物控释体系的功能性和多样性设计创造有利的条件[11]。
2 丝素蛋白纳微米球的成球机理
为了提高丝素蛋白材料的稳定性,需在制备过程中加入乙醇、盐离子等变性剂,增强丝素蛋白分子间的疏水作用,从而诱导其构象发生改变(无规卷曲转变到β折叠)[12]。Cao等[13]将丝素蛋白溶液通过缓慢搅拌方式滴加到乙醇溶液中,丝素蛋白首先形成亚稳定的微晶相(此时无沉淀析出),再经缓慢低温冷冻(水溶液冷冻后产生剪切力)完全地诱导丝素蛋白构象转变得到稳定的丝素蛋白纳微米球。并猜测丝素蛋白成球存在的两种可能性:一种是丝素蛋白分子首先形成有核的晶相,然后再形成有壳的非晶相,最终形成纳微米球;另一种是非晶相被截留并附着结晶相以形成纳微米球。Lammel等[14]研究不同pH值丝素蛋白溶液经磷酸钾溶液盐析后的成球机理。丝素蛋白分子中的H链末端是由N和C基团组成的亲水性区域。其中,N末端的等电点为4.6,以负电荷为主,而C末端的等电点为10.5,表现为正电荷。丝素蛋白的等电点直接影响氨基酸侧链的电荷分布,进而调控分子间的间距和自组装行为。基于此机理,当pH9.0时,丝素蛋白除C末端外,带电的氨基酸侧链都显负电而存在静电排斥,导致分子构象伸长。随着pH值降低,静电排斥作用减弱,分子构象伸长程度减弱并使得分子间的距离趋于紧密。当pH4.0时,静电排斥被抑制,而紧密的分子间的疏水、氢键作用加强,能够形成稳定的丝素蛋白纳微米球。另外,笔者选择了常用的亲水性药物助剂聚乙二醇(PEG)和丝素蛋白共混制备纳微米球,其成球机理分析认为是分散相的丝素蛋白溶液先在连续相的PEG溶液中形成均匀的液滴。亲水性的PEG分子分布在丝素蛋白分子的周围,并能不断吸收与丝素蛋白表面结合的水分子,使丝素蛋白分子的溶解度降低并暴露疏水结晶区形成微晶相,在氢键及疏水作用力下微晶相又不断聚集形成稳定的丝素蛋白纳微米球而沉淀析出[15]。
3 丝素蛋白纳微米球的制备方法
目前制备丝素蛋白纳微米球的方法比较成熟,主要制备方法见表1。
由表1可见,制备方法所选择的工艺参数条件直接决定了丝素蛋白纳微米球的尺寸大小。例如喷雾干燥法、电压驱动成球法及微流控法制备得到的丝素蛋白纳微米球的粒径主要与喷嘴的孔径有关,脂质体模板法、盐析法、溶剂-非溶剂法及液中干燥法制备得到的丝素蛋白纳微米球的粒径主要与丝素蛋白的浓度有关,乳化溶剂挥发法及化学交联法制备的丝素蛋白纳微米球的粒径主要与乳化剂及搅拌的速率有关。另外,制备方法直接决定丝素蛋白纳微球的成球性能和载药性能。其中喷雾干燥法、脂质体模板法、电压驱动成球法、微流控法都需要经过后处理来提高丝素蛋白纳微米球的结构稳定性,进而延缓药物的释放,尤其喷雾干燥法不利于活性受温度影响的药物。盐析法、溶剂-非溶剂法,以及液中干燥法的成球易粘连,分散性差,药物含量也会影响成球性能。乳化溶剂挥发法制备的丝素蛋白纳微米球需通过甲醇等有机溶剂处理提高稳定性。除此之外,制备流程繁琐、影响因素和工艺条件难以控制,只能停留在实验室小批量生产。双相乳化交联法主要利用丝素蛋白中的羟基、羧基及氨基等反应性基团与小分子交联剂或合成大分子反应,如添加京尼平、戊二醛等交联剂等形成丝素蛋白纳微米球,尽管可直接提高丝素蛋白纳微米球中的β折叠含量,但是添加的交联剂可能存在安全隐患。
4 丝素蛋白纳微米球作为药物控释载体的研究进展
4.1 单一小分子药物
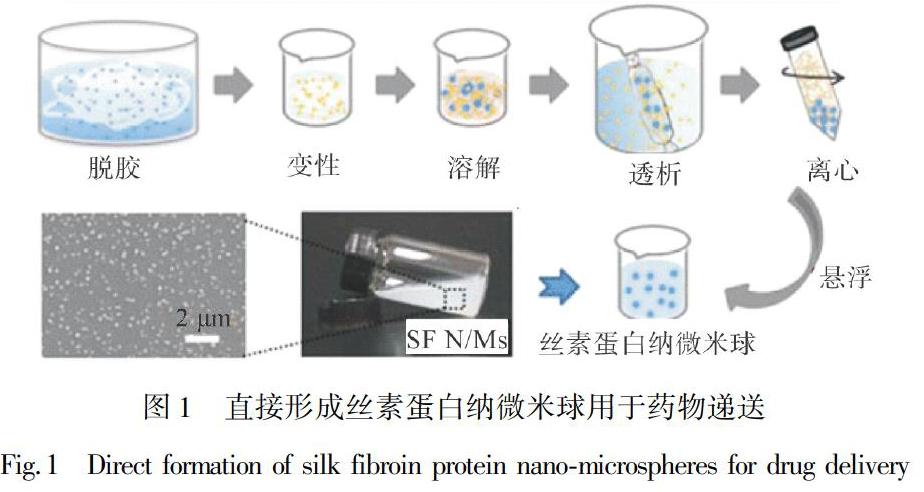
小分子药物通常存在毒副作用大、稳定性差、生物利用度差、疗效低等突出问题。利用丝素蛋白具有亲水无定型区和疏水结晶区等独特的特性,可为小分子药物的有效负载和稳定性的提高创造有利条件。Pritchard等[22]将抗生素药物包埋在丝素蛋白纳微米球中,研究发现丝素蛋白纳微米球在保持抗生素稳定性的同时,延缓了抗生素的作用时间。另外,发现丝素蛋白纳微米球的存在有助于鼠感染伤口的愈合,疗效提高的同时也减少了用药频率。Xiao等[23]接着通过优化溶剂体系精准调控丝素蛋白的纯化过程,直接制备得到100~200 nm的丝素蛋白纳微米球,如图1所示;以盐酸阿霉素抗癌药物为模型,并成功地负载在丝素蛋白纳微米球中,并改变释放液的pH值来调控药物的释放速率(4.5>6.0>7.0),从而满足肿瘤组织酸性条件下释放速率更快的要求。另外,高分散的负载有盐酸阿霉素的丝素蛋白纳微米球对癌细胞有较强的细胞毒性,有望后期用于癌症的临床治疗。Li等[24]利用自组装法制备得到包封率为7.7%、载药率为1.54%的埃洛替尼-丝素蛋白纳微米球。与游离药物相比,丝素蛋白纳微米球的存在能有效延缓药物的释放速率并对细胞发挥更持久的毒性,有望用于乳腺癌的高效治疗。笔者利用液中干燥法制备了姜黄素-丝素蛋白纳微米球,如图2所示。通过体外释放数据发现,不同粒径大小的丝素蛋白纳微米球可实现对姜黄素药物精准释放调控。对大鼠进行口服给药后发现,经丝素蛋白纳微米球包埋的姜黄素相比于纯姜黄素颗粒更有助于体内吸收(图2)。该研究证实了丝素蛋白纳微米球能提高疏水性药物的溶出度,进而提高了姜黄素在大鼠体内的生物利用度[25]。尽管丝素蛋白纳微米球在单一小分子药物的负载和释放等方面取得一定进展,但是依然存在藥物的装载效率低、亲水性药物突释甚至暴释、疏水性药物滞释等问题。
4.2 单一大分子药物
生物活性多肽及蛋白质大分子药物具有给药后的毒副作用小、见效快、疗效好等优势,已成为当前药物控释体系的研究热点,但是依然存在生物半衰期短、不易透过生物膜、易在体内酶解等问题,从而无法有效发挥药物的最佳疗效。丝素蛋白纳微米球是大分子药物的优异载体,在药物控释体系的应用研究中取得了一系列进展。例如,Zhang等[26]首次报道了利用自组装方法将将寡脱氧核苷酸(Oligodeoxynucleotides,ODNs)包埋在丝素蛋白纳微米球上(Silk Fibroin-ODNs Nanospheres,SF-ODNs NPs),解决了ODNs无法有效转染到免疫细胞中的难题,有望用于免疫疾病的治疗。Germershaus等[27]分别将聚赖氨酸和鱼精蛋白装载在丝素蛋白纳微米球中,发现丝素蛋白分子与蛋白药物分子之间的静电作用力受溶液的离子强度调控,明确相互作用机制的同时也为蛋白药物的选择提供了理论支撑。Schultz等[28]将胰岛素生长因子I(Insulin Growth Factor,IGF-I)包埋在丝素纳微米球中,并对IGF-I的空气动力学和释放性能进行表征,经体外人肺叶模型研究表明,IGF-I可有效穿过肺上皮屏障,这为肌肉萎缩症的治疗提供了一种全新的给药方式。笔者利用液中干燥法将奥曲肽装载在丝素蛋白纳微米球中,经体外释放研究发现,甲醇、乙醇处理的奥曲肽-丝素蛋白纳微米球的高β折叠含量能显著降低了突释,并实现了奥曲肽的零级长效释放(102天)。经大鼠肌肉注射高剂量乙醇处理的奥曲肽-丝素蛋白纳微米球后,28天内体内的血药浓度一直高于50 pg/mL,且在56天后血药浓度升高到280 pg/mL,分析认为与丝素蛋白纳微米球在体内降解有关。该研究证实了丝素蛋白纳微米球具有实现奥曲肽的长效缓释的潜力,为后期开发新型长效缓释奥曲肽制剂提供了研究基础[6]。另外,经丝素蛋白纳微米球负载的蛋白药物的稳定性和药物活性相比于游离态明显提高[12]。
4.3 双元药物协同组合
除了负载单一的药物之外,多种药物同时负载在丝素蛋白纳微米球载体基质中实现协同高效治疗是当前的研究热点。Li等[29]利用自组装法将姜黄素和5-氟尿嘧啶两种抗癌药物装载到丝素蛋白纳微米球中(217 nm±0.4 nm),两种药物的负载效率分别为15%和45%,并实现了长效缓慢释放。另外,这双药递送系统能显著增加活性氧的水平,有助于抑制肿瘤生长,证实了双元药物基丝素蛋白纳微米球能高效治疗乳腺癌。Numtata[30]等首先利用溶剂-反溶剂法将FITC负载在丝素蛋白纳米微球中,然后将含有异硫氰基荧光素(Fluoresceine Isothiocyanate,FITC)的丝素蛋白纳微米球的丝素-乙醇溶液经涡旋形成凝胶,最后将其浸泡在罗丹明B(Rhodamine B,RhB)的水溶液中制备含双药的丝素蛋白纳微米球-凝胶复合载体系统。体外释放实验研究发现,相比于纯丝素蛋白纳微米球,丝素蛋白纳微米球-凝胶复合载体系统的空间阻碍能进一步延缓FITC、RhB的释放速率。因此,利用双药释放系统可针对不同类型的生物活性分子的释放速率的要求灵活设计。Hassani等[31]首先将血管内皮生长因子包埋在丝素蛋白纳微米球中,然后再嵌入到含有万古霉素的丝素蛋白支架中构建双重药物释放系统。经体外释放动力学表明,万古霉素和血管内皮生长因子分别在21天和28天内释放了9956%和14%,释放的万古霉素能有效抑制金黄色葡萄球菌的生长;且血管内皮生长因子的生物活性依然达到75%,有望解决骨组织修复过程中细菌感染的问题。Crivelli等[32]发现丝素蛋白纳微米球是双药(塞来昔布或姜黄素)的細胞和血液相容性的最佳载体,证实了丝素蛋白纳微米球可以促进双药的抗炎特性,并可以用于骨关节炎的高效治疗。
5 结 论
首先,氨基酸为组成单位的丝素蛋白纳微米球具有优异的生物相容性和可靠的生物安全性。其次,制备方法和机理研究的不断优化与深入为丝素蛋白高效装载药物提供了技术和理论支撑。最后,以丝素蛋白纳微球为载体基质实现从单一的小分子药物到双元药物的成功装载及高效递送为药物控释制剂的研发和应用提供了丰富的实践依据。
尽管丝素蛋白纳微米球极具开发潜力,但起步晚,有许多不足之处。丝素蛋白纳微米球需后处理,流程增加的同时影响药物的载药量和活性;释放速率难以精准调控,难溶性药物存在滞释,甚至停释的现象;研究仅停留在实验室可行性的研究基础上,目前尚未有针对丝素蛋白纳微米球的控释制剂问世,离真正的临床治疗应用尚有距离。因此,科研学者们应重点在丝素蛋白纳微米球的理化性能、载、释药性能,以及不同的给药途径需求上下足功夫。
PDF下载参考文献:
[1]TIWARI G, TIWRRI R, SRIWASTAWA B, et al. Drug delivery systems: an updated review[J]. International Journal of Pharmaceutical Investigation, 2012, 2(1): 2-11.
[2]ZIMMER A, KREUTER J. Microspheres and nanoparticles used in ocular delivery systems[J]. Advanced Drug Delivery Reviews, 1995, 16(1): 61-73.
[3]ANDERSON J M, SHIVE M S. Biodegradation and biocompatibility of PLA and PLGA microspheres[J]. Advanced Drug Delivery Reviews, 2012, 64: 72-82.
[4]SHIRANGI M,HENNINK W E, SOMSEN G W, et al. Identification and assessment of octreotide acylation in polyester microspheres by LC-MS/MS[J]. Pharmaceutical Research, 2015, 32(9): 3044-3054.
[5]FU K, PACK D W, KLIBANOV A M, et al. Visual evidence of acidic environment within degrading poly(lactic-co-glycolic acid)(PLGA) microspheres[J]. Pharmaceutical Research, 2000, 17(1): 100-106.
[6]GONG H, WANG J, ZHANG J, et al. Control of octreotide release from silk fibroin microspheres[J]. Materials Science and Engineering: C, 2019, 102: 820-828.
[7]LEONG W, KREMER, WANG D A. Development of size-customized hepatocarcinoma spheroids as a potential drug testing platform using a sacrificial gelatin microsphere system[J]. Materials Science and Engineering: C, 2016, 63: 644-649.
[8]SARANYA TS, RAJAN V K, BISWAS R, et al. Synthesis, characterisation and biomedical applications of curcumin conjugated chitosan microspheres[J]. International Journal of Biological Macromolecules, 2018, 110: 227-233.
[9]QI X, QIN X, YANG R, et al. Intra-articular administration of chitosan thermosensitive in situ hydrogels combined with diclofenac sodium-loaded alginate microspheres[J]. Journal of Pharmaceutical Sciences, 2016, 105(1): 122-130.
[10]KOH L D, CHENG Y, TENG C P, et al. Structures, mechanical properties and applications of silk fibroin materials[J]. Progress in Polymer Science, 2015, 46: 86-110.
[11]MOTTAGHITALAB F, FAROKHI M, SHOKRGOZAR M A, et al. Silk fibroin nanoparticle as a novel drug delivery system[J]. Journal of Controlled Release, 2015, 206: 161-176.
[12]NUMATA K, KAPLAN D L. Silk-based delivery systems of bioactive molecules[J]. Advanced Drug Delivery Reviews, 2010, 62(15): 1497-1508.
[13]CAO Z, CHEN X, YAO J, et al. The preparation of regenerated silk fibroin microspheres[J]. Soft Matter, 2007, 3(7): 910-915.
[14]LAMMEL A S, HU X, PARK S H, et al. Controlling silk fibroin particle features for drug delivery[J]. Biomaterials, 2010, 31(16): 4583-4591.
[15]WU J, ZHENG Z, LI G, et al. Control of silk microsphere formation using polyethylene glycol(PEG)[J]. Acta Biomaterialia, 2016, 39: 156-168.
[16]HINO T, TANIMOTO M, SHIMABAYASHI S. Change in secondary structure of silk fibroin during preparation of its microspheres by spray-drying and exposure to humid atmosphere[J]. Journal of Colloid and Interface Science, 2003, 266(1): 68-73.
[17]WANG X, WENK E, MATSUMOTO A, et al. Silk microspheres for encapsulation and controlled release[J]. Journal of Controlled Release, 2007, 117(3): 360-370.
[18]WENK E, WANDREY A J, MERKLE H P, et al. Silk fibroin spheres as a platform for controlled drug delivery[J]. Journal of Controlled Release, 2008, 132(1): 26-34.
[19]BRESLAUER D N, MULLER S J, LEE L P. Generation of monodisperse silk microspheres prepared with microfluidics[J]. Biomacromolecules, 2010, 11(3): 643-647.
[20]SRIANAM P, SRISUWAN Y, IMSOMBUT T, et al. Silk fibroin microspheres prepared by the water-in-oil emulsion solvent diffusion method for protein delivery[J]. Korean Journal of Chemical Engineering, 2011, 28(1): 293-297.
[21]IMSOMBUT T, SRISUWAN Y, SRIANAM P, et al. Genipin-cross-linked silk fibroin microspheres prepared by the simple water-in-oil emulsion solvent diffusion method[J]. Powder Technology, 2010, 203(3): 603-608.
[22]PRITCHARD E M, VALENTIN T, PANILAITIS B, et al. Antibiotic-releasing silk biomaterials for infection prevention and treatment[J]. Advanced Functional Materials, 2013, 23(7): 854-861.
[23]XIAO L, LU G, LU Q, et al. Direct formation of silk nanoparticles for drug delivery[J]. ACS Biomaterials Science & Engineering, 2016, 2(11): 2050-2057.
[24]LI H, QIU H, WANG J, et al. Erlotinib-silk fibroin nanoparticles in inhibiting tumor[J]. Polymer Bulletin, 2019, 76(9): 1-10.
[25]WU J, WANG J, ZHANG J, et al. Oral delivery of curcumin using silk nano-and microparticles[J]. ACS Biomaterials Science & Engineering, 2018, 4(11): 3885-3894.
[26]ZHANG H, LAI L, WANG Y, et al. Silk fibroin for CpG oligodeoxynucleotides delivery[J]. ACS Biomaterials Science & Engineering, 2019,5(11): 6082-6088.
[27]GERMERSHAUS O, WERNER V, KUTSCHER M, et al. Deciphering the mechanism of protein interaction with silk fibroin for drug delivery systems[J]. Biomaterials, 2014, 35(10): 3427-3434.
[28]SCHULTZ I, VOLLMERS F, LUHMANN T, et al. Pulmonary insulin-like growth factor I delivery from trehalose and silk-fibroin microparticles[J]. ACS Biomaterials Science & Engineering, 2015, 1(2): 119-129.
[29]LI H, TIAN J, WU A, et al. Self-assembled silk fibroin nanoparticles loaded with binary drugs in the treatment of breast carcinoma[J]. International Journal of Nanomedicine, 2016, 11: 4373-4380.
[30]NUMATA K, YAMAZAKI S, NAGA N. Biocompatible and biodegradable dual-drug release system based on silk hydrogel containing silk nanoparticles[J]. Biomacromolecules, 2012, 13(5): 1383-1389.
[31]HASSANI B N, DAMOOGH S, ZAFAR B, et al. Preparation of a codelivery system based on vancomycin/silk scaffold containing silk nanoparticle loaded VEGF[J]. ACS Biomaterials Science & Engineering, 2018, 4(8): 2836-2846.
[32]CRIVELLIB, BARI E, PERTEGHELLA S, et al. Silk fibroin nanoparticles for celecoxib and curcumin delivery: ROS-scavenging and anti-inflammatory activities in an in vitro model of osteoarthritis[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 137: 37-45.

