低温条件下人工湿地氨氧化微生物的群落结构特征
蔡张杰 崔丽娟 李晶 李伟 雷茵茹


摘要:為了解冬季低温条件下人工湿地沉积物的氨氧化潜力及其影响因素,以北京市汉石桥湿地自然保护区内的人工湿地为研究对象,测定了不同湿地单元沉积物的硝化潜势(PNR)及其相关功能基因的丰度。结果表明,沉积物的PNR较高,说明冬季人工湿地具有较高的硝化潜力。PNR从入水段到出水段呈现先增加后减少的趋势。通过建立硝化活性与功能微生物丰度的线性回归模型发现,氨氧化古菌(AOA,以AOA的 amoA基因丰度表征)是影响硝化潜势的主要功能微生物。进一步构建硝化微生物丰度与环境因子的回归方程,发现影响AOA amoA基因丰度的主要环境因子是碳氮比(C/N),影响氨氧化细菌(AOB,以AOB的 amoA基因丰度表征)丰度的主要环境因子是全氮(TN)含量。高通量测序测定人工湿地沉积物AOA和AOB的群落组成,各湿地单元检测到的AOB群落优势门为Proteobacteria,主要是β-Proteobacteria纲,AOA主要属于Crenarchaeota和Thaumarchaeota 2个门类。湿地4单元和5单元,1单元和6单元在AOB菌群群落组成上较为接近;湿地6单元、7单元、8单元在AOA菌群群落组成上较为接近。
关键词:人工湿地;硝化潜势;功能基因丰度;群落结构;环境因子
中图分类号:X171.1文献标识码:A文章编号:1000-4440(2020)02-0373-11
Abstract:To understand the potential nitrification rate of the constructed wetland sediments under low temperature conditions in winter and its influencing factors, the constructed wetland in the Hanshiqiao Wetland Nature Reserve in Beijing was selected as the research area, and the potential nitrification rate (PNR) and the abundance of their related functional genes were investigated. The results showed that the PNR of the sediment was higher, indicating that the constructed wetland had higher nitrification potential in winter. The PNR increased first and then decreased from the inlet section to the outlet section. By establishing a linear regression model of nitrification activity and functional microbial abundance, we found that ammonia-oxidizing archaea (AOA, characterized by the abundance of amoA gene in AOA) was the main functional microorganism affecting the nitrification potential. By further constructing the regression equation of microbial abundance and environmental factors, it was found that the main environmental factor affecting the abundance of AOA amoA gene was carbon-nitrogen ratio (C/N), and the main environmental factor affecting the abundance of ammonia-oxidizing bacteria (AOB, characterized by abundance of amoA gene in AOB) was total nitrogen (TN) content. High-throughput sequencing was used to determine the community composition of AOA and AOB in constructed wetland sediments. The dominant phylum of AOB community in each wetland unit was Proteobacteria, which was mainly composed of β-subdivision of Proteobacteria, and AOA mainly belonged to Crenarchaeota and Thaumarchaeota. In terms of community composition, for AOB, wetland units 4 and 5, 1 and 6 were relatively similar in flora composition, for AOA, wetland units 6, 7, 8 were relatively close.
Key words:constructed wetland;potential nitrification rate;functional genes′ abundance;community structure;environmental factor
人工湿地能够有效处理氮素污染,其主要的除氮机制为植物和微生物的作用[1-2]。微生物以其主导的硝化-反硝化作用等过程可去除60%~90%的氮[3-5]。氨氧化作用是硝化作用的限速步骤,是氮循环的中心环节。在中国北方,冬季低温条件下,植物衰老死亡后其吸收的氮素分解回归湿地环境,微生物代谢缓慢,有机质在基质中积累[6],导致人工湿地生态系统在冬季低温时运行效率较低[7-8],进而影响人工湿地的推广普及。近年来,国内外学者开展了对人工湿地冬季低温条件下运行状况的研究。这些研究多用水体氮形态变化表征除氮效果,较少涉及沉积物的硝化作用,也较少从功能微生物的角度评价除氮效果。
本研究以北京市汉石桥湿地自然保护区的人工湿地为对象,采集冬季冰封期不同处理单元的沉积物,测定其硝化潜势,并测定氨氧化功能基因(amoA)的丰度以及环境因子,揭示冬季低温条件下人工湿地的硝化潜势及其生物和非生物影响因子,以期为提高湿地冬季运行效率提供理论参考。此外本研究采用Miseq高通量测序的方法分析不同处理单元的反硝化细菌群落,利用冗余分析方法探究其与环境因子的关系,以期为人工湿地氨氧化细菌、氨氧化古菌群落结构的空间分布以及细菌环境影响因子的研究提供依据,为人工湿地微生物除氮机制研究提供理论依据。
1材料与方法
1.1研究区概况及样品采集
北京市汉石桥人工湿地建于2015年,共有8个处理单元(图1)。1单元的水源是游船区的湖水,2单元的水源是附近餐厅和厕所的污水。人工湿地总面积约为3 400 m2,种植的植物为香蒲、菖蒲、水葱、芦苇等。各单元底部均铺有砂石或砾石防渗,单元之间通过下方管道实现水流的连通。湿地内的水经多级处理,达到Ⅱ类水的标准后,通过地下管道从8单元排入附近河道。人工湿地在每年3月中旬蓄水,11月底入冬后排干。于2018年3月1日湿地无水期,在人工湿地8个处理单元各采集0~20 cm深的3个沉积物样品,共24个样品。
1.2沉积物理化性质和活性指标的测定
按照文献[9]的方法,测定沉积物的pH值以及有机质(OM)、全碳(TC)、全氮(TN)、铵态氮(NH+4-N)、硝态氮(NO-3-N)含量。用电位法(土水比1.0∶2.5,质量比)测定pH值,用Cytation 5多功能酶标仪(BioteK,USA)测定有机质含量,用Vario Ⅱ元素分析仪(Elementar,German)测定TC和TN含量,用SmartChem200全自动间断化学分析仪(WestCo,USA)测定NH+4-N和NO-3-N含量。硝化潜势(PNR)的测定(以NO-2-N计)采用氯酸盐抑制法[10]。
1.3DNA的提取和PCR扩增
利用Power Soil土壤DNA提取试剂盒(German,QIAGEN)提取基因组DNA。氨氧化古菌(AOA)和氨氧化细菌(AOB)的amoA基因定量PCR分析均在Light Cycler 480Ⅱ(Roche,Switzerland)上进行。PCR反应体系为25.0 μl,包含12.5 μl TB Green Premix Ex Taq Ⅱ(TaKaRa公司产品),正、反向引物各1.0 μl,DNA模板1.0 μl,其余用ddH2O(Takara,Japan)补足至25.0 μl。定量PCR所用引物及反应条件见表1。全部样品使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司产品)切胶回收PCR产物,Tris_HCl洗脱,2%琼脂糖凝胶电泳检测。将纯化产物通过Illumina MiSeq平台的标准测试方法进行高通量测序(由美吉桑格生物医药科技有限公司完成测序)。
1.4序列处理
应用Usearch软件将所有优化序列Map至OUT代表序列,选出与OUT代表序列相似性在97%以上的序列,生成OUT表格。使用Qimme平台与RDP Classifier贝叶斯算法對97%相似水平的OUT代表序列进行分类学分析,对比SILVA数据库,统计每个样品的群落组成。若分类学数据库中出现一些分类学谱系中的中间等级没有科学名称,以norank作为标记。分类学对比后根据置信度阈值进行筛选,如果某些分类谱系在某一分级别分值较低,在统计时以Unclassified标记。
1.5数据处理和分析
使用Microsoft Excel2013软件(Microsoft,USA)进行试验数据初步处理,使用SPSS22.0软件(Chicago,IL,USA)进行统计分析,在OriginPro2018软件(OriginLab,USA)上完成制图。采用单因素方差分析(one-way ANOVA)的Duncans法(P<0.05)检验多组样本之间的差异性,采用成对数据t检验分析AOA与AOB amoA丰度的差异性。采用Spearman相关系数分析两组变量之间的相关性,并用线性回归进一步确定变量之间的关系。使用上海美吉生物医药科技有限公司的I-Sanger云平台进行微生物的多样性分析和分类学分析。
2结果与分析
2.1人工湿地沉积物主要理化性质与硝化活性
测定结果(表2)表明,人工湿地沉积物pH值介于7.97与8.34之间,呈弱碱性,在1单元和2单元之间pH值有显著差异,其他单元之间均无显著差异,1单元和6单元pH值最大,分别为8.25和8.34。OM、TC、TN含量从2单元至出水单元(8单元)均显著降低(P<0.05)。C/N在1~5单元和6~8单元间存在显著差异(P<0.05),其变化范围为8.59~14.11。NH+4-N含量在1、4单元间存在显著差异,其他单元之间不存在显著差异,但存在一定的先增加后减少的趋势。NO-3-N含量在4、5单元和其他单元之间存在显著差异,该湿地各单元NH+4-N和NO-3-N含量均处于较高水平。
图2显示,3单元的硝化潜势(PNR)最高[(0.30±0.02) μg/(g·h)],6单元最低[(0.01±0) μg/(g·h)]。从3单元到8单元沉积物的PNR呈现显著降低的趋势(P<0.05)。
2.2人工湿地氨氧化微生物功能基因丰度
利用实时荧光定量PCR技术对各湿地单元沉积物样品的氨氧化细菌(AOB)和氨氧化古菌(AOA)的amoA基因进行分析(图3)。成对数据t检验结果表明,在所有湿地单元中,AOA amoA基因丰度均显著高于AOB amoA基因丰度(t=6.678,P<0.01),二者的比值为1.44~31.35。在所有湿地单元中,AOA和AOB的amoA基因丰度分别为1 g 1.55×107~2.65×108拷贝、8.12×106~1.58×107拷贝。单因素方差分析结果表明,人工湿地3单元和4单元AOA amoA基因丰度与其他单元存在显著差异(F=168.506,P<0.01)。人工湿地入水单元(1单元、2单元)AOB amoA基因丰度与其他单元存在显著差异(F=9.471,P<0.01)。
分析PNR与相关功能基因的关系,结果表明PNR与沉积物中AOA amoA基因丰度呈极显著正相关关系(相关系数为0.693**,P<0.01),AOA amoA基因丰度越高,PNR越大。说明该人工湿地在低温条件下,AOA在硝化过程中作用较为重要。进一步分析氨氧化功能基因丰度与环境因子的关系,结果(表3)表明人工湿地冬季沉积物AOA amoA基因丰度与沉积物C/N呈极显著负相关关系。AOB amoA基因丰度与OM、TC、TN含量呈极显著正相关关系。
进一步对各功能基因与环境因子进行多元逐步回归。结果(表4)表明,沉积物C/N比对人工湿地AOA amoA基因丰度影响最大,回归方程决定系数R2为0.225;沉积物TN含量对AOB amoA基因丰度影响最大,回归方程R2为0.332。
2.3人工湿地氨氧化微生物的α-多样性
α-多样性指标(OUT水平)可以在一定程度上表示样点的群落特征。本研究中计算的α-多样性指标有:丰富度指数(Chao1、ACE),表示一个群落中物种的复杂程度,值越高表明群落内物种的数目越多;优势度指数(Simpson指数),表示一个群落中优势菌群的地位和贡献,值越高表明群落内物种数量差异越大,优势菌群的主导地位越突出;多样性指数(Shannon指数),是物种丰富度和均匀度的综合指标,也是对Chao1指数和Simpson指数综合的一个指数[12]。为了保证样品的序列数一致,在计算各指标之前,对样本OUT数目进行随机抽平。计算结果(表5)显示,氨氧化细菌Chao1指数最高的是3单元(58.00),最低的是5单元(31.00); Simpson指数最高的为1单元(0.27),最低的为8单元(0.13);Shannon指数最高的为8单元(2.47),最低的是1单元(1.58)。氨氧化古菌Chao1指数最高的是3单元(68.00),最低的是2单元(36.50); Simpson指数最高的为5单元(0.34),最低的为8单元(0.10);Shannon指数最高的为8单元(2.88),最低的是2单元(1.53)。
2.4人工湿地氨氧化微生物的β-多样性
β-多样性(OUT水平)可以用来比较各样点间群落的差异,基于Bray-Curtis差异度指数计算样点间的差异,进而对微生物群落排序,选取解释度最大的两轴做PCA图(图4)。对于AOB,两轴对排序结果的解释度分别为60.96%和19.57%。1单元和6单元,4单元和5单元的距离较近,说明这两组的氨氧化细菌群落结构更相似。1单元和7单元距离最远,说明这2个单元的氨氧化细菌群落结构差异较大。对于AOA,两轴对排序结果的解释度分别为61.95%和22.46%。1~5单元距离很近,说明这5个单元的氨氧化古菌群落结构更相似;6单元和7单元距离最远,说明这2个单元的氨氧化古菌群落结构差异较大。这个结果与人工湿地沉积物氨氧化微生物的聚类结果(OUT水平)类似(图5)。
2.5人工湿地氨氧化微生物的群落组成
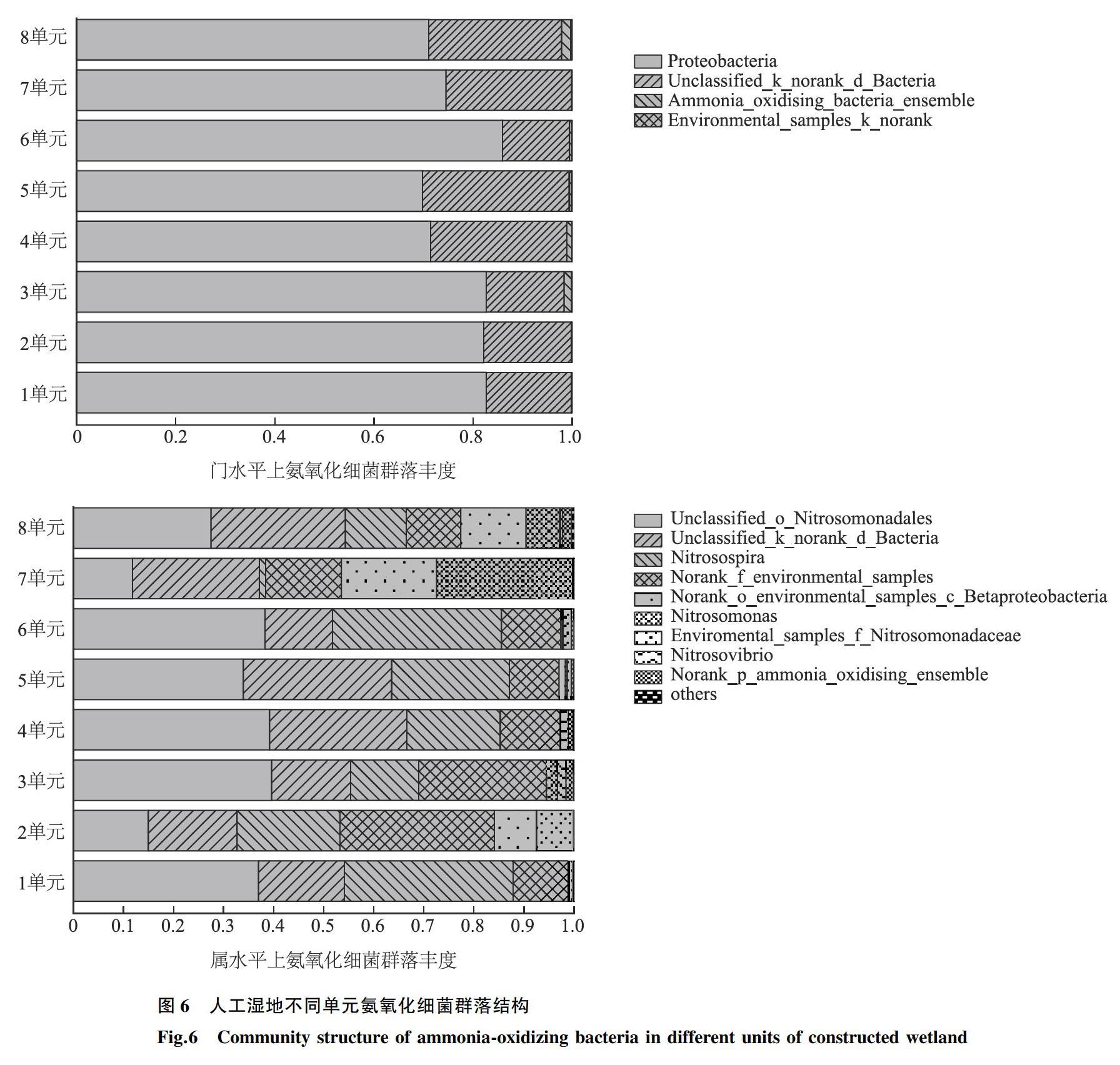
对人工湿地沉积物样品氨氧化细菌的所有序列进行聚类,共得到109个OTU,通过分类学统计得到门、属2个水平的细菌群落结构组成。分别统计其门、属类别的构成,形成柱状图(图6),同时分析其在各个水平上的菌群结构。结果显示检测所得OUT主要属于3个门类,分别是Proteobacteria(77.52%)、Unclassified_k_norank_d_Bacteria(21.68%)、Ammonia_oxidising_bacteria_ensemble(0.69%)。在属水平上,所得OUT主要属于9个属,分别为Unclassified_o_Nitrosomonadales(30.28%)、Unclassified_k_norank_d_Bacteria(21.68%)、Nitrosospira(19.64%)、Norank_f_environmentl_samples(15.88%)、Norank_o_environmental_sample_c_Betaprotebacteria(0.05%)、Nitrosomonas(0.05%)、Environmental_samples_f_Nitrosomonadaceae(0.009%)、Nitrosovibrio(0.008%)、Norank_p_ammonia_oxidising_ensemble(0.007%)。
對沉积物样品氨氧化古菌的测序序列进行聚类后,共得到74个OTU,通过分类学统计得到在门和属上的群落结构组成(图7)。检测所得OUT主要属于4个门类,分别是Unclassified_k_norank_d_Archaea(66.09%)、Crenarchaeota(24.02%)、Environmental_sample_k_norank_d_Archaea(7.48%)、Thaumarchaeota(2.32%)。在属水平上,所得OUT主要属于4个属,分别是Unclassified_k_norank_d_Archaea(66.09%)、Norank_c_environmental_samples_p_Crenarchaeota(24.02%)、Norank_p_environmental_sample_k_norank(7.48%)、Nitrososphaera(2.26%)。
为比较不同单元氨氧化微生物群落组成的差异,应用Bray-Curtis距离算法和Complete聚类方法,将高丰度和低丰度的物种分块聚类,通过颜色梯度及相似程度反应多个样本在各分类水平上群落组成(属水平)的相似性和差异性(图8)。结果表明,氨氧化细菌群落相似度最高为86.6%,相似度较高,4单元与5单元,1单元与6单元菌群群落组成较为相近。氨氧化古菌群落相似度最高为87.2%,相似度较高,6单元、7单元、8单元与3单元、5单元、4单元、1单元、2单元群落组成相差较大,其中1单元与2单元,7单元与8单元菌群群落组成较为相似。
2.6人工湿地氨氧化微生物与沉积物理化性质的相关性
对沉积物理化环境因子与氨氧化微生物主要菌落(属)所占比重进行中心标准化,并进行校正(蒙特卡洛置换检验),提取第一与第二坐标轴信息,进行冗余分析,发现对于氨氧化细菌,第一和第二坐标轴对方差总解释率为83.10%。在所测样品中,Nitrosomonas、Norank_o_environmental_samples_c_Bataproteobacteria、Norank_f_environmental_samples与沉积物中TC含量、TN含量、OM含量、C/N比呈正相关关系,与pH、NO-3-N含量呈负相关关系。而Environmental_samples-f_Nitrosomonadaceae、Unclassified_o_Nitrosomonadales与pH、NO-3-N含量呈正相关关系,与TC含量、TN含量、OM含量、C/N比呈负相关关系。对于氨氧化古菌,Nitrososphaera、Unclassified_k_norank_d_Bacteria、Norank_c_environmental_samples_p_Crenarchaeota与pH、C/N比呈正相关关系,与TC含量、TN含量、OM含量、NH+4-N含量、NO-3-N含量呈负相关关系。
进一步进行环境因子与物种的相关分析(图9)。对于氨氧化细菌,pH值与Nitrosovibrio、Unclassified_o_Nitrosomonadales呈显著正相关关系(r=0.810,P<0.05;r=0.714,P<0.05)与Norank_o_environmental_sample_c_Betaprotebacteria呈显著负相关关系(r=-0.738,P<0.05),Environmental_samples_f_Nitrosomonadaceae与NO-3-N含量呈显著负相关关系(r=-0.756,P<0.05)。对于氨氧化古菌,OM含量与Norank_c_environmental_samples_p_Crenarchaeota呈负相关关系(r=-0.785,P<0.05)。
3讨论
本研究探讨了低温条件下人工湿地沉积物硝化潜势,并应用高通量测序技术,针对氨氧化微生物的功能基因amoA进行扩增,较全面地考察了人工湿地冬季低温时期沉积物中氨氧化微生物的群落组成,从α-多样性、β多样性、群落组成及其与环境因子的关系等方面进行分析。硝化潜势是短期人为添加外源氮条件下的硝化强度,反映的是硝化作用的第一步——氨氧化作用的潜力,其产物NO-2是一些厌氧过程底物的重要来源,硝化作用是湿地环境有氧无氧界面的一个重要过程[10]。本研究中,冬季人工湿地沉积物PNR最大值为0.30 μg /(g·h),高于国内农田和森林生态系统PNR的平均水平,低于草地生态系统PNR[13]。
土壤微生物是土壤生化过程的驱动者,其生物量、群落结构、活性等特性都会直接影响到土壤硝化潜势[5,14]。在本研究中,沉积物AOA amoA基因丰度显著高于AOB amoA基因丰度。相关分析结果也表明,硝化潜势和AOA amoA基因丰度呈现极显著的正相关关系,AOA在本研究的人工湿地硝化作用中发挥着重要的作用,这与杭州湾滨海湿地沉积物及中国南方酸性土壤中AOA占主导优势的结论相一致[15-16]。AOA和AOB有生态位分异的特征[16]。本研究中,人工湿地沉积物AOA amoA基因丰度与C/N比值呈极显著负相关关系,AOB amoA基因丰度与OM、TC、TN含量均呈极显著正相关关系,这与章芳等[17]的研究结果相似。多元回归分析结果表明,C/N比值是影响AOA amoA丰度的主要环境因子,C/N比值影响有机质的矿化,C/N比值越低,有机质分解速率越快[17]。TN含量是影响AOB amoA的主要环境因子。
在计算氨氧化细菌(AOB)和氨氧化古菌(AOA)的α-多样性时,由于各指数计算方法的不同,不同指标给出的结果略有差异。本研究中Chao1指数(丰富度指数)最高单元的Shannon指数(多样性指数)并不是最高,同样,Shannon指数最高单元的Chao1指数也并不是最高。例如3单元AOB的Chao1指数最高,但其Shannon指数仅为1.88,其最大值为2.47;3单元AOA的Chao1指数最高,但其Shannon指数仅为2.15,最高为2.88。8单元AOB的Shannon指数最高,但其Chao1指数为57.43,最高为58.00;8单元AOA的Shannon指数最高,但其Chao1指数为61.00,最高为68.00。出现这种现象的原因是,3单元中氨氧化微生物的群落组成最复杂,但群落内个体数目的分布不均匀,而8单元群落组成不是最复杂,但其群落组成分布均匀。而Simpson指数(优势度指数)较高单元的Chao1指数(丰富度指数)往往较低,Simpson指数较低单元的Chao1指数往往较高。
氨氧化微生物在氮素循环中占有重要的地位,是土壤中较敏感的功能性微生物类群[18]。在群落组成上,氨氧化细菌的群落多样性高于氨氧化古菌。本研究中,各湿地单元检测到的氨氧化细菌群落优势门为Proteobacteria,主要是由β-Proteobacteria(77.51%)组成。β-Proteobacteria作為优势门的优势纲,常见于淡水环境中[19],海洋中较少发现。人工湿地中β-Proteobacteria绝大多数属于Nitrosomonadales目Nitrosomonadaceae科。Nitrosomonadaceae科主要包含Nitrosospira和Nitrosomonas 2个属[20]。Nitrosomonas在硝化作用第一阶段起主导作用,可以促进NH+4氧化成NO-2;Nitrosospira是陆地生态系统中的优势种,可作为硝化细菌,将亚硝酸盐氧化为硝酸盐[21]。本研究中人工湿地氨氧化细菌最多的属为Unclassified_o_Nitrosomonadales,即在科水平上未分类的Nitrosomonadales目细菌。本研究中Nitrosospira丰度高于于Nitrosomonas,表明Nitrosospira在硝化作用中的数量优势。Nitrosomonas青睐于低氨态氮环境,而Nitrosospira更适应高氨态氮的污染环境[22]。不同菌属的分布不同,Nitrosomonas属在7、8单元的丰度高于1~6单元,而Nitrosospira属在7、8单元的丰度低于1~6单元。
氨氧化古菌在淡水湿地生态系统氮循环过程中占有重要地位,但人们对其在氨氧化过程中的贡献的了解还不够充分[23]。在陆地生态系统中,氨氧化古菌的数量远远高于氨氧化细菌的数量,但是氨氧化古菌是酸性土壤硝化作用的主导者[24]。泉古菌门(Crenarchaeota)和奇古菌门(Thaumarchaeota)是古菌的2种门类, Crenarchaeota是氨氧化古菌的主要类群[25],但在洞庭湖岸边沉积物中,发现的AOA主要是属于Thaumarchaeota[26]。本研究的人工湿地中,AOA主要属于Crenarchaeota和Thaumarchaeota 2个门类,且以Crenarchaeota丰度占优。本研究中,不同湿地单元的AOB与AOA存在一定的群落差异性,4单元和5单元、1单元和6单元在AOB菌群组成上较为接近,而6、7、8单元与其他单元之间AOA菌群组成存在较大差异。
氨氧化微生物的多样性受沉积物多种环境因子的影响。AOB中丰度较大的Unclassified_o_Nitrosomonadales与pH值和NO-3-N含量呈正相关关系,其中与pH值的关系达到显著水平。本研究中,人工湿地沉积物pH值为7.97~8.34,为碱性。AOA中Nitrososphaera与pH值、C/N比值呈正相关关系,与TC、TN、OM、NH+4-N、NO-3-N含量呈负相关关系。
参考文献:
[1]HERNANDEZ M E, MITSCH W J. Denitrification in created riverine wetlands: Influence of hydrology and season[J]. Ecological Engineering, 2007, 30(1):78-88.
[2]崔丽娟,李伟,张曼胤,等. 复合人工湿地运行2年净化水禽污水效果[J]. 农业工程学报, 2011, 27(12):234-240.
[3]YE F X, YING L. Enhancement of nitrogen removal in towery hybrid constructed wetland to treat domestic wastewater for small rural communities[J]. Ecological Engineering, 2009, 35(7):1043-1050.
[4]SONG K, LEE S H, KANG H. Denitrification rates and community structure of denitrifying bacteria in newly constructed wetland[J]. European Journal of Soil Biology, 2011, 47(1):24-29.
[5]陈亮,刘锋,肖润林,等. 人工湿地氮去除关键功能微生物生态学研究进展[J]. 生态学报, 2017, 37(18):6265-6274.
[6]黄翔峰,谢良林,陆丽君,等. 人工湿地在冬季低温地区的应用研究进展[J]. 环境污染与防治, 2008, 30(11):84-89.
[7]彭焘,徐栋,贺锋,等. 人工湿地系统在寒冷地区的运行及维护[J]. 给水排水, 2007, 33(S1):82-87.
[8]吴海明. 表面流人工湿地处理北方污染河水的长期净化效果及相关机理研究[D]. 济南:山东大学, 2011.
[9]鲍士旦. 土壤农化分析 [M]. 3版.北京:高等教育出版社,2000.
[10]KUROLA J, SALKINOJASALONEN M, AARNIO T, et al. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil[J]. Fems Microbiology Letters, 2005, 250(1):33-38.
[11]ROTTHAUWE J H , WITZEL K P , LIESACK W . The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied & Environmental Microbiology, 1997, 63(12):4704-4712.
[12]莊林杰,夏超,田晴,等. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 2017, 37(1):261-271.
[13]郭志英, 贾仲君. 中国典型生态系统土壤硝化强度的整合分析[J].土壤学报, 2014, 51(6): 1317-1324.
[14]吕璐. 湖北省主要水稻产区水稻土硝化、反硝化潜势及其与铁、锰的关系[D]. 武汉:华中农业大学, 2017.
[15]ZHANG Y, CHEN L, DAI T, et al. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment: a microcosm study[J]. Applied Microbiology and Biotechnology, 2015, 99(22):9825-9833.
[16]张苗苗,王伯仁,李冬初,等. 长期施加氮肥及氧化钙调节对酸性土壤硝化作用及氨氧化微生物的影响[J]. 生态学报, 2015, 35(19):6362-6370.
[17]章芳,吴梦纤,王晓亮,等. 新疆玛纳斯湿地土壤细菌生理类群数量变化及其与土壤环境的相关分析[J]. 江苏农业科学, 2015, 43(8):327-332.
[18]刘丽,杨静,李成云.玉米-大豆间作对玉米根际氨氧化微生物的影响[J]. 江苏农业学报, 2017, 33(6) : 1278-1287
[19]丛耀辉,张玉玲,张玉龙,等. 黑土区水稻土有机氮组分及其对可矿化氮的贡献[J]. 土壤学报, 2016, 53(2):457-467.
[20]魏佳明. 表流湿地细菌及反硝化细菌群落结构研究[D]. 北京:中国林业科学研究院, 2017.
[21]魏琳琳,杨殿林,侯萌瑶,等. 氮高效转基因水稻OsNRT2.3b对土壤氨氧化细菌群落多样性的影响[J]. 农业环境科学学报, 2017,36(6):1149-1159.
[22]潘彦羽,代嫣然,王飞华,等. 东湖表层沉积物中氨氧化古菌和氨氧化细菌丰度及多样性研究[J]. 水生生物学报, 2018,42(2): 406-415.
[23]刘正辉. 氨氧化古菌及其对氮循环贡献的研究进展[J]. 微生物学通报, 2015, 42(4):774-782.
[24]李景云,李秀玲,葛鹏,等. 土壤氨氧化古菌及其可能代谢类型[J]. 土壤通报, 2015(6):1428-1432.
[25]刘晶静,吴伟祥,丁颖,等. 氨氧化古菌及其在氮循环中的重要作用[J]. 应用生态学报, 2010, 21(8): 2154-2160.
[26]周磊榴,祝贵兵,王衫允,等. 洞庭湖岸边带沉积物氨氧化古菌的丰度、多样性及对氨氧化的贡献[J]. 环境科学学报, 2013, 33(6):1741-1747.
(责任编辑:张震林)

